Введение
Назначение пробиотических препаратов (ПП) с профилактической или лечебной целью подразумевает непосредственную коррекцию нарушенной нормальной микрофлоры человека. Высокая частота возникновения дисбиотических состояний различного генеза среди детей и взрослого населения России определяет существенную потребность практической медицины в препаратах, корригирующих нарушенную нормальную микрофлору кишечника человека. Нормофлора, или микробиота, человека представляет собой эволюционно сложившуюся экологическую систему разнообразных микроорганизмов, населяющих открытые полости организма и поддерживающих биохимическое, метаболическое, иммунологическое равновесие, необходимое для сохранения здоровья [8]. Микробные сообщества образуют биоценоз определенного биотопа и вместе с организмом хозяина формируют постоянные или временные экосистемы. Внутри экосистем популяции и сообщества микроорганизмов занимают свои экологические ниши, колонизируя слизистые облочки (СО) в виде бактериальных биопленок.
Методами сканирующей и трансмиссионной электронной микроскопии установлено, что биопленки однородных и смешанных микробных сообществ различных видов энтеробактерий и стафилококков, развивающиеся in vivo или in vitro на агаризованной среде, идентичны по своему строению. Поверхностные структуры биопленок экранируют клетки, обеспечивают их контакт с внешней средой, повышают их устойчивость к различным повреждающим факторам. Идентичность ультратонкого строения биопленок, развивающихся на биотических или абиотических поверхностях, свидетельствует об универсальности защиты микробных клеток индигенной микрофлоры, что является важным свойством для гомеостаза макроорганизма, функциональная активность которого тесным образом связана с населяющими его желудочно-кишечный тракт (ЖКТ) сообществами микроорганизмов. Фрагменты бактерильных биопленок представлены на рис. 1, 2.
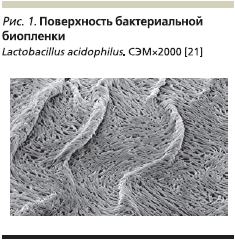
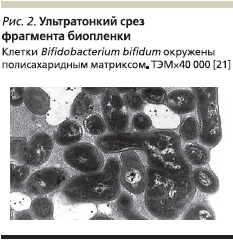
Хорошо известна важная роль иммунной системы СО и ассоциированной с ней лимфоидной ткани в осуществлении барьерного и иммунорегуляторного гомеостаза макроорганизма. Поверхности СО покрыты слоем эпителиальных клеток и слизью, предотвращающими попадание экзогенных антигенов в организм. Эпителиальные клетки формируют физический барьер за счет движения ресничек, продукции слизи, секреции молекул с антибактериальной и цитолитической активностью (дефенсины, лактоферрин, лизоцим и др.). В совокупности эти врожденные механизмы в ассоциации с нормальной микрофлорой обеспечивают первую линию защиты против возбудителей инфекционных заболеваний, чужеродных антигенов и аллергенов. Иммунный ответ СО кишечника обеспечивается защитной системой, известной как GALT (gut-associated lymphoid tissue – лимфоидная ткань, ассоциированная с ЖКТ), которая начинает обнаруживаться в ЖКТ c первых дней жизни ребенка и после периода сукцессии (смены сообществ), занимающего, по данным различных исследователей, до двух лет, становится полностью сформировавшейся [14, 17, 27].
GALT выполняет три важнейшие функции:
• защищает СО от колонизации и инвазии потенциально опасными патогенами;
• препятствует захвату нерасщепленных антигенов, включая белки перевариваемой пищи и микроорганизмы комменсалы;
• предотвращает развитие потенциально вредного иммунного ответа на эти антигены.
В GALT принято выделять два участка: индуктивный (лимфоидная ткань) и эффекторный (непосредственно СО). В индуктивной зоне протекают процессы иммунологического распознавания, презентации антигена при участии макрофагов и дендритных клеток, формируется популяция антигенспецифических лимфоцитов. В эффекторной зоне происходит реализация иммунного ответа при участии Т- и В-лимфоцитов и антител внешних секретов. При определенных условиях иммунный ответ может быть индуцирован и в интерстициальном эпителии [27].
Существуют специфические Tolllike-рецепторы (TLR), которые можно назвать сигнальными. Они распознают чужеродные консервативные структуры (лиганды), оповещают об их приходе и запускают каскад реакций, обеспечивающих активацию транскрипционного ядерного фактора κB. Активация NF-κB представлена на схеме, адаптированной по А.Н. Маянскому и соавт. (рис. 3) [16].
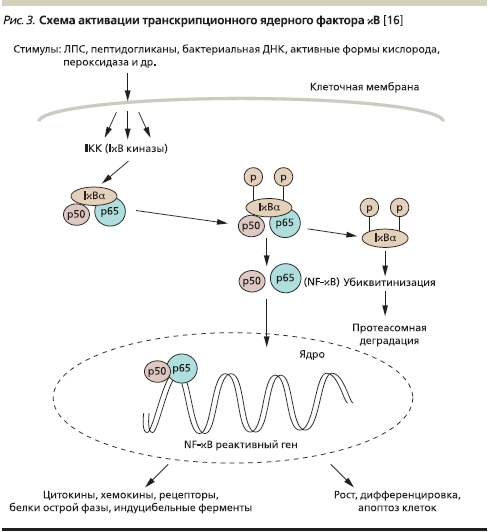
Кроме того, происходит образование ряда соединений, главной функцией которых является обеспечение реакций врожденного иммунитета. В то же время реакции, индуцированные TLR, способствуют развитию адаптивного иммунитета [7, 13].
Микробные сообщества образуют биоценоз определенного биотопа и вместе с организмом хозяина формируют постоянные или временные экосистемы. Внутри экосистем популяции и сообщества микроорганизмов занимают свои экологические ниши. Наибольшее внимание врачей, ученых и широких кругов общественности привлекает в настоящее время кишечный микробиоценоз, т. е. совокупность микробного населения кишечника [8, 23]. Это один из наиболее многочисленных микробиоценозов, представленный разнообразными анаэробными и аэробными грамположительными и грамотрицательными микроорганизмами, наибольшее количество которых обнаруживается в толстой кишке человека.
Для обозначения всего генетического материала, содержащегося в микробиоте организма человека, принят термин “микробиом”, предложенный лауреатом Нобелевской премии Д. Ледербергом. В последние годы появилось такое понятие, как “метагеном” (включающий гены как человека, так и триллионов микроорганизмов микробиоты), а также понятия “протеом” (совокупность белков) и “метаболом” (совокупность метаболических процессов). Национальным институтом здоровья (NIH, USA) рассчитано, что не более чем 10 % клеток человека являются дискретными клетками Homo sapiens, в то время как остальные клетки относятся к микробиоте [45]. Следует отметить, что число генов в микробиоме на три порядка выше, чем генов организма человека, и это послужило основанием рассматривать совокупность всех микроорганизмов в качестве “суперорганизма”. Ранее было рассчитано, что популяционный уровень Escherichia coli в организме каждого человека равен количеству всего населения Земли, насчитывающего 6 млрд [51]. Полагают, что нормофлора функционирует в составе биопленок, сбалансированных по видовому составу. В составе биопленок микробные клетки лучше защищены от повреждающего действия различных стресс-индуцируемых факторов, включая этиотропную терапию [20, 21, 32].
Для человека характерно изменение биотопа кишечника в онтогенезе, связанное с явлением естественной сукцессии нормальной микрофлоры. Аутогенная сукцессия – это последовательность смены биоценозов в определенной экологической нише. В ходе этого процесса в видовом сообществе происходит вытеснение одних видов другими вследствие их биоэкологических преимуществ в определенных условиях. При этом образуется т. н. сукцессионный ряд с образованием конечного – устойчивого – биоценоза. Аутогенная сукцессия затрагивает первые 2 года жизни человека и проходит 4 стадии: 1-я – до введения прикорма, 2-я – после появления прикорма, 3-я – после включения в рацион твердой пищи, 4-я – после прекращения грудного вскармливания. Помимо этого изменения в составе микрофлоры совпадают с критическими периодами развития в детском и подростковом возрасте: становлением иммунной и ферментативной систем, изменением гормонального фона, сменой пищевого рациона. В то же время микробиоценоз взрослых людей относительно стабилен [19, 23].
Изучение микробного пейзажа у детей и взрослых показало, что бифидобактерии в кишечнике здорового человека представлены сразу несколькими видами, каждый из которых имеет свои биохимические и физиологические особенности. Вид B. bifidum выявляется у здоровых людей всех возрастных групп; у детей на грудном вскармливании он является преобладающим и выделяется среди 70 % обследованных, у детей 4–6 лет – до 40 % и у взрослых – до 15–20 %. Вид B. longum также характерен для детей и взрослых, выделяясь у 40–60 % детей первого года жизни, 70–75 % детей старшего возраста и взрослых людей среднего возраста; у пожилых он выделяется в 30 % случаев. Вид B. adolescentis свойствен взрослым людям и детям старшего возраста; обнаруживается у них в 60–65 % случаев. Этот вид становится преобладающим для пожилых (85 %). Виды B. Infantis, B. breve, B. animalis и их подвиды обнаруживаются преимущественно среди детей грудного возраста. Указанные виды бактерий характерны для детей и взрослых различных рас и географических мест проживания с небольшим разнообразием энтеротипов, зависимых от вида потребляемых пищевых продуктов [11, 17, 30].
Помимо бифидобактерий важную роль в поддержании симбиотных отношений между макроорганизмом и его микрофлорой, а также в регуляции межмикробных взаимоотношений принадлежит бактериям рода Lactobacillus, заселяющим организм новорожденного ребенка в раннем постнатальном периоде. Лактобациллы присутствуют во всех отделах пищеварительного тракта, начиная с полости рта и заканчивая толстой кишкой, являются доминирующей флорой влагалища, выявляются в грудном молоке. В полости рта здоровых людей обнаруживают, как правило, семь видов лактобацилл. В желудочном соке общее количество лактобацилл может достигать 103, в содержимом тощей кишки – до 104, подвздошной кишке – от 102 до 105, а в фекалиях – от 106 до 1010 КОЕ/мл в зависимости от возраста [8, 21].
Позитивная роль микробиоты состоит в обеспечении колонизационной резистентности ЖКТ, иммуномодулирующем, антимутагенном и антиканцерогенном действиях, участии в метаболических процессах, регуляции роста эпителиоцитов, защите СО от повреждений и регуляции местной толерантности [7, 8, 19].
Нарушение микробной экологии кишечника принято обозначать термином “дисбактериоз”. Согласно ОСТу Минздрава РФ, “дисбактериоз кишечника – это клинико-лабораторный синдром, возникающий при ряде заболеваний, характеризующийся изменением качественного и количественного состава нормофлоры, а также метаболическими и иммунными нарушениями, сопровождающимися у части пациентов поражением кишечника, транслокацией бактерий в несвойственные биотопы и их избыточным ростом” (Протокол ведения больных. Дисбактериоз кишечника ОСТ 91500.11.0004. Приказ МЗ РФ № 231 от 09.06.2003).
Известно, что увеличение числа лиц с иммунодефицитными состояниями ведет к нарастанию частоты инфекционных процессов, вызываемых условно-патогенными микроорганизмами (УПМ). Увеличение заболеваемости тесным образом связано с широким распространением микроэкологических нарушений со стороны кишечника, неуклонным ростом числа больных, страдающих хроническими воспалительными заболевания ЖКТ, включая гастриты, язвенную болезнь желудка и двенадцатиперстной кишки, панкреатиты, гепатиты и холециститы, а также воспалительные процессы урогенитального и респираторного трактов [3, 8, 21]. Определенное значение имеют атеросклероз, астма, бесплодие, ожирение, подагра, остеохондроз, поражение суставов, остеопороз, диабет и некоторые онкологические заболевания, сопровождающиеся дисбиозами [3, 7, 8, 23, 52]. Положение о том, что в основе многих хронических патологических процессов лежат воспаление, срыв оральной толерантности и цитокиновый дисбаланс, в последнее десятилетие широко обсуждается на различных медицинских форумах и симпозиумах. Решение этой проблемы тесно связано с научными достижениями по изучению состава и функции “суперорганизма” (микробиоты, разработкой более эффективных ПП.
Полагают, что благодаря координированной работе эволюционно сложившихся систем регуляции симбиоза осуществляется согласованное взаимодействие генов эукариотических клеток и геномов многочисленных симбиотических микроорганизмов [44, 45]. Процесс внутрипопуляционного информационного обмена бактериальных клеток между собой получил название “Quorum Sensing” (QS; чувство кворума) и представляет собой специфический вариант регуляции экспрессии генов, т. е. механизм, посредством которого микроорганизмы способны осваивать окружающую их среду – человеческий организм [40, 41]. Взаимодействие микроорганизмов друг с другом и с клетками хозяина происходит через низкомолекулярные сигнальные молекулы, называемые аутоиндукторами. Благодаря аутоиндукторам бактерии обмениваются информацией и координируют свою деятельность. Исследования последних лет показали, что микроорганизмы синтезируют и распознают широкий спектр аутоиндукторов различной химической природы.
В связи с этим важным являются поиск и расшифровка механизма действия новых оригинальных метаболитов и сигнальных молекул, стимулирующих рост и разитие собственных индигенных микроорганизмов, стабилизирующих нормобиоценоз. В этом плане интерес представляют разработки препаратов, стимулирующих биопленкообразование индигенных микроорганизмов, зависимое от функции QS-системы, контролирующей плотность популяции в биотопе [21, 40, 41]. Определенное значение имеет и мишень-опосредованный способ доставки лекарственных форм пробиотиков, обозначаемый как таргетированный [44]. Познание методов управления единой симбиотической системой “микробиота–макроорганизм” играет первостепенную роль в плане укрепления популяционного здоровья и оптимального долголетия населения [7, 11, 19, 23, 52, 54].
Следует отметить, что многие гнойно-воспалительные инфекции часто возникают у пациентов со сниженной резистентностью макроорганизма. Больные обращаются за медицинской помощью и поступают в различные стационары, как правило, уже с сформировавшимися иммунными и микроэкологическими нарушениями. Микробиота находится в состоянии нового “ассоциативного симбиоза” [3, 7, 10]. Полагают, что в этом процессе на фоне утраты способности организма различать “свой–чужой” осуществляется замена биопленок индигенной микрофлоры организма хозяина на смешанные полимикробные биопленки УПМ. В результате такой трансформации формируется локальный инфекционный очаг, который впоследствии может перейти в генерализованную форму путем трансинтестинальной транслокации микроорганизмов и их токсинов в лимфатическое и кровеносное русло с возникновением дополнительных очагов и суперинфекций различной локализации [3, 8]. Наиболее часто очаги эндогенной инфекции формируются в кишечном, урогенитальном и респираторном трактах и обусловлены полиантибиотикорезистентными штаммами бактерий родов Staphylococcus, Enterococcus, Klebsiella, Escherichia, Enterobacter, Citrobacter, Hafnia, Serratia, Providencia, Morganella, Proteus, Pseudomonas, Acinetobacter, Streptococcus, грибами родов Candidaи Geotrichium. Среди ВИЧ-инфицированных больных зарегистрированы случаи инфекционного процесса, вызванные даже такими представителями индигенной нормальной микрофлоры, как Bifodobacterium и Lactobacillus spp. Наиболее тяжело протекают оппортунистические инфекционные процессы, возникающие на фоне таких основных соматических патологий, как опухоли, спаечная болезнь кишечника, нейроэндокринные и генетические заболевания с выраженными вторичными иммунодефицитами. Возможно сочетание микстинфекции с наличием микологических, глистных и паразитарных заболеваний у лиц с лучевой болезнью и при суперинфекциях (хламидиоз, микоплазмоз, уреаплазмоз, герпес-, рота-, корона- и цитомегаловирусная инфекции, вирусные гепатиты, туберкулез, сифилис). Поэтому в случае обнаружения мультирезистентных бактериальных ассоциаций УПМ больным рекомендуется проведение дополнительных целевых микробиологических, вирусологических, иммунологических и паразитологических исследований для исключения вышеуказанных суперинфекций, паразитозов и различных иммунодефицитных состояний, что в большинстве случаев позволяет проводить правильную диагностику и адекватное лечение основных заболеваний и сопутствующих микроэкологических нарушений [3, 8]. Усугубление заболевания может происходить при назначении этиотропной химиотерапии, подавляющей нормальную микрофлору. При микроэкологических нарушениях могут проявляться признаки энцефалопатии, аллергопатологии, в частности возникновение атопического дерматита и нейродермитов, степень выраженности которых в разных случаях различна [3, 8, 22]. Выявлено, что при этиотропной терапии на фоне дефицита индигенной микрофлры кишечника может развиваться псевдомембранозный колит, вызванный Clostridium difficili (рис. 4).
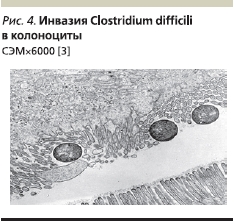
Для стандартизации диагностики, лечения и профилактики дисбактериоза в Российской Федерации разработан указанный ранее Протокол ведения больных. Дисбактериоз кишечника (ОСТ 91500.11.0004. Приказ МЗ РФ № 231 от 09.06.2003), в котором изложена характеристика важнейших представителей микробиоты человека, описаны модели пациентов при различных стадиях и фазах развития дисбактериоза, включая клинические и лабораторные критерии их оценки, рекомендованы ПП для восстановления микрофлоры из числа зарегистрированных для использования в медицинской практике РФ.
Препараты с пробиотическим механизмом действия
Для восстановления нарушенного микробиоценоза открытых полостей организма используются препараты, подразделенные на про-, пре-, син- и метабиотики.
Пробиотики – это живые микроорганизмы и вещества микробного происхождения, оказывающие при естественном способе введения позитивные эффекты на физиологические, биохимические и иммунные реакции организма хозяина через стабилизацию и оптимизацию функции его нормальной микрофлоры. Аналогичную дефиницию предложили и эксперты ВОЗ: “пробиотики – это живые микроорганизмы, которые при употреблении в необходимом количестве, оказывают благоприятное воздействие на здоровье организма хозяина” [11].
Пребиотики – это препараты немикробного происхождения, способные оказывать позитивный эффект на организм хозяина через селективную стимуляцию роста или метаболической активности нормальной микрофлоры кишечника. В эту группу входят препараты, относящиеся к различным фармакотерапевтическим группам, но обладающие общим свойством – стимулирововать рост нормальной микрофлоры кишечника.
Синбиотики – это препараты, полученные путем рациональной комбинации пробиотиков с пребиотиками. Ряд синбиотиков являются биологически активными добавками к пище (БАД) и содержат живые бактерии определенных видов, различные полезные для поддержания здоровья человека ингредиенты.
Метабиотики – препараты, содержащие микробные метаболиты, которые в совокупности с компонентами бактериальных поверхностных и цитоплазматических структур, ДНК и органическими кислотами оказывают лечебный эффект путем нормализации состава микробиоты кишечника и восстановления водно-электролитного баланса организма хозяина [2, 4–6, 28].
Механизм действия ПП
Наиболее важным свойством пробиотических бактерий является обеспечение колонизационной резистентности, т. е. защиты кишечной стенки от проникновения во внутреннюю среду организма как бактерий, так и токсинов и токсических продуктов различного происхождения. В комплексе механизмов колонизационной резистентности важную роль играет антагонистическая активность пробиотической культуры, ее способность колонизировать СО, которая складывается из адгезии микроорганизмов к эпителиальным клеткам кишечника, конкуренции за рецепторы связывания и блокады адгезии и колонизации СО патогенными микробами и УПМ с участием гуморальных и клеточных факторов зашиты макроорганизма [6, 39].
Роль адгезинов у разных микроорганизмов выполняют поверхностно расположенные фимбрии, антигены белковой или полисахаридной природы, липотейхоевые кислоты, фосфолипиды и др. Процесс адгезии позволяет микробам удерживаться в определенной нише, что обеспечивает возможность эффективной колонизации СО симбионтами. Следовательно, одним из способов предотвращения колонизации кишечника патогеном является подавление его прикрепления путем насыщения эпителиальных рецепторов лигандами адгезии симбионтов. Как показали исследования, процесс адгезии лактобацилл и бифидобактерий к кишечному эпителию происходит за счет фимбриоподобных структур и компонентов клеточной стенки, по-видимому, белков наружной мембраны и липотейхоевой кислоты. Антагонистическое действие пробиотических бактерий связано также с продукцией органических кислот, бактериоцинов и ингибиторных протеинов, в т. ч. термолабильных и термостабильных высоко- и низкомолекулярных антибактериальных субстанций и антибиотиков. Органические кислоты являются конечным продуктом метаболизма, которые экскретируются в окружающую среду. Это молочная, уксусная, масляная, пропионовая, изомасляная, изовалериановая, муравьиная, сукциниловая, янтарная и другие кислоты. Антимикробный эффект молочной и уксусной кислот хорошо изучен. Кислоты проникают через мембрану, выделяют ион гидроокиси в нейтральную цитоплазму, что приводит к подавлению жизненных функций клетки. Так, уксусная кислота при рН выше 4,5 проявляет более выраженный, чем молочная кислота, ингибирующий эффект и, наоборот, при рН ниже 4,0 более сильная антимикробная активность наблюдается у молочной кислоты. Подавляющее действие оказывают перекись водорода и диацетил. Обе эти субстанции обладают антимикробной активностью в отношении широкого круга патогенных микроорганизмов и УПМ.
Важную роль играют бактериоцины – биологически активные вещества белковой природы. Известно два типа бактериоцинов: высокомолекулярные, подавляющие в основном близкородственные виды бактерий, обитающие в той же экологической нише, и низкомолекулярные вещества – микроцины, характеризующиеся широким спектром антагонистической активности. Эти субстанции хорошо изучены. Они достаточно стабильны при температуре 100 οС, активны при кислой рН и проявляют антимикробную активность в отношении многих видов энтеробактерий, вибрионов, стрепто- и стафилококков [20, 47–48].
Важную роль лактобациллы, бифидобактерии и энтерококки играют в активации фагоцитарной и цитостатической активности макрофагов, стимуляции лимфоидной ткани, воздействии на иммунокомпетентные Т- и В-клетки. Вырабатывающиеся в кишечнике иммуноглобулины включаются в сложный механизм контроля кишечных микроорганизмов, в т. ч. патогенных, осуществляемый через блокирование прикрепления их к эпителию СО, нейтрализации путем агглютинации, бактериостаза и других бактерицидных механизмов с последующей их элиминацией из кишечника.
Предполагают, что секреторные иммуноглобулины выполняют важную роль в местном иммунитете кишечника: IgA1-антитела за счет тяжелых цепей, имеющих химическое сродство с мукозой, обеспечивают формирование монослоя иммуноглобулинов на поверхности СО. Иммуноглобулины субкласса IgA2, не имея родства с СО, поступают в просвет кишечника и действуют как первое звено иммунной защиты, при этом лактобациллы и бифидобактерии в отличие от эшерихиозной микрофлоры, как правило, не покрыты иммуноглобулинами. Показано, что прием пробиотиков способствует значительному увеличению относительного и абсолютного числа В-лимфоцитов при снижении относительного и абсолютного числа Т-лимфоцитов. Важная роль микрофлоры в развитии иммунного ответа обусловлена ее универсальными иммуномодулирующими свойствами, включающими как иммуностимуляцию, так и иммуносупрессию [7, 27, 39, 43]. Бактериальные липополисахариды и пептидогликаны, входящие в состав клеточной стенки различных видов нормофлоры, оказывают иммунорегулирующее действие. Поэтому ПП назначают как в острый период заболевания, так и в период реконвалесценции в связи с их способностью оказывать антагонистическое действие на возбудителей инфекции и стимулировать природный иммунитет.
Характеристика производственных штаммов
В настоящее время пробиотики выпускаются в следующих лекарственных формах:
• лиофильно высушенная биомасса во флаконах или ампулах;
• лиофильно высушенная биомасса в желатиновых капсулах и капсулах, покрытых кишечнорастворимой оболочкой;
• жидкая суспензия живых пробиотических бактерий;
• суппозитории ректальные и вагинальные с лиофильно высушенной биомассой;
• лиофильно высушенная биомасса, прессованная в таблетки, покрытые оболочкой, растворимой в кишечнике;
• лингвальные таблетки, рассасываемые под языком.
Нетрадиционная лекарственная форма пробиотиков, примененная еще И.И. Мечниковым, эффективна в ряде клинических случаев: кисло-молочный продукт, полученный при сквашивании молока пробиотическим штаммом.
Следует отметить, что пробиотики, содержащие лиофильно высушенную биомассу, сохраняют лечебные свойства при значительно большем сроке хранения, чем жидкие суспензии. В настоящее время производственные бактерии, входящие в состав ПП, предложено характеризовать по наличию факторов адаптации и пробиотической активности, дополненных степенью выраженности иммуномодулирующих свойств и спектром восстанавливаемых регуляторных метаболических функций макроорганизма, включая нормализацию процессов электролитного обмена, окислительного фосфорилирования и регенерацию поврежденных клеток.
За адаптацию интродуцента ответственны факторы, позволяющие бактериям прикрепляться к эпителию и колонизировать СО кишечника, конкурируя с биопленкой индигенной микрофлоры, что непосредственно связано со сроками их персистенции, длительностью поддержания микробного баланса нормальной флоры и обеспечением временной защиты энтероцитов и колоноцитов от повреждения [7, 38–40, 49].
К факторам, участвующим в процессе адаптации, следует относить адгезины, органические кислоты, бактериоцины, факторы, ответственные за биопленкообразование, и сигнальные молекулы системы QS [39–42].
Пробиотическая способность связана с локальной конкуренцией/кооперацией в отношении нутриентов, активацией синтеза антимикробных факторов СО, восстановлением межмикробных коммуникаций и иммуномодулирующим действием. К факторам пробиотической активности интродуцента можно отнести биомолекулы различных белков, пептиды, ДНК и оригинальные метаболиты, включая короткоцепочечые жирные кислоты, способствующие восстановлению “рабочего” состояния микробиоты [2–, 26–9, 31].
В совокупности указанные характеристики обеспечивают клинический эффект вводимых пробиотических бактерий, связанный с процессом восстановления нарушенных микроэкологии и локального природного иммунитета кишечного биотопа, способствующих подавлению роста УПМ и усилению защитного транслокационного барьера СО, препятствующего проникновению во внутреннюю среду различного типа бактериальных токсинов, включая эндотоксин.
Наиболее известные и изученные производственные штаммы, входящие в состав пробиотиков
Lactobacillus rhamnosus GG (LGG)
Бактерии LGG были получены американскими исследователями S. Gorbach и В. Goldin [34]. При оценке безопасности штамма установлено отсутствие у бактерий способности вызывать системную инфекцию, неблагоприятные изменения метаболической активности, чрезмерную иммунную стимуляцию у добровольцев, переноса генов in vitro. Было показано, что перорально вводимые LGG сохраняются в кишечнике не более одной недели [49, 50].
В настоящее время LGG – один из самых изученных штаммов в мире (более 400 различных исследований) [53]. Проведено 14 рандомизированных двойных слепых плацебо-контролируемых исследования по применению LGG [37].
Недавно при сравнении нуклеотидных фрагментов геномов бактерий LGG и L. rhamnosus LC705 было показано, что их штамм-специфические гены (80 для LGG и 72 для LC705) входили в состав 5 и 4 геномных “островов” соответственно. Геномные “острова” LGG включали гены бактериофагов, метаболизма и транспорта углеводов, синтеза экзополисахарида. Только у бактерий LGG один из “островов” кодировал синтез трех LPXTG-подобных муцин-связывающих пилей адгезии (spaCBA) и пили-ассоциированной сортазы [38]. Наличие у LGG муцин-связывающих пилей адгезии обеспечивает прикрепление бактерий к СО кишечника и ее колонизацию. Ранее было показано, что лактобациллы штамма LGG синтезируют органические кислоты, бактериоциноподобные и иммуномодулирующие вещества, а также ферменты, способствующие пищеварению и улучшающие обмен веществ. ПП, содержащие LGG, применяют в комплексном лечении больных неспецифическим язвенным колитом; соматическими заболеваниями, осложненными дисбактериозами. Больным, перенесшим острые кишечные инфекции, при наличии дисфункций кишечника в случае выделения патогенной микрофлоры и УПМ такие препараты назначают для быстрого восстановления рН в кишечнике. Клинический эффект LGG используется при терапии некротизирующего энтероколита (Dai, Walker, 1998), различных воспалительных процессах в кишечнике (Steidler и соавт., 2001), псевдомембранозном колите, вызванном C. difficile на фоне эрадикации H. pylori [30], ротавирусной инфекции и атопическом дерматите у детей [35, 36]. При использовании LGG и B. lactisВВ-12 (Gundalini и соавт., 2000) наблюдали подавление транслокации микроорганизмов и их токсинов из просвета кишечника во внутреннюю среду организма; стимуляцию и усиление иммунного ответа, снижение местной воспалительной реакции, доставку микробной лактазы в тонкий кишечник, деконьюгирование желчных кислот. Информация о клиническом эффекте пробиотиков широко освещена в литературе [1–6, 15, 22–26, 33–36]. Использование LGG рекомендовано ESPGHAN/ESPID для лечения острых инфекционных диарей у детей (уровень доказательности 1а) [55].
Пробиотические штаммы энтерококков
Энтерококки являются представителем нормальной микрофлоры человека и характеризуются высокой степенью интеграции в различные биотопы открытых полостей организма хозяина. Они одними из первых колонизируют ЖКТ ребенка, в норме обнаруживаются во всех отделах кишечника здоровых людей всех возрастов, используются при изготовлении пищевых продуктов и лечебных ПП. В то же время бактерии E. faecalis и E. faecium, несущие гены вирулентности, при снижении резистентности организма нередко инициируют серьезные инфекционные гнойно-воспалительные процессы [9, 24]. Потенциальная патогенность (вирулентность) энтерококков вызывает существенную озабоченность в плане безопасности их клинического применения. Под патогенностью принято понимать способность возбудителя вызывать инфекционный процесс, вирулентность же – это степень патогенности определенного штамма. Нами с помощью полимеразной цепной реакции было исследовано три штамма E. faecium, входящих в состав пробиотических препаратов Линекс (Лек, Словения), Бифиформ (Ферросан, Дания) и Ламинолакт (Авена, Россия). При сравнительном анализе с патогенными клиническими штаммами в геноме всех трех пробиотических культур E. faecium не удалось обнаружить ни одного из 8 тестируемых генов вирулентности, контролирующих синтез адгезинов (asa1, esp, efaA), цитолизинов (cylA, cylM), протеолитических ферментов (желатиназы – gelE, и сериновой протеиназы – spr) и fsr регулятора, что подтверждает данные об их безопасности [9].
Пробиотическиештаммы Bifidobacterium lactis BB-12 и Streptococcus thermophilus TH-4
Комбинация B. lactis BB-12 и S. thermophilus TH-4 используется в молочной индустрии с 1984 г. С 2002 г. эти штаммы разрешены к применению детьми раннего возраста. За 25 лет использования не было получено данных об их непереносимости и побочных эффектах. Бактерии B. Lactis ВВ-12 продуцируют антибиотикоподобные субстанции, совместимы с индигенной бифидофлорой, усиливают в биотопе синтез секретоных IgA антител. Штамм B. lactis ВВ-12 имеет статус GRAS (Generally Regarded As Safe). Безопасен при использовании с момента рождения. Интересным является наблюдение за тем, что адгезивная и колонизирующая активность B. lactis BB-12 усиливается в присутствии бактерий S. thermophilus TH-4, эффективных при лактазной недостаточности [36].
Вопросы выбора оптимальной пробиотической терапии
В первую очередь при выборе пробиотика необходимо учитывать возрастные этапы формирования видового состава кишечного микробиоценоза и потребности, обусловленные именно возрастом пациента.
Зарегистрированные в РФ лекарственные ПП приведены в табл. 1.
Это, в частности, монокомпонентные ПП, содержащие живые бактерии, относящиеся к представителям нормальных симбионтов (эшерихии, бифидобактерии, лактобациллы, энтерококки и др.), или самоэлиминирующие антагонисты (B. subtilis, B. licheniformis, Saccharomyces boulardii). К числу указанных ПП относятся Колибактерин, Бифидумбактерин, Лактобактерии, Энтерол, Бактисубтил, Споробактерин. К комбинированным ПП относится Кипацид, содержащий L. acidophilus и комплексный иммуноглобулин; Бифилиз, включающий В. bifidum 1 и лизоцим.
Сорбированные ПП – это Бифидумбактерин форте и Пробифор, содержащие иммобилизованные на активированном угле жизнеспособные бактерии B. bifidum; Флорин форте, представляющий собой иммобилизованные на активированном угле жизнеспособные бактерии B. Bifidum и планктонные L. plantarum 8PA-3); Бифиформ капсулы кишечнорастворимые (B. longum, E. faecium и питательная пребиотическая среда), Бифиформ Малыш (L. rhamnosus GG, B. lactis BB-12, витамины В1, B6 и фруктоолигосахарид). Поликомпонентными ПП являются Бифилонг, Ацилакт, Бифиформ Бэби, Аципол (L. acidophilus и полисахарид кефирных грибков) и Линекс.
При анализе результатов опроса российских врачей-специалистов, применявших пробиотики, большинство отметили принципиальную важность индивидуального подхода к каждой возрастной категории страдающих дисбактериозом пациентов. Иными словами, действующее вещество – штаммы бактерий нормальной флоры – должны максимально соответствовать возрастным физиологическим нормам. Не менее важной, особенно для детей, респонденты посчитали форму выпуска бактерийных препаратов [1, 3].
В Российской Федерации представлены пробиотические комплексы Бифиформ, разработанные для детей различных возрастных групп и взрослых. Бифиформ Бэби – пробиотическая суспензия для детей с первых дней жизни (B. lactis BB-12 – 108 КОЕ и S. thermophilus TH-4 – 107 КОЕ) – биологически активная добавка к пище. Бифиформ Малыш (B. lactis BB-12 – 109 КОЕ, L. rhamnosus GG – 109 КОЕ, витамины В1, B6 и фруктоолигосахарид) – синбиотик, биологически активная добавка к пище, выпускается в виде порошков/саше для детей с 1 года; Бифиформ Малыш в виде жевательных таблеток для детей с 2 лет (B. lactis BB-12 – 108 КОЕ, L. rhamnosus GG – 108 КОЕ, витамины В1, B6 и фруктоолигосахарид). Бифиформ капсулы кишечнорастворимые – комбинированный пробиотик для взрослых и детей старше 2 лет, содержащий жизнеспособные бактерии производственных штаммов B. longum – 107 КОЕ, E. faecium – 107 КОЕ и специальную питательную пребиотическую среду. Кишечнорастворимая капсула позволяет доставлять полезные бактерии именно в кишечник, защищая их от неблагоприятного воздействия кислой среды желудка.
Ряд клиницистов отмечают, что эффект пробиотикотерапии зависит от того, какой штамм и какого вида микроорганизмов положен в основу пробиотика, каковы форма применяемого препарата и метод его введения в организм пациента, насколько пробиотический штамм соответствует возрастным физиологическим нормам. Кроме того, эффект пробиотикотерапии определяется иммунным статусом пациента, нозологией заболевания, остротой течения процесса. В отельных случаях применение пробиотиков можно сочетать с назначением иммуномодулирующих препаратов.
В связи с наличием выраженной конкуренции за рецепторы адгезии между пробиотическими бактериями интродуцируемого ПП и дисбиозными УПМ при сформировавшихся стойких очагах эндогенной и экзогенной инфекций пробиотикотерапия может не дать заметных положительных результатов из-за невозможности дезорганизовать бактериальную биопленку ассоциантов-возбудителей воспалительного процесса. В этом случае наблюдаются рецидивы, требующие индивидуальной коррекции нарушенной нормальной микрофлоры больного.
В связи со сложным этиопатогенезом дисбактериоза кишечника для коррекции микроэкологических нарушений применяют комплексное лечение, направленное в первую очередь на ликвидацию и санацию всех выявленных первичных и вторичных очагов эндогенной и экзогенной инфекций, восстановление физиологических функций и структуры поврежденных органов, систем организма пациента (включая коррекцию моторной, секреторной и пищеварительной функций кишечника, энтеросорбцию, энтеропротекцию и т. д.), а также иммунного гомеостаза, витаминно-минерального баланса, сбалансированного функционального питания и т. д.
В последнее время в связи с неблагоприятной социально-экономической и экологической обстановкой наблюдается не только широкое и повсеместное распространение дисбактериозов и вторичных иммунодефицитов среди населения, но и его выраженная аллергизация. Дисбактериозы, аллергизация и иммунодефицитные состояния неблагоприятно влияют на длительность и тяжесть острых и хронических воспалительных заболеваний, усложняют и удорожают диагностику и лечение основной соматической патологии. Такие патологические состояния можно рассматривать как инфекционно-аллергические заболевания, возникающие в результате патогенного воздействия ассоциаций дисбиозных микроорганизмов на организм хозяина и характеризующиеся признаками инфекционных процессов.
Стратегия и тактика назначения ПП
Практикующие врачи разного профиля часто на конференциях задают следующие пять вопросов:
• связан ли эффект действия пробиотиков с приживлением пробиотических бактерий на СО кишечника;
• обладают ли биологической активностью метаболиты пробиотических бактерий;
• связано ли клиническое действие пробиотиков с их иммуномодулирующей активностью;
• нужна ли для реализации действия пробиотиков их способность взаимодействовать с Toll-подобными рецепторами;
• существует ли зависимость клинического эффекта от пробиотического штамма?
Ответы на все эти вопросы положительные:
1. Возможна ситуация, когда после перорального введения живые пробиотические бактерии приживаются на СО, и тем самым достигается нормализация кишечной микрофлоры.
2. Позитивное действие пробиотиков на организм может быть связано с конкуренцией за рецепторы адгезии на эпителии, подавлением роста патогенов за счет синтеза различных антимикробных веществ, ингибированием транслокации микроорганизмов и их токсинов из просвета кишечника в кровоток.
3. В действии живых пробиотических бактерий могут принимать участие их метаболиты, обладающие биологической активностью.
4. Клиническое действие пробиотиков связано в т. ч. и с их иммуностимулирующей активностью. Показано, что для реализации модулирующего действия пробиотиков необходим контакт их лигандов (агонистов) с Toll-подобными рецепторами. При этом контакт может быть обусловлен как живыми бактериальными клетками, так и их структурными компонентами.
5. Особенности позитивного эффекта разных ПП могут быть обусловлены различиями иммуномодулирующих свойств отдельных пробиотических штаммов: это уровни повышения параметров Т- и В-клеточного иммунитета, степень увеличения авидности антител сыворотки крови к связыванию антигенов УПМ и их токсинов, в значительной мере зависящая от видовой принадлежности и штамма пробиотика. Механизмы действия пробиотиков детально обсуждены в обзорах [2–6, 25, 35, 39, 49–50, 54] и систематизированы в адаптированной по Sanders табл 2.
Следует подчеркнуть, что пробиотическая концепция является на сегодняшний день ведущей при назначении бактерийных препаратов. При этом наибольшую эффективность в клинической практике демонстрируют лекарственные препараты и биологически активные добавки к пище на основе комбинаций нескольких видов или штаммов пробиотических микроорганизмов, по составу приближенных к естественному, соответствующему определенному возрасту микробиоценозу и обладающих широким спектром антагонистической активности в отношении условно-патогенных бактерий и грибов.
Заключение
Прогнозируемый терапевтический и профилактический эффекты ПП определяются сроками, степенью стабилизации и спектром восстанавливаемых индивидуальных регуляторных функций макроорганизма, включая нормализацию микробиоценоза, иммунологических реакций, процессов электролитного обмена, окислительного фосфорилирования и регенерацию поврежденных клеток. Бльшое значение имеет научное обоснование эффекта, зависимое от степени изученности пробиотического штамма, в первую очередь его способности к адгезии и временной колонизации СО, спектра антагонистической активности, взаимодействию с Toll-подобными рецепторами и последующей активации врожденного иммунитета.



