За последние 10–15 лет внимание специалистов (педиатров, хирургов, гастроэнтерологов, неонатологов) как у нас в стране, так и за рубежом привлекала инфекция, обусловленная Clostridium difficile. Возбудитель C. difficile относится к спорообразующим анаэробным грамположительным бациллам, которые могут длительно существовать в виде спор в окружающей среде (в частности, в почве).
Источником инфекции служит прежде всего человек. В целом к роду Clostridia относятся заболевания с энтеральным путем передачи (ботулизм, клостридиальный гастроэнтерит, клостридиальный некротический энтерит) и травматическим (столбняк, анаэробная инфекция). Впервые I.C. Hall и E. O’Toole в 1935 г. описали и назвали возбудитель Bacillus difficilis [1, 2], выделив его от здорового новорожденного. Такое название бактерия получила в связи с трудностями ее выделения и культивирования [1].
Поначалу данный возбудитель был причислен к непатогенным. И лишь значительно позже, в 1978 г., бацилла была выделена из фекалий пациентов с превдомембранозным колитом (ПМК) после лечения клиндамицином, в связи с чем и была отнесена к патогенным возбудителям. С начала ХХI в. во многих странах отмечается нарастание распространенности клостридиальной инфекции. Этому обстоятельству способствуют широкое применение антибиотиков во всех странах мира, рост резистентной микрофлоры, длительное пребывание в стационаре и выхаживание глубоко недоношенных новорожденных, получающих антибактериальные препараты.
Основные пути передачи инфекции:
- фекально-оральный;
- контактный.
Факторы вирулетности C. difficile
К основным факторам вирулентности C. difficile относятся токсин А (TcdA) и токсин В (TcdB). Для проникновения в клетку токсины используют различные типы рецепторов. Рецепторы TcdB находятся в клетках-мишенях (энтероцитах) базолатерально, а для TcdA – на верхушечных апикальных участках [1]. Клиническая картина различается в зависимости от преобладания или наличия того или иного токсина.
TcdA – энтеротоксин, стимулируя гуанилатциклазу, повышает секрецию жидкости в просвет кишечника и способствует развитию диареи.
TcdB – обладает выраженным цитопатогенным действием на слизистую оболочку кишечника.
Оба токсина индуцируют апоптоз и некроз эпителиальных клеток. Нарушение барьера слизистой оболочки позволяет токсинам непосредственно воздействовать на различные клетки иммунной системы (макрофаги, тучные клетки), на нейроны, вызывая активацию провоспалительных цитокинов (интерлейкина-1 – ИЛ-1, ИЛ-8, ИЛ-1β, фактора некроза опухоли α). Токсины значительно изменяют защитные свойства слизи [1]. Помимо TcdA и TcdB, по данным литературы, в 1999 г. в странах Европы и Америки описано появление нового, гипервирулентного, штамма С. difficile, который получил название по способу его типирования NAPI/B1/027, тип NAP1 (Nort American pulsed-field gel electrophoresis type 1) и риботип 027 (ПЦР – полимеразная цепная реакция) [11]. Следует сказать, что не все штаммы C. difficile продуцируют токсин.
Значение C. difficile для стационара
К сожалению, C. difficile является причиной внутрибольничной инфекции (передаваясь через руки медицинского персонала и медицинские предметы). Описаны вспышки внутрибольничных заболеваний в отделении реанимации и интенсивной терапии (ОРИТ), а также в отделениях гематологии, онкологии, хирургии и др.
Клостридиальная инфекция может встречаться не только в стационаре, но и в амбулаторных условиях у тех детей, которые получали антибиотики широкого спектра действия, а также и у тех, антибиотики не получали вообще.
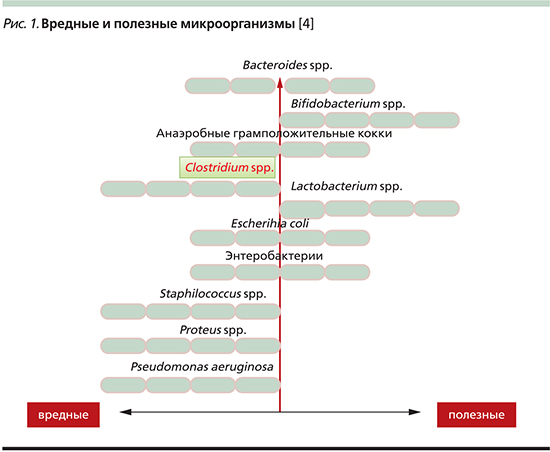
Место C. difficile среди всех микроорганизмов
Известно, что некоторые микроорганизмы (как полезные, так и вредные) даже в организме здорового человека способны проникать в кровоток и оказывать влияние на здоровье и функцию не только кишечника, но и всего пищеварительного тракта и организма ребенка (рис. 1) [3].
К патогенным бактериям относятся Clostridium spp., Pseudomonas aeruginosa, Staphilococcus spp., Proteus spp. Другие могут быть как патогенными, так и полезными: Bacteroides spp., Escherichia coli и энтеробактерии. Часть бактерий проявляет исключительно полезные качества: Lactobacillus и Bifidobacterium.
Значение C. difficile для новорожденных и недоношенных детей
Известно, что в норме у детей, рожденных естественным путем, после рождения происходит колонизация Lactobacillus spp. и Bifidobacterium spp. Кишечник глубоко недоношенных детей особо чувствителен к патогенным бактериям и возникновению язвенного некротического энтероколита. Недоношенные дети с незрелой иммунной системой составляют группу риска по формированию в более старшем возрасте воспалительных заболеваний кишечника.
В исследованиях M. Kalliomaki и соавт. (2001) было установлено, что у младенцев первых 3 месяцев жизни, имеющих высокий риск развития атопии, при высоком содержании Clostridium spp. значительно уменьшается количество Bifidobacterium spp.
В возрасте 3 месяцев это различие нивелировалось [5].
Дети, рожденные путем кесарева сечения, имеют высокую концентрацию Clostridium spp., способствующую длительному сохранению грамотрицательной микрофлоры [6]. Особенное значение Clostridium spp. имеет в связи с риском возникновения антибиотик-ассоциированной диареи (ААД) и ПМК.
К контингентам риска по развитию тяжелых форм относятся дети раннего возраста с ослабленным иммунитетом, а также взрослые >65 лет, больные онкологическими, хроническими заболеваниями, а также пациенты с иммуносупрессивными состояниями. На сегодняшний день выделен ряд факторов риска развития клостридиальной инфекции, однако основными являются госпитализация в стационар и лечение антибиотиками. Кроме этих факторов на протяжении десятилетий были выделены еще и следующие: оперативные вмешательства на желудочно-кишечном тракте (ЖКТ), повторные очистительные клизмы, длительное использование назогастрального зонда [7–9].
К антибактериальным препаратам, способствующим развитию клостридиальной инфекции, относятся клиндамицин, цефалоспорины, аминопенициллины. В случае комбинированного применения антибактериальных препаратов риск развития C. difficile-инфекции значительно возрастает – до 58,9% [10].
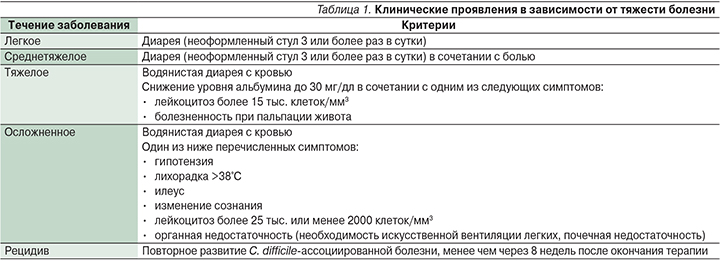
Клинические проявления зависят от формы заболевания – от легкой до тяжелой. Возможно также носительство C. difficile. Заболевание начинается с частого разжиженного стула – иногда с примесью крови, повышением температуры до 38–40°С, схватко-образными болями в животе. Основная клиническая симптоматика представлена в табл. 1 [1, 12–14].
При тяжелых формах заболевания (исследование проводилось у взрослых) с развитием ПМК клостридиальной этиологии описаны патоморфологические изменения, которые могут начинаться с дистальных отделов толстой кишки и далее распространяться в проксимальном направлении, вплоть до терминального отдела подвздошной кишки с увеличением глубины некроза слизистой оболочки кишки.
К гистологическим особенностям относятся тромбозы сосудов подслизистого слоя (69,7%), васкулиты (21,2%), флегмона толстой кишки (45,5%) [15]. Поражение слизистых оболочек характеризуется наличием псевдомембран неправильной формы, небольших размеров, состоящих из слизи, лейкоцитов и фибрина. У ряда больных определялись участки гиперсекреции слизи с кистозной дилатацией крипт [15].
Диагностика C. difficile
Прежде всего следует отметить, что материалом для исследования токсинов C. difficile являются фекалии пациентов с диареей. На сегодняшний день существует ряд методов диагностики клостридиальной инфекции (ИФА – иммуноферментный анализ, ПЦР, исследование глутаматдегидрогеназы C. difficile). Для определения TcdA и TcdB используется иммунохроматографический экспресс-тест. Однако пока других методов диагностики и «золотого» стандарта для выявления данного возбудителя нет.
По данным Морозовской ДГКБ, за последние 5 лет у 37,3% детей из 539 обследованных на C. difficile результаты были положительными. У обследованных больных TcdB регистрировался у большинства (88,1%), в то время как TcdA – лишь у 11,9%. Большинство обследованных больных были из гастроэнтерологического, хирургического, отделения реанимации в возрасте от 1 до 17 лет. Из других отделений – единичные анализы.
Для объективной оценки диагностики C. difficile-инфекции был проведен анализ результатов у 53 детей (23 девочки и 30 мальчиков), обследованных за 2015 г. У большинства обследованных больных (22 [42%]) имела место болезнь Гиршпрунга (в возрасте от 5 месяцев до 11 лет). А также были выявлены функциональные нарушения ЖКТ у 7 (13%); язвенный колит – у 9%, постинфекционный энтероколит – у 9%, хронические заболевания кишечника и ЖКТ – у 8%, болезнь Крона – у 5,7%, гастроэнтерит на фоне пищевой аллергии – у 3,8% и другие – у 9,5%.
Большинство (79,2%) детей обращались амбулаторно или госпитализировались с октября по март (включительно).
Оперативное вмешательство было выполнено 12 детям с болезнью Гиршпрунга и болезнью Крона. Следовательно, в случае подготовки к операции целесообразно всем детям с данной патологией проводить обследование и лечение C. difficile до оперативного вмешательства.
Из неблагоприятных факторов развития С. difficile на основании проведенного исследования следует выделить следующие:
- отягощенную беременность матери;
- кесарево сечение;
- прием антибиотиков матерью во время беременности;
- функциональные нарушения пищеварения с рождения;
- запоры с рождения;
- низкая прибавка массы тела;
- дисбактериоз с первых месяцев жизни (с пониженным количеством бифидо- и лактобактерий);
- перевод из отделения в отделение;
- частые госпитализации;
- оперативные вмешательства.
Следовательно, при наличии выше выделенных факторов целесообразно проводить исследование на клостридиальную инфекцию.
Лечение C. difficile
При выявлении C. difficile следует отменить антибиотик, вызвавший заболевание. В том случае, если антибиотик отменить невозможно, следует произвести его замену другой группой (например, макролидами) [16]. К ципрофлоксацину C. difficile резистентны.
Не рекомендуется применять спазмолитики из-за опасности развития тяжелого осложнения – токсического мегаколона. Также не применяют средства, уменьшающие моторику кишечника, – лоперамид.
Доказана связь между лечением антисекреторными препаратами (ингибиторами протонной помпы – ИПП) и развитием ААД C. difficile. Food and Drug Administration 8 февраля 2012 г. представило сообщение, в котором предупреждает пациентов и врачей об увеличении риска развития C. difficile при использовании ИПП.
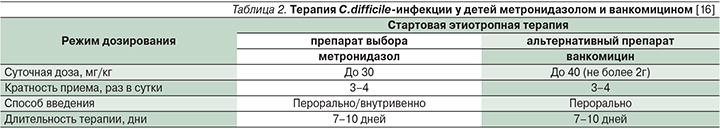
Антибиотики. Выбор препаратов и способ введения (пероральный, внутривенный) для лечения C. difficile зависит от тяжести заболевания. На протяжении двух последних десятилетий используются в основном два антибиотика – метронидазол и ванкомицин. Достоверной разницы между использованием метронидазола и ванкомицина выявлено не было. При тяжелых формах заболевания препараты либо комбинируются, либо вводятся внутривенно (табл. 2).
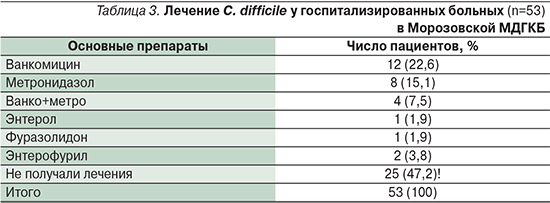
Как показали собственные данные лечения детей в Морозовской ДГКБ (табл. 3), к наиболее часто применяющимся препаратам при клостридиальной инфекции относятся метронидазол и ванкомицин.
Это обстоятельство, очевидно, связано с устоявшейся врачебной практикой, а также с тем, что лечение проводилось в основном у детей в стационаре.
Однако следует учитывать, что практически треть детей обследуются амбулаторно в условиях консультативной поликлиники и течение заболевания в этом случае бывает более легким. Обращает на себя внимание тот факт, что 47,2% детей вообще не получили лечения по поводу клостридиальной инфекции. Отсутствие лечения и контроля за этой инфекцией может приводить прежде всего к рецидивирующему течению, осложнениям в постоперационном периоде, распространению внутрибольничной инфекции.
К неблагоприятным эффектам, связанным с ванкомицином, относятся тошнота, рвота, ПМК, агранулоцитоз. При приеме метронидазола – тошнота, периферическая невропатия. Не следует назначать метронидазол при последующих рецидивах данной инфекции в связи с риском развития нейротоксического эффекта [17]. Следует учитывать, однако, и следующее обстоятельство: данные препараты в последние годы стали активно и широко применяться в отношении новорожденных и недоношенных детей, в отделениях реанимации, хирургических и т.д., в ситуациях, связанных с тяжестью состояния больного, септическим состоянием, а не только с клостридиальной инфекцией. В связи с этим нельзя не учитывать рост резистентности к данным препаратам, который будет только увеличиваться. В связи с этим идет поиск и других препаратов и методов лечения.
В частности, в ряде стран появился новый препарат группы макролидов – фидаксомицин. Применяется при легких и среднетяжелых формах клостридиальной инфекции в форме таблеток, уменьшая число рецидивов. Стоимость высокая. В России фидаксомицин не зарегистрирован.
Рифаксимин активен в отношении к C. difficile и может рассматриваться как дополнение к ванкомицину [9]. На сегодняшний день ведутся дискуссии относительно применения данного препарата.
Нитрофуроксазид – противомикробное средство широкого спектра действия, производное нитрофурана. Проявляет активность в отношении грамположительных микроорганизмов, в т.ч. C. difficile, а также грамотрицательных энтеробактерий. Восстанавливает эубиоз кишечника, препятствует развитию бактериальной инфекции, не всасывается и выводится через ЖКТ. Препарат стоит рассматривать (как в стационаре, так и в амбулаторной практике) как один из перспективных в отношении лечения диарей различного генеза у детей и взрослых, в т.ч. обусловленных C. difficile.
Важно, что препарат можно назначать детям начиная с первого месяца жизни в связи с отсутствием токсичности и резистентности.
Пробиотики. Пробиотики назначаются как в стационаре, так и амбулаторно. Энтерол показан при легких формах как альтернативное лечение антибиотиками либо одновременно с антибиотиками. Среди всех пробиотических препаратов Saccharomyces boulardii оказывает антимикробное действие, обусловленное антагонистическим эффектом в отношении патогенных и условно-патогенных микроорганизмов (C. difficile, Candida albicans, Candida kruesei, Candida pseudotropicalis, Klebsiella pneumoniae, Pseudomonas aeruginosa, Salmonella typhimurium, Yersinia enterocolitica, Echerichia coli, Shigella dysenteriae, Staphilococcus aureus и др.).
Saccharomyces boulardii обладает естественной устойчивостью к антибиотикам, проходит через пищеварительный тракт в неизмененном виде без колонизации, полностью выводится из организма в течение 2–5 дней после прекращения приема. Показанием к применению являются также дисбактериоз, синдром раздраженного кишечника, ААД, диарея путешественников, вызванная C difficile. Рекомендуемая продолжительность лечения, согласно инструкции, составляет 1 месяц. В рекомендациях 2013 г. по лечению и профилактике C. difficile-инфекции доза Энтерола увеличена до 250 мг дважды в сутки в течение 10–14 дней [14].
Другие пробиотики, содержащие в своем составе Bifibacterium bifidum, Bifidobacterium longum, Bifidobacterium infantis, Lactobacterium ramnosus, можно назначать для предупреждения развития рецидивов после лечения метронидазолом и ванкомицином сроком на 3 месяца [1, 18].
Другие методы лечения
При тяжелых формах заболевания описан опыт внутривенного введения иммуноглобулинов (при лечении ПМК).
Рассматриваются перспективные методы: введение моноклональных антител к токсинам C. difficile и использование фекального трансплантанта от здорового донора при ПМК и ААД.
На сегодняшний день речь идет об использовании экоантибиотиков разных групп (аминопенициллины, макролиды, фторхинолоны), содержащих в своем составе пребиотиотическую дозу высокоочищенной лактулозы ангидро (АВВА РУС). Кристаллы лактулозы подвергаются сушке, измельчению по специальной методике – ангидро, затем их включают в состав антибиотиков (300 мг). Проведенные ранее исследования относительно пребиотика лактулозы показали, что она не оказывает влияния на осмотическое давление в кишечнике, не влияет на моторику кишечника, компенсирует негативное воздействие антибиотика на микробиоценоз организма. Лактулоза гидролизуется в толстой кишке, главным образом лакто- и бифидобактериями, что приводит к увеличению их содержания. Отмечен рост ферментативной активности бифидобактерий в случае применения экоактибиотиков [19].
В исследовании, проведенном с участием здоровых добровольцев, было отмечено, что при приеме лактулозы плотность бифидобактерий увеличивается в 1,5 раза, в то время как плотность популяций клостридий одновременно снижается в 3 раза [20].
Диоктаэдрический смектит нейтрализует активность токсинов, может применяться одновременно с антибиотиками по 1–2 пакетика 3 раза в сутки на протяжении 7 дней.
При тяжелых, осложненных формах показанием к оперативному вмешательству (колэктомии) служат следующие состояния [1, 14,]:
- перфорация кишки;
- развитие синдрома системной воспалительной реакции;
- отсутствие улучшения самочувствия, несмотря на проводимое консервативное лечение на протяжении 5 дней;
- развитие токсического мегаколона, илеуса, симптомов «острого» живота.
Показателем тяжести служит уровень лактата сыворотки крови (более 5 ммоль/л). Кроме этого показателя целесообразно определять уровень фекального кальпротектина как маркера воспаления толстой кишки при разных вариантах течения C. difficile [21].
Профилактика
Комплекс мероприятий достаточно прост и прежде всего включает соблюдение правил личной гигиены: мытье рук с мылом и антисептиками, соблюдение санитарно-гигиенических правил медицинского учреждения. К более масштабным по объему мероприятиям относится сокращение назначения антибактериальных препаратов, сроков пребывания в стационаре.
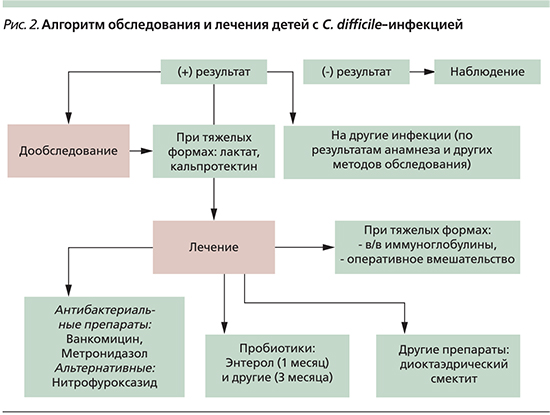
По результатам проведенного исследования, а также принимая во внимание данные литературы, нами был составлен алгоритм обследования и лечения детей с C. difficile-инфекцией (рис. 2).
Таким образом, обследование на C. difficile показано детям, рожденным от матерей с отягощенным анамнезом, путем кесарева сечения, перенесших внутриутробную инфекцию, имеющих дисбактериоз, перенесших оперативные вмешательства, длительно пребывающих в стационаре (ОРИТ, хирургические отделения, гастроэнтерологические и др.) или переведенных из других стационаров, получавших различные антибактериальные средства. Для лечения детей с данной инфекцией необходимо комплексное лечение (антибактериальные препараты+пробиотики). Назначение других препаратов зависит от тяжести состояния. Следует также проводить динамическое катамнестическое обследование.



