Введение
Роль кишечной микрофлоры в жизнедеятельности человека в настоящее время хорошо изучена. Влияние дисбиотических расстройств на возникновение и поддержание различных патологических состояний находится в фокусе современной медицинской науки.
В настоящее время симбиотическая микрофлора рассматривается как интегральная часть макроорганизма, его своеобразный «экстракорпоральный орган» как выполняющий регуляторную функцию, так и вносящий заметный вклад в физиологию человека [1]. Представление о микрофлоре человека как о «надорганизме» является основой микроэкологического аспекта этиопатогенеза современных заболеваний.
Появившиеся в последние годы новые методы молекулярно-генетического анализа значительно расширили представление о составе и функциях кишечной микробиоты. Так, в 2008 г. был запущен глобальный проект «Микробиом человека», целью которого стала расшифровка генома бактерий, населяющих организм человека. Расшифровкой генома бактерий, населяющих желудочно-кишечный тракт (ЖКТ), занимается Европейский консорциум MetaHIT. В настоящее время расшифровано 3,3 млн генов, что примерно в 150 раз больше набора генов человека. Полученные результаты позволяют установить взаимосвязь определенных генов с состоянием здоровья, развитием заболеваний, а также определить фенотип человека [2].
Экологической нишей, или биотопом с самой высокой степенью микробной обсемененности, является толстая кишка (ТК). Здесь микроорганизмы находятся в тесном взаимодействии со слизистой оболочкой кишечника, резорбирующая площадь которого составляет около 200 м2, а количество иммунокомпетентных клеток – около 60% общего числа клеток иммунной системы человека [3]. Микробное сообщество и иммунная система макроорганизма находятся в непрерывном процессе перекрестных взаимодействий и реорганизации, что приводит к их относительной стабильности. При этом до конца не известно, каков именно механизм взаимодействия интестинального микробного сообщества с системой иммунного реагирования.
Выраженность дисбиотических изменений отражается на течении (тяжесть проявления, длительность) заболеваний практически всех систем и органов. С одной стороны, патологический процесс любой локализации может приводить к изменениям в кишечном микробиоценозе, с другой – наличие дисбиоза является фактором, усугубляющим основное заболевание. Такое представление о связи дисбиоза кишечника и основного заболевания ставит нормализацию кишечного микробиоценоза в ряд необходимых условий адекватной терапевтической тактики. В настоящее время в качестве средств коррекции кишечного микробиоценоза используются пробиотики, пребиотики, симбиотики, синбиотики, метабиотики и кишечные антисептики.
Пробиотики – живые микроорганизмы, которые при введении в адекватном количестве оказывают положительный эффект на здоровье хозяина (World Gastroenterology Organisation – WGO, 2008). Исследования пробиотиков дают возможность предположить наличие у них многих положительных эффектов для здоровья человека [4].
Наиболее полно эффекты пробиотической терапии исследованы в гастроэнтерологии. Поскольку наиболее тесное и многоуровневое взаимодействие микробиоты и макроорганизма происходит в кишечнике, представляется целесообразным рассмотреть возможность применения пробиотиков при заболеваниях ТК: синдроме раздраженной кишки (СРК) и воспалительных заболеваниях кишечника (ВЗК).
Пробиотики в схемах лечения СРК
Синдром раздраженной ТК является наиболее частым функциональным расстройством ЖКТ. Во всем мире приблизительно 10–20% взрослого населения имеют симптомы СРК. По данным эпидемиологического исследования, проведенного на кафедре терапии и клинической фармакологии СПбМАПО, его распространенность в Санкт-Петербурге среди взрослого населения составляет 8,4% (Гомон Ю.М., 2009).
Симптомы СРК могут существовать длительное время, часто сочетаются с другими функциональными расстройствами и способны серьезно ухудшать качество жизни пациентов [5, 6].
Патогенез СРК включает следующие факторы: измененную моторику ЖКТ, висцеральную гиперчувствительность, расстройство взаимодействия в системе «головной мозг–кишка», вегетативные и гормональные сдвиги, генетические факторы и факторы окружающей среды, последствия перенесенных кишечных инфекций и психосоциальные расстройства.
В последние годы значительное внимание уделяется проблемам нарушения кишечного микробиоценоза у больных СРК. В ряде исследований было показано, что нарушение взаимодействия между кишечной микрофлорой, слизистой оболочкой и иммунной системой кишечника играет фундаментальную роль в патогенезе СРК [7–10].
Известно, что состав кишечной микрофлоры здоровых людей и пациентов с СРК существенно различается. У больных СРК наблюдается значительное уменьшение количества бифидо- и лактобактерий на фоне увеличения числа факультативных микроорганизмов [7, 8]. Так, при СРК с запорами возрастает количество аэробных бактерий, в частности обладающих протеолитической активностью. При СРК с диареей наблюдается повышение активности анаэробных микроорганизмов – родов бактероидов, пропионибактерий, клостридий и т.д. [11].
Существует несколько возможных доказательств того, что нарушения в кишечной микрофлоре могут являться одним из звеньев патогенеза СРК:
- у больных СРК наблюдаются изменения пристеночной и просветной микрофлоры по сравнению со здоровыми людьми;
- у 30% пациентов симптомы СРК проявляются впервые после эпизода острой кишечной инфекции, которая сама по себе не требует медикаментозного лечения;
- у части пациентов с СРК наблюдаются признаки синдрома избыточного бактериального роста;
- антибиотики, такие как рифаксимин, способны снижать интенсивность или полностью устранять симптомы СРК.
Таким образом, есть четкие основания для включения пробиотиков в схемы комплексного лечения СРК.
Действие пробиотиков при СРК осуществляется за счет [12–14]:
- предотвращения адгезии чужеродных микробов (колонизационная резистентность);
- продукции антимикробных субстанций (лизоцим, проглутамат, пероксид);
- конкуренции за пищевые субстраты;
- продукции цитопротективных веществ (аргинин, глутамин, полиамины);
- ацидификации толстокишечного содержимого;
- стимуляции иммунного ответа на патогены (синтез sIgA, IgG, повышение синтеза макрофагами и T-клетками цитокинов, усиление фагоцитоза; хоминг-эффект);
- продукции ферментов – гидролиз клетчатки, белков, жиров, крахмала, деконъюгация желчных кислот;
- синтеза витаминов, аминокислот, холестерина, мочевой кислоты, органических кислот;
- укрепления цитоскелета (экспрессия тропомиозина ТМ-5, синтез актина и окклюзина);
- снижения проницаемости (фосфорилирование белка межклеточных соединений);
- повышения синтеза муцина (стимуляция гена MUC-3);
- стимуляции синтеза и активации рецептора эпителиального фактора роста;
- увеличения синтеза полиаминов.
Продукты метаболизма микроорганизмов, входящих в состав пробиотиков, – короткоцепочечные жирные кислоты (масляная кислота), служат источником питания и энергии эпителиоцитов и стимулируют моторику кишечника. Выявлена способность метаболитов бактерий влиять на кальциевые каналы в ТК и усиливать сократительный эффект гладкой мускулатуры. Образование осмотических активных субстанций (органических кислот) приводит к снижению рН и стимуляции моторики. Некоторые микроорганизмы, например L. аcidophilus, оказывают сопоставимый с морфином анальгезирующий эффект при абдоминальной боли, сопровождающийся увеличением экспрессии каннабиноидных и опиоидных μ-рецепторов в эпителиальных клетках, выстилающих кишечник.
За последние годы в отечественной и зарубежной литературе появилось много публикаций, посвященных вопросам перспективности использования пробиотиков в терапии СРК.
Так, в исследовании G.М. Halpern и соавт. был использован инактивированный пробиотический штамм L. acidophilus (штамм LB) [15]. В этом исследовании участвовали 18 больных, которые в течение 6 недель получали пробиотик или плацебо с последующим 2-недельным периодом «очищения» и повторением 6-недельного цикла терапии. Клиническое состояние больных оценивалось при помощи опросника. Авторы этого исследования пришли к выводу, согласно которому пробиотический продукт продемонстрировал статистически значимый терапевтический эффект у 50% больных.
В другом исследовании, проведенном с участием 40 больных, в течение 4 недель оценивали фруктовый напиток, содержащий L. plantarum (штамм 99V). Все больные, получавшие активный продукт, отмечали облегчение абдоминальных болей. Ослабление общих симптомов СРК наблюдали у 95% больных в группе, получавшей лактобациллы, и у 15% – в контрольной группе, получавшей плацебо.
Большинство исследователей сходятся во мнении, будто основные эффекты пробиотиков при СРК связаны, во-первых, с коррекцией микроэкологических нарушений кишечника, обеспечивающей нормализацию его перистальтики, висцеральной чувствительности и/или газообразования в кишечнике. Возможным механизмом действия пробиотиков также является коррекция иммунологических сдвигов (в т.ч. нормализация профиля провоспалительных цитокинов), минимальных воспалительных изменений, сопровождающихся мышечной дисфункцией и нарушением нейрорегуляции кишечника [16, 17].
Ограниченное число научных исследований по оценке эффективности пробиотических продуктов при СРК побудили группу ученых под руководством D. Guyonnet провести в 2005 г. крупномасштабное многоцентровое рандомизированное плацебо-контролируемое клиническое исследование для оценки воздействия потребления пробиотического продукта Активиа, содержащего Bifidobacterium animalis DN-173 010 (коммерческое название ActiRegularis), на выраженность гастроинтестинальных симптомов и качество жизни взрослых пациентов с СРК и преобладанием запоров [15]. Исследование, в котором приняли участие 274 человека в возрасте от 18 до 65 лет, было проведено в 35 медицинских центрах Франции. Все его участники страдали легкими и среднетяжелыми формами СРК. Основным критерием эффективности сравниваемых продуктов являлась динамика гастроинтестинальных симптомов СРК (вздутие, боли в брюшной полости, дискомфорт, частота и характер стула) и качества жизни. Как показали результаты исследования, доля участников, отметивших улучшение самочувствия по общему показателю абдоминального дискомфорта, на 3-й неделе исследования оказалась значительно выше в группе Активиа по сравнению с группой плацебо (65,2 и 47,7% соответственно; p=0,003).
В финальном документе Римского консенсуса-III результаты назначения пробиотиков пациентам с СРК оценены как «обнадеживающие». Прием пробиотиков, содержащих B. infantis, сопровождался нормализацией цитокинового профиля пациентов с постинфекционным СРК. Тем не менее вне зависимости от ведущего пускового механизма заболевания назначение пробиотиков (L. sporogenes, L. acidophilus, S. thermophilus, B. infantis) приводит к повышению эффективности терапии пациентов с СРК: в редукции абдоминальной боли – на 62%, в купировании запора – на 58%, в купировании диареи – на 33%. Последними работами продемонстрировано и достоверное уменьшение количества (с 2,4±1,3 до 1,6±1,6; р=0,044) и длительности эпизодов абдоминальной боли (с 1,7±1,3 до 1,0±1,0; p=0,038) [17].
В клинических рекомендациях Российской гастроэнтерологической ассоциации по диагностике и лечению СРК отмечено, что лечебное действие различных пробиотиков при СРК подтверждено рандомизированными контролируемыми исследованиями и систематическим обзором Cochrane Database. Уровень доказательности соответствует II категории, уровень практических рекомендаций – категории В. Эффект от терапии следует оценивать не ранее чем через 4 недели от начала приема препарата в дозе, рекомендованной производителем. Доказана эффективность пробиотиков, содержащих такие микроорганизмы, как B. infantis, B. animalis, B. breve, B. longum, L. acidophilus, L. plantarum, L. casei, L. bulgaricus, S. thermophilus.
Таким образом, пробиотики сегодня являются одним из компонентов комплексной терапии СРК наряду со средствами, нормализующими тонус кишечной стенки, и психотерапевтической коррекцией.
Использование пробиотиков при ВЗК
Основой воспалительных заболеваний ТК являются иммунопатологические реакции, реализующиеся в воспалительных и деструктивных процессах в слизистой оболочке ТК (при язвенном колите – ЯК) или в стенке органа ЖКТ (при болезни Крона – БК) различной степени выраженности. Участие кишечной микрофлоры в течение этих заболеваний не вызывает сомнений. Дисбиотические изменения выявляются у всех пациентов с ВЗК.
Как при синдроме раздраженной ТК, так и при ВЗК наблюдаются значительные различия в составе кишечной микрофлоры больных и здоровых. Так, было выявлено снижение числа лакто- и бифидобактерий при активных формах ВЗК с нормализацией этих показателей в случаях ремиссии. У пациентов с ВЗК отмечено уменьшение количества синантропных бактерий, таких как Firmicutes, Clostridium, подвидов IX, IV и бактероидов, вместе с тем возрастает число протео- и актинобактерий [18–20]. Уменьшение количества подвидов Faecalibacterium ведет к снижению их противовоспалительного защитного воздействия. В исследовании, проведенном М. Joossens и соавт., при анализе фекальной микробиоты у 68 пациентов с БК и 84 близких родственников этих больных было отмечено снижение числа Faecalibacterium, Bifidobacterium и Clostridium кластеров XI и IV с одновременным увеличением количества Ruminococcus. При этом выявлены значительные отличия в составе кишечной микробиоты между пациентами с БК и их родными, несмотря на общие пищевые привычки.
У пациентов с ЯК, включая страдающих поухитом (воспаление илеоанального анастомоза), одновременно с выявленным снижением числа Faecalibacterium обнаружено значимое преобладание протеобактерий (Proteobacteria) и более высокий уровень сульфатредуцирующих бактерий, которые, влияя на увеличение продукции сероводорода, опосредованно снижают выработку бутирата, а также потенцируют клеточную пролиферацию [21, 22].
Исследование, проведенное В. Willing и соавт., показало, что у пациентов с илеоцекальной локализацией БК недостаточно представлены такие подвиды, как Faecalibacterium и Roseburia, но возрастает количество Enterobacter, в частности кишечной палочки и штаммов R. gnavus [23].
У пациентов с ЯК выявлена избыточная контаминация ТК видом Fusobactervarium, а также E. сoli, что может свидетельствовать об их вкладе в течение заболевания. В биоптатах слизистой оболочки ТК многих пациентов с БК изолируется E. coli, в частности ее адгезивно-инвазивные штаммы [24].
Дисбиоз при ВЗК может играть роль триггера или являться фактором поддержания иммунопатологических реакций [25].
Механизм действия пробиотиков при ВЗК множественный и может включать [26, 27]:
- угнетение роста патогенных микроорганизмов;
- улучшение барьерной функции эпителия и слизистой оболочки;
- иммунорегулирующее действие;
- уменьшение секреции провоспалительных цитокинов;
- нормализацию трофологических взаимодействий в системе колоноциты–микробиота.
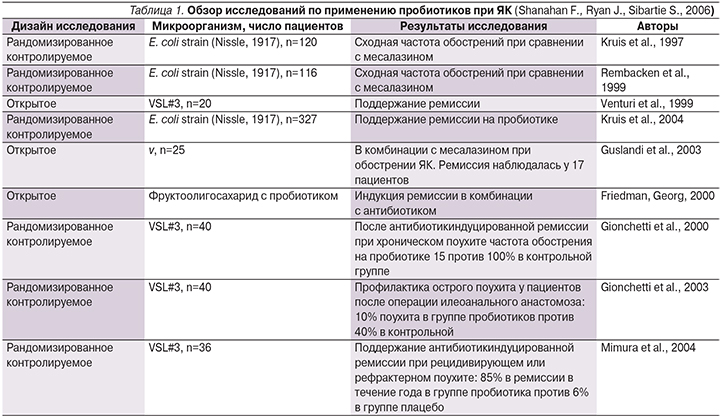
Анализ современной литературы, посвященной вопросам пробиотической терапии, показал возможность ее успешного применения при лечении ЯК. В экспериментальных работах было продемонстрировано, что применение пробиотиков способно как предотвращать развитие колита, так и уменьшать активность воспалительных процессов в ТК. У животных с экспериментальным колитом на фоне пробиотической терапии было отмечено значительное улучшение барьерной функции слизистой оболочки ТК, что оценивалось по уменьшению количества циркулирующих антител к эндотоксинами и уменьшению проницаемости кишечной стенки [15–17].
Согласно данным WGO (2008), есть весомые доказательства эффективности пробиотиков для профилактики первичного приступа поушита (VSL#3), а также для предотвращения рецидивов заболевания после терапии антибиотиками. Пробиотики могут быть рекомендованы пациентам с поушитом умеренной активности в ремиссии в качестве поддерживающей терапии [4].
Пробиотический штамм E. coli Nessle может быть эквивалентен мезасалазину в поддержании ремиссии ЯК [4].
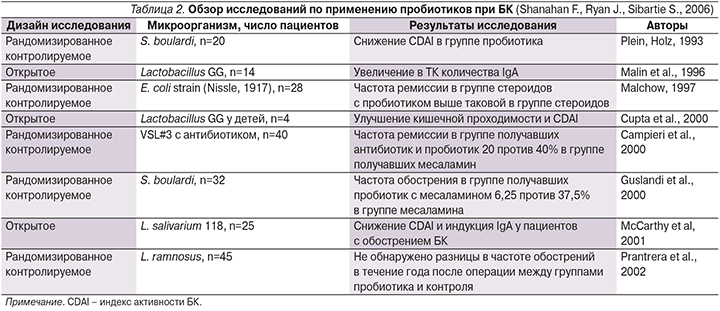
В табл. 1 и 2 представлен обзор исследований, проводившихся с целью выяснения эффектов пробиотической терапии при ЯК и БК [28].
Проведенные исследования применения пробиотиков при БК включали небольшое число пациентов. Несмотря на позитивное влияние пробиотической терапии при БК, выявленное в ряде исследований, в настоящее время нет достоверных данных об эффективности пробиотиков в поддержании ремиссии этого заболевания [4].
На кафедре терапии и клинической фармакологии СПбМАПО было проведено исследование влияния пробиотической терапии на течение ЯК. Пациенты со средней тяжестью ЯК (n=49) были рандомизированы в 2 группы: группу больных, получавших стандартную терапию месалазином, и группу, в которой терапия месалазином сочеталась с таковой Ламинолактом (Enterococcus faecium L3). В ходе исследования была выявлена способность пробиотической терапии поддерживать ремиссию ЯК. Так, через 2 месяца после окончания основного курса терапии в сравниваемых группах не наблюдалось различий ни в клиническом, ни в эндоскопическом индексах активности. То есть независимо от наличия в схеме терапии пробиотика удалось достигнуть достоверного снижения активности заболевания. Однако через 6 месяцев оба индекса активности оставались достоверно меньшими в группе пациентов, получивших Ламинолакт. На основании этих данных можно предположить, что сочетание базисной терапии с пробиотиком позволяет поддерживать медикаментозно индуцированную ремиссию заболевания [29].
Аутопробиотики в лечении заболеваний ТК
В настоящее время в качестве пробиотического компонента используются биотехнологические штаммы микроорганизмов. Механизмы влияния таких средств изучены недостаточно, т.к. чужеродность биотехнологических штаммов не позволяет им внедряться в биопленку, где реализуется большинство взаимодействий микро- и макроорганизма. Промышленные штаммы микроорганизмов подвергаются элиминации вследствие биологической несовместимости, пребывая в кишечнике транзиторно как микрофлора пищи. Это признают производители пробиотиков, подтверждая, что их продукты не восполняют дефицит соответствующих содержимому пробиотика микроорганизмов, но стимулируют рост облигатной микрофлоры. Все это не позволяет получать высокие и стабильные клинические результаты при лечении заболеваний, сопровождающихся дисбиотическими расстройствами.
Доказано, что микробиота каждого человека индивидуальна и обладает большим резервом устойчивости [1]. В связи с этим большое значение приобретают исследования, посвященные использованию в клинической практике аутопробиотических средств. Имеющиеся в мире исследования такой направленности в основном посвящены вопросам выделения и консервирования аутофлоры человека.
В результате совместной работы коллективов кафедры терапии и клинической фармакологии СПбМАПО и отдела молекулярной генетики Института эксперементальной медицины была разработана технология приготовления аутопробиотического продукта, содержащего аутоштаммы E. faecium. Отличительной чертой индигенных штаммов E. faecium, использованных для получения аутопробиотиков, является способность синтезировать ряд антимикробных пептидов – бактерио-цинов (энтероцины А, В, P, X и др.), что является важным для подавления избыточного роста условно-патогенной флоры у пациентов с заболеваниями кишечника. Антибактериальные и противовирусные свойства этих бактериоцинов не исчезают даже после инактивации самих бактерий, т.к. данные белки устойчивы к воздействию различных физико-химических факторов. Также E. faecium вырабатывает широкий спектр витаминов, способных расщеплять растительные полисахариды, тем самым вырабатывая дополнительную энергию и различные метаболиты для организма человека, в т.ч. являющихся ростовыми факторами бифидобактерий и лактобацилл кишечника.
На кафедре терапии и клинической фармакологии ГОУ ДПО СПбМАПО проведено исследование, посвященное применению аутопробиотической терапии больных СРК (Сундукова З.Р., 2010). Результаты работы доказывают, что способ лечения пациентов с СРК с применением аутопробиотика на основе аутоштамма энтерококка позволяет достоверно улучшать состояние кишечного микробиоценоза, уменьшать выраженность клинических проявлений заболевания и улучшать состояние больного по сравнению с терапией пробиотиками на основе промышленных штаммов того же микроорганизма [30].
Также этот аутопробиотический продукт был использован в качестве средства для профилактики развития постинфекционного СРК. Было продемонстрировано достоверное снижение частоты случаев развития постинфекционного СРК на фоне профилактического приема пробиотика с E. faecium, в большей степени при приеме аутопробиотика [31].
Таким образом, пробиотики играют важную роль в профилактике и лечении заболеваний ЖКТ. Продолжающиеся клинические исследования могут стать основанием для расширения показаний к применению пробиотиков в гастроэнтерологии. Пробиотики оказывают не только терапевтический, но и профилактический эффект в отношении заболеваний ЖКТ, улучшают качество жизни здоровых людей.



