Актуальность проблемы
В настоящее время заболеваемость сахарным диабетом (СД) приняла характер эпидемии. Каждые 10 лет число больных СД удваивается [4, 5, 7, 9]. Так, в частности, в нашей стране число больных СД оценивается в 9 млн человек на 2014 г., при том что 62,5% из них (около 5 млн) не знают о своем заболевании [2, 5, 6, 12]. Синдром «диабетическая стопа» (СДС) развивается в той или иной форме у 30–60% пациентов, страдающих СД [3–5, 10].
Введение
Патология центральных и периферических сосудов является одним из определяющих факторов, влияющих на течение СДС. К наиболее частым причинам развития ишемической формы СД относятся облитерирующий атеросклероз артерий нижних конечностей (ОААНК) и склероз Менкеберга [5, 6, 8, 11].
Атеросклеротический процесс в артериях нижних конечностей довольно универсален, но при СД [4, 5] он имеет ряд особенностей:
- встречается в 2–5 раз чаще, чем в общей популяции;
- поражает людей более молодого возраста;
- распространенность ОААНК не зависит от половой принадлежности;
- атеросклеротический процесс характеризуется быстрым прогрессированием, полисегментарным, диффузным типом поражения артерий;
- преобладает дистальный тип поражения (реже вовлекаются артерии аорто-подвздошного сегмента).
Так, по данным российских и зарубежных авторов, при установлении диагноза СД 2 типа облитерирующий атеросклероз артерий нижних конечностей выявляется среди 10% пациентов [4, 5, 7, 9]. Атеросклеротические изменения артерий крупного и среднего калибра при СД практически не отличаются от таковых у лиц, не больных СД, но при СД такие изменения развиваются в более раннем возрасте и быстрее прогрессируют. При СД помимо ОААНК отмечается развитие процесса, играющего существенную роль в патогенезе ишемии мягких тканей нижних конечностей [4, 5]. При длительно текущем СД, неэффективном метаболическом контроле и на фоне периферической диабетической полиневропатии часто развивается медиакальциноз артерий голеней и стоп. Развитие медиакальциноза в первую очередь связано с формированием полиневропатии и поражением автономного звена периферической нервной системы. В условиях аутосимпатэктомии происходит нарушение трофики миоцитов сосудистой стенки, сопровождающееся отложением кальция. В результате артерия становится ригидной трубкой с фиксированным диаметром, что создает предпосылки для развития ишемии конечностей, возникающей на фоне состояний, требующих увеличения объемного кровотока, в первую очередь при физической нагрузке, а также при воспалении. Одним из патогенетических путей развития подобного состояния считают гликирование белков артериальной стенки. Накопление конечных продуктов гликирования в стенке сосуда ведет к нарушению структуры эндотелия, возможным тромботическим осложнениям и представляет собой субстрат для окклюзии пораженного сосуда. Поражаются не только артерии голеней, но и коронарные сосуды, аорта, церебральные сосуды, феморальные артерии [2, 3, 8]. Следует помнить, что медиасклероз является независимым и серьезным фактором риска сердечно-сосудистой смертности и может маскировать собственно ОААНК.
Давно известно положительное влияние Актовегина на диабетическую микроангиопатию, однако, данных по влиянию Актовегина на ишемические поражения при СД пока не достаточно. Доказано субъективное улучшение качества жизни больных СД с нейроишемическим болевым синдромом после курса препарата Актовегин [1–3, 7].
Цели и задачи исследования: определить эффективность применения Актовегина в лечении больных ишемической формой СДС, а также подтвердить результаты лечения с помощью объективных методов исследования.
Материал и методы
Данное исследование основано на наблюдении 40 пациентов старше 60 лет с СД 2 типа, нейроишемической формой СДС, которые с 2010 по 2014 г. находились на стационарном лечении в отделении хирургической инфекции ГБУЗ ГКБ № 81 ДЗ Москвы.
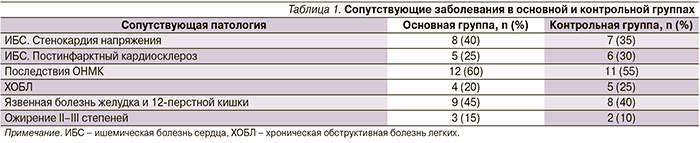
Все больные случайным образом были распределены в две группы. Для пациентов обеих групп окклюзия дистального русла стала противопоказанием к реконструктивным сосудистым вмешательствам. В основную группу вошли 20 пациентов, из которых у 7 (35%) наблюдались акральные некрозы пальцев, у 13 (65%) – трофические язвы стоп. По степени ишемии стоп у пациентов основной группы III стадия наблюдалась у 15 (75%) больных, IV – у 5 (5%) (по Фонтейну–Покровскому). Число мужчин составило 11 (55%), женщин – 9 (45%). Возрастной состав пациентов: от 60 до 70 лет – 11 (55%) пациентов, от 70 до 80 лет – 6 (30%), старше 80 лет – 3 (15%) пациента. Среди пациентов основной группы легкая форма СД наблюдалась в 8 (40%) случаях, средней степени тяжести диабет – в 4 (20%), тяжелого течения – в 8 (40%) случаях. В контрольную группу вошли 20 пациентов, из которых у 8 (40%) отмечены акральные некрозы пальцев, у 12 (60%) – трофические язвы стоп. По степени ишемии стоп у пациентов основной группы III стадия наблюдалась у 15 (75%) больных, IV стадия – у 5 (5%). Число мужчин составило 10 (50%), женщин – 10 (50%). Возрастной состав пациентов: от 60 до 70 лет – 12 (60%) пациентов, от 70 до 80 лет – 6 (30%), старше 80 лет – 2 (10%) пациента. Среди пациентов контрольной группы легкая форма СД наблюдалась в 7 (35%) случаях, диабет средней степени тяжести – в 5 (25%), тяжелого течения – в 8 (40%) случаях. Соотношение сопутствующей патологии представлено в табл. 1.
Как видно, сопоставляемые группы идентичны по проявлениям основного заболевания, полу, возрасту, тяжести СД и сопутствующей патологии.
Больным обеих групп проведена консервативная ангиотропная терапия по стандартной, принятой в нашей клинике схеме.
Больные обеих групп получали внутривенно препараты: пентоксифиллин 10,0 № 10 на 250 мл раствора 0,9%-ного натрия хлорида; Сулодексид 650 ЛЕ в сутки; Октолипен 600 мг в сутки № 14 на 250 мл 0,9%-ного натрия хлорида; перорально: кардиомагнил 75 мг в сутки, оксигенотерапия – 5 сеансов в барокамере. Помимо ангиотропной терапии пациентам обеих групп поводилось местное лечение с применением повязок Tender Wet Active 1 раз в день при трофических язвах, при акральных некрозах 1 раз в день выполнялась перевязка с раствором Бетадин, по показаниям выполнялась механическая некрэктомия.
Больным основной группы к схеме лечения добавлен препарат Актовегин, представляющий собой высокоочищенный гемодериват, получаемый методом ультрафильтрации из крови телят. Препарат содержит более 200 биологически активных веществ, таких как: аминокислоты, олигопептиды, нуклеозиды, продукты метаболизма углеводов и жирных кислот, низкомолекулярные компоненты клеточных мембран и другие. Внутриартериально или внутривенно с помощью инфузомата вводили 30 мл раствора Актовегина (1200 мг) в 200 мл физиологического раствора ежедневно в течение 3–4 недель. Далее применяли таблетированную форму Актовегина по 200 мг (1–2 таблетки) 3 раза в сутки в течение 1,0–1,5 месяца.
Под воздействием Актовегина в клетке происходят следующие процессы:
- повышается обмен высокоэнергетических фосфатов (АТФ);
- активируются ферменты окислительного фосфорилирования (пируват- и сукцинатдегидрогеназы, цитохром С-оксидаза);
- возрастает активность кислой фосфатазы и лизосомальная активность клетки;
- повышается активность щелочной фосфатазы;
- ускоряется синтез углеводов и белков, увеличивается приток ионов калия в клетку;
- происходит активация калий-зависимых ферментов – каталаз, сахараз, глюкозидаз;
- ускоряется распад продуктов анаэробного гликолиза – лактата и β-гидроксибутирата, что приводит к нормализации внутриклеточного pH.
По данным многочисленных исследований, Актовегин улучшает процессы функционального метаболизма и регенерации при дистальных диабетических полиневропатиях. Это происходит благодаря его метаболотропному, синаптотропному и нейротрофическому действиям, особенно у больных СД. В условиях энергодефицита он активирует ресинтез глюкозы из лактата, повышает эффективность анаэробного гликолиза, стимулирует синтез АТФ, корригирует лактатацидоз.
Результаты и обсуждение
У больных основной группы по результатам лечения положительный клинический эффект наблюдался в среднем на 4–6 суток раньше, чем у больных контрольной группы.
Оценивались следующие клинические показатели:
В основной группе (с включением Актовегина):
- болевой синдром в покое и после ходьбы уменьшился у 18 (90%) пациентов;
- чувствительность стоп улучшилась у 16 (80%) больных;
- кожная температура повысилась у 15 (75%) пациентов.
В контрольной группе:
- болевой синдром в покое и после ходьбы уменьшился у 13 (65%) пациентов;
- чувствительность стоп улучшилась у 10 (50%) больных;
- кожная температура повысилась у 11 (55%) пациентов.
Кроме того, оценивали местный статус: регистрировали уменьшение размеров раневых дефектов, уменьшение и отторжение некрозов. Эти изменения отмечены в обеих группах, но в основной группе наблюдались на 7–8-е сутки лечения, в контрольной – на 12–14-е.
Изучение динамики показателей функциональных методов лечения после проведения консервативной терапии показало, что имеется достоверная положительная динамика регионарного кровотока в основной группе. Одним из методов оценки адаптационных резервов организма является фотоплетизмография (греч. plethysmos наполнение, увеличение + graphō писать, изображать) метод исследования сосудистого тонуса и кровотока в сосудах мелкого калибра, основанный на графической регистрации пульсовых и более медленных колебаний объема какой-либо части тела, связанных с динамикой кровенаполнения сосудов. Больным обеих групп для оценки кровотока выполнялась фотоплетизмография нижних конечностей. Результаты оценивались при помощи аппаратно-программного комплекса «Акутест FPG», Россия. В основной и контрольных группах до проведения консервативной терапии средний показатель амплитуды колебаний составил 1,8±0,34 мм (р<0,05). После лечения в основной группе средняя амплитуда колебаний фотоплетизмограммы возросла до 3,5±1,05 мм (р<0,05), в контрольной также отмечено увеличение амплитуды колебаний до 2,7±1,14 мм (р<0,05). Результаты показывают, что в группе приема Актовегина улучшился отток венозной крови и увеличился объем пульса за счет увеличения артериального притока, что в свою очередь говорит об улучшении кровоснабжения и обмена веществ на капиллярном уровне.
Кроме того, изучали изменения кислородного режима тканей: больным выполняли чрескожную полярографию, определяли парциальное напряжение кислорода в тканях тыла стопы. Чрескожная полярография позволяет исследовать микрогемоциркуляцию и кислородный режим тканей при облитерирующих заболеваниях сосудов, в т.ч. и при диабетической ангиопатии нижних конечностей, и проводить объективную оценку эффективности лечебных мероприятий. В основной группе эти значения выросли с 22,5±0,47 до 35±0,36 мм рт.ст. (р<0,05), тогда как в контрольной эти показатели выросли значительно в меньшей степени с 23,7±0,43 до 29,9±0,38 мм рт.ст. (р<0,05). Это еще раз подтверждает положительное действие Актовегина на микрогемоциркулцию и поступление кислорода в ишемизированные ткани.
У пациентов рассчитывали лодыжечно-плечевой индекс (ЛПИ): у больных основной группы при исходном среднем показателе ЛПИ 0,43±0,12 после проведения консервативной терапии ЛПИ составил 0,71±0,14, тогда как у больных контрольной группы при исходном значении 0,45±0,14 ЛПИ составил 0,56±0,16.
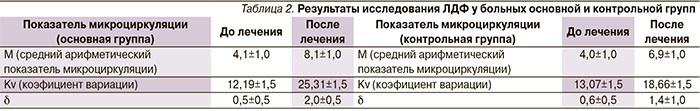
 У больных основной и контрольной групп до и после курсов консервативной терапии исследовали микроциркуляцию методом лазерной допплеровской флоуметрии (ЛДФ). Для этого использован одноканальный лазерный компьютеризированный анализатор кровотока «ЛАКК-02» производства НПО ЛАЗМА, Россия. Датчик располагался на тыле стопы, замер показателей производился в течение 3 минут. Результаты представлены на табл. 2. Все исследования показали значительно лучшие результаты в основной группе (с включением Актовегина).
У больных основной и контрольной групп до и после курсов консервативной терапии исследовали микроциркуляцию методом лазерной допплеровской флоуметрии (ЛДФ). Для этого использован одноканальный лазерный компьютеризированный анализатор кровотока «ЛАКК-02» производства НПО ЛАЗМА, Россия. Датчик располагался на тыле стопы, замер показателей производился в течение 3 минут. Результаты представлены на табл. 2. Все исследования показали значительно лучшие результаты в основной группе (с включением Актовегина).
Клинический пример
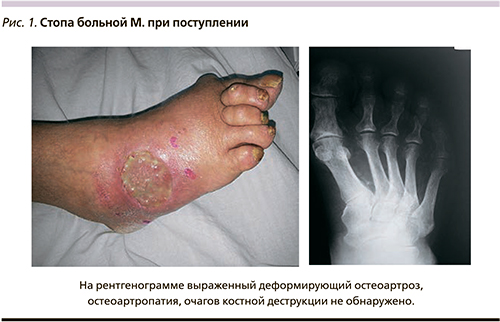
Больная М. 69 лет поступила в экстренном порядке в клинику с подозрением на гангрену левой стопы. При осмотре жалобы на боли в левой стопе после ходьбы, онемение левой стопы. При осмотре отмечается цианоз стопы, пульсация ниже уровня подколенной артерии не определяется, левая стопа прохладная в области пальцев, активные движения в пальцах имеются, рефлексы на стопе определяются, на тыле стопы имеется язвенный дефект без перифокального воспаления 5,0×3,0 см, глубина до 0,3 см (рис. 1). В анамнезе жизни: в течение 15 лет страдает СД 2 типа, на инсулине. При аортоартериографии: общая подвздошная артерия, внутренние подвздошные артерии диффузно изменены, стенозированы, кальцинированы, наружная подвздошная артерия стенозирована до 60%, общая бедренная артерия – без значимого стенотического поражения, кальцинирована, глубокая бедренная артерия контрастируется до терминальных ветвей, поверхностная бедренная артерия диффузно изменена, от устья протяженно сужена до 80%, в средней трети множественные критические стенозы с протяженной окклюзией, в дистальной трети заполняется по коллатералям, ПоА диффузно изменена, протяженно сужена до 60–70%. Тибиоперонеальный ствол протяженно субтотально стенозирован, передняя большеберцовая артерия множественно критически стенозирована, контрастируется до стопы, задняя большеберцовая артерия множественно критически стенозирована, контрастируется до стопы, малоберцовая артерия не контрастируется. Выполнение прямой и эндоваскулярной реконструкции артерий больной не представляется возможным.
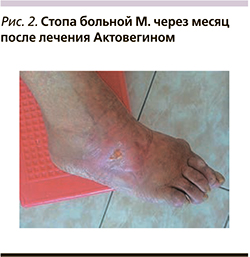
При исследовании микроциркуляции методом лазерной допплеровской флоуметрии М 4,0 пф. ед.; Kv 12,07; δ 0,75 пф. ед. ЛПИ при поступлении – 0,44. Больной назначен курс консервативной терапии с применением препарата Актовегин. На фоне лечения ночные боли купировались, боли после ходьбы уменьшились. Раневой дефект на тыле стопы с тенденцией к заживлению и эпителизации, размеры уменьшились до 0,5×0,4 см, глубина – до 0,1 см (рис. 2). При контрольном исследовании микроциркуляции методом лазерной допплеровской флоуметрии М 7,9 пф. ед.; Kv 23,19; δ 1,9 пф. ед. ЛПИ при выписке 0,73.
Больная с улучшением выписана из стационара под наблюдение хирурга по месту жительства.
Выводы
Препарат Актовегин достоверно улучшает микроциркуляцию больных ишемической формой СДС, о чем свидетельствует повышение показателей микроциркуляции у больных основной группы при ЛДФ: М с 4,1 поднялся до 8,1 пф. ед., Kv – с 12,19 до 25,31, δ – c 0,5 до 2,0 пф. ед., ЛПИ – с 0,43 до 0,71, что превышает аналогичные показатели в контрольной группе, где Актовегин не применялся. Кроме того, улучшение микроциркуляции подтверждено при помощи чрескожной полярографии и фотоплетизмографии.
Мы рекомендуем включать препарат Актовегин в курс комплексного лечения больных СДС и облитерирующими заболеваниями артерий нижних конечностей по следующей схеме: 30 мл раствора Актовегина (1200 мг) разбавить 200 мл физиологического раствора, вводить 1 раз в сутки внутривенно в течение 14 дней, затем амбулаторно по 1 таблетке 3 раза в сутки в течение месяца. Курс лечения повторять 2 раза в год.



