Актуальность проблемы
По последним данным, более чем у 40 % больных воспалительными заболеваниями урогенитального тракта выявляется микоплазменная инфекция [11]. В последние десятилетия наряду с ростом заболеваемости отмечаются значительные изменения в структуре урогенитальной патологии.
Урогенитальная микоплазменная инфекция довольно широко распространена в человеческой популяции. Человек является естественным хозяином по крайней мере 11 видов микоплазм, из них 3 (Mycoplasma genitalium, Mycoplasma hominis, Ureaplasma urealyticum) способны вызывать воспалительные заболевания урогенитального тракта. Носительство М. hominis и U. urealyticum среди населения варьируется от 10 до 50 % [11].
Исследователи из США предложили термин “негонококковые нехламидийные уретриты”. Этиологическими агентами при таких уретритах могут быть генитальные микоплазмы (U. urealyticum, M. genitalium). При помощи полимеразной цепной реакции в режиме реального времени (PCR-Real time) была продемонстрирована роль M. genitalium в рецидивирующем уретрите [6]. Показана также роль других генитальных микоплазм в развитии этого заболевания, в частности U. urealyticum.
В настоящее время все большее внимание в отечественной и зарубежной литературе уделяется виду U. urealyticum. Данный вид включает 2 биовара: PARVO (серотипы 1, 3, 6 и 14) и T-960 (серотипы 2, 4, 5, 7, 8, 9, 10, 11, 12, 13). Оба биовара способны инициировать патологические проявления. Так, с биоваром PARVO связывают высокий уровень лейкоцитов в мазках, кольпит, развитие пиелонефрита, дистрофические изменения плаценты, а также рождение детей с массой тела менее 3 кг. Биовар Т-960 считается ответственным за проявления негонококкового уретрита у мужчин, воспалительные выделения из влагалища у женщин и в редких случаях – внутриутробную гибель плода [22].
Отличительные особенности мико- и уреаплазм – отсутствие клеточной стенки и способность паразитировать на мембране клеток хозяина.
С учетом высокой распространенности микоплазм, особенно среди беременных женщин, их клиническое значение зависит от степени колонизации ими урогенитального тракта [1]. Так, статистически выявлена значительная связь между уровнем колонизации U. urealyticum и M. hominis мочеполовых путей женщин и преждевременными родами, а также дородовым излитием околоплодных вод [1]. В литературе появляется все больше сообщений о внутриутробной микоплазменной инфекции, которая проявляется чаще всего в виде пневмоний у новорожденных, но может носить и генерализованный характер [1].
Основной путь передачи микоплазменной инфекции – половой. Чаще всех микоплазмы обнаруживаются у лиц с повышенной половой активностью. Для развития инфекционного процесса большое значение имеет не столько сам факт наличия или отсутствия микоплазм, сколько широта и массивность их диссеминации.
К факторам, провоцирующим развитие инфекционного процесса, относятся следующие: присоединившаяся инфекция другой природы, изменение гормонального фона, беременность и роды; нарушения иммунного и интерферонового статусов организма. Немаловажную роль в развитии инфекции играет и вирулентность конкретного штамма.
Среди здоровых лиц широко распространенным остается бессимптомное носительство микоплазм. Во многих случаях они вызывают латентную инфекцию, которая под влиянием различных стрессовых факторов может переходить в хроническую рецидивирующую или острую форму.
Клиническая картина мико- и уреаплазменной инфекций неспецифична и, как правило, не отличается от клинических проявлений инфекций, вызванных другими микроорга-низмами.
Таким образом, воспалительные заболевания мочеполовых органов, обусловленные патогенными и условно-патогенными микроорганизмами, продолжают оставаться серьезной проблемой в связи с возможностью развития тяжелых осложнений, связанных с репродуктивной функцией. Несмотря на неоднозначность мнений исследователей в отношении патогенной роли мико- и уреаплазменной инфекций, в этиологической классификации Всемирной организации здравоохранения (ВОЗ, 2006) и синдромальной классификации Centers for Disease Control and Prevention эти микроорганизмы выделены как возможные этиологические агенты неспецифических негоноккоковых уретритов, воспалительных заболеваний органов малого таза и бактериального вагиноза [6].
Современные международные и российские рекомендации по лечению микоплазменной инфекции
Одним из наиболее сложных на сегодняшний день остается вопрос эффективности терапии урогенитальных инфекций. Многочисленные исследования посвящены разработке схем и методик применения тех или иных антимикробных препаратов. Оптимизируют антибактериальную терапию с помощью иммуномодуляторов, ферментных и других лекарственных средств. Терапия инфекций, передаваемых половым путем, должна быть комплексной, а применяемые препараты обладать широким спектром действия.
Требования ВОЗ к препаратам, используемым в качестве лечения инфекций, передаваемых половым путем:
- эффективность не менее 95 %;
- хорошая переносимость и малая токсичность;
- безопасность использования во время беременности;
- медленное развитие резистентности микроорганизмов к средствам терапии;
- доступная цена.
- Главные принципы медикаментозной терапии:
- основные препараты (препараты выбора) – обеспечивают наилучшее соотношение между эффективностью лечения и доказанной безопасностью лечебного средства;
- альтернативные препараты – обеспечивают приемлемые результаты лечения в отсутствие возможности использования основных схем лечения (беременность, кормление грудью, индивидуальная непереносимость лекарственного средства, сопутствующие заболевания и т. д.).
Рациональный выбор антибиотиков для эмпирической терапии следует осуществлять с учетом следующих критериев:
- спектр активности, соответствующий предполагаемому возбудителю;
- фармакокинетика, определяющая проникновение антибиотика в очаг воспаления, кратность введения и длительность курса лечения;
- эффективность при урогенитальных инфекциях, доказанная рандомизированными клиническими исследованиями;
- противопоказания и частота побочных эффектов;
- удобство применения для пациента (повышает приверженность лечению);
- фармакоэкономические аспекты лечения.
Вопросы антибиотикотерапии урогенитальной мико- и уреаплазменной инфекций также активно дискутируются. В то же время адекватная антибиотикотерапия должна проводиться лишь с учетом чувствительности конкретного штамма возбудителя [24, 28].
С учетом вышеуказанных пунктов можно выделить следующие перспективные группы антибиотиков для лечения мико- и уреалазменной инфекции: тетрациклины, макролиды, фторхинолоны, азалиды.
Критерии назначения этиологической терапии при выявлении генитальных микоплазм, по мнению большинства исследователей:
- клинические и лабораторные признаки воспалительного процесса в органах мочеполовой системы;
- результаты комплексного микробиологического обследования на наличие патогенных и условно-патогенных микроорганизмов с количественным обнаружением генитальных микоплазм более 104 ЦОЕ/мл;
- предстоящие оперативные или другие инвазивные мероприятия на органах мочеполовой системы;
- бесплодие;
- беременность (оценка акушерско-гинекологического анамнеза).
Среди наиболее часто применяемых антибиотиков сохраняется стабильно высокая чувствительность мико- и уреплазменной инфекции к джозамицину (94,8 % 5 лет назад и 94,4 % в настоящее время), отмечается увеличение числа штаммов, чувствительных к доксициклину, с 93,2 до 97,2 %. Вместе с тем чувствительность к другому антибиотику той же группы, тетрациклину, снизилась с 92,5 до 83,3 %.
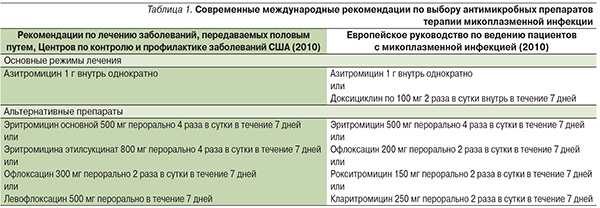
Современные международные рекомендации по выбору антимикробных препаратов терапии микоплазменной инфекции представлены в табл. 1.
Препараты, указанные в альтернативных схемах, не имеют каких-либо преимуществ между собой и рассматриваются как равнозначные.
Рекомендуемые препараты в соответствии с Европейским руководством по ведению беременных женщин, инфицированных микоплазмами [4]:
- эритромицин 500 мг 4 раза в сутки в течение 7 дней;
- амоксициллин 500 мг внутрь 3 раза в сутки 7 дней;
- джозамицин 500 мг 2 раза в сутки 7 дней.
Отечественные рекомендации по выбору антимикробных препаратов терапии микоплазменной инфекции представлены в табл. 2.
Для лечения беременных рекомендуется применять [6] джозамицин по 500 мг внутрь 3 раза в сутки в течение 10 дней.
Эффективность и безопасность отдельных препаратов, используемых для терапии микоплазменной инфекции
Тетрациклины
Одним из основных препаратов лечения инфекций, передаваемых половым путем, продолжает оставаться представитель группы тетрациклинов – доксициклин. При этом эталоном эффективности различных режимов терапии является пероральный прием доксициклина (100 мг 2 раза в сутки в течение 10 дней). Доксициклин отличается от тетрациклина лучшими фармакокинетическими свойствами и большей безопасностью. В основе механизма антибактериального действия доксициклина, как и других тетрациклинов, лежит подавление им биосинтеза белка микробной клетки на уровне рибосом [13]. При негонококковом уретрите, вызванном U. urealyticum или M. genitalium, доксициклин применяют в дозе 100 мг 2 раза в сутки в течение 7–14 дней [1]. Хорошие результаты были получены при применении доксициклина женщинами, инфицированными различными видами микоплазм и страдающими бесплодием или привычным невынашиванием беременности.
В ряде случаев после применения доксициклина наступала беременность, которая заканчивалась нормальными родами в срок и без осложнений [1].
С клинической точки зрения наиболее актуальным представляется остановиться на тех препаратах, к которым U. urealyticum демонстрирует наивысшую чувствительность. Выделение устойчивых к действию доксициклина эффектов отмечается крайне редко. Рост числа штаммов, чувствительных к доксициклину, можно объяснить тем, что в последние годы этот препарат несколько потеснили макролиды (кларитромицин, рокситромицин) и азитромицин, активно применяемые в терапии урогенитальной инфекции.

Сохранение высокой чувствительности возбудителя к этому препарату и сегодня доказывает обоснованность его применения в лечении микоплазмозов. При его применении могут наблюдаться побочные эффекты – чаще со стороны желудочно-кишечного тракта (ЖКТ). К недостаткам доксициклина относится невозможность его назначения детям до 8 лет и беременным женщинам, а также женщинам в период лактации.
Макролиды
Еще одной группой антибиотиков, применяемых в лечении микоплазмозов, являются макролиды. Для макролидов в целом характерны более низкие, чем для фторхинолонов, минимальные подавляющие концентрации (МПК). По мнению ряда исследователей, при мико- и уреаплазменной инфекциях макролиды должны использоваться в качестве препаратов первого ряда [7].
Эритромицин в течение длительного времени применялся в качестве альтернативы тетрациклинам, однако этот препарат часто плохо переносится больными. Согласно опубликованным результатам, терапия эритромицином остается достаточно эффективной (83–95 %). Тем не менее многие авторы отмечают, что выраженные побочные эффекты со стороны ЖКТ, а также высокая курсовая доза и необходимость многократного приема (4 раза в сутки по 500 мг) снижают приемлемость этого метода лечения.
В группе макролидов самые низкие МПК для уреаплазм имеют кларитромицин и джозамицин. Прием 250 мг кларитромицина 2 раза в сутки в течение 7 дней, как правило, приводит к исчезновению M. hominis, U. urealyticum из половых путей мужчин и женщин. Применение рокситромицина (300 мг/сут) по эффективности не уступает стандартному режиму приема доксициклина.
Джозамицин обладает широким спектром антибактериального действия, включающим как все клинически значимые возбудители микоплазмоза (M. hominis, M. genitalium, U. urealyticum), так и другие основные этиологические агенты при урогенитальных заболеваниях – хламидии и Neisseria gonorrhoeae.
Преимуществом 16-членных макролидов, к которым относится джозамицин, перед эритромицином и другими препаратами этой группы является более редкое развитие к ним устойчивости ряда микроорганизмов, например Streptococcus pneumoniae [15]. Аналогичная тенденция прослеживается и в отношении внутриклеточных возбудителей. Несмотря на широкое применение, клинические штаммы микоплазм и уреаплазм сохраняют высокую чувствительность к джозамицину как за рубежом [26], так и в России [22]. Например, в период с 2001 по 2003 г. был отмечен рост числа резистентных штаммов к рокситромицину, кларитромицину, левофлоксацину и клиндамицину, в то время как уровень антибиотикоустойчивости к джозамицину за это время не изменился [4]. Аналогичные данные были получены и в исследовании, проведенном в Красноярске, где было показано сохранение стабильно высокой чувствительности U. urealyticum к джозамицину на протяжении последних 5 лет [23]. Более высокая активность джозамицина в отношении уреаплазм по сравнению с другими макролидами продемонстрирована и в других отечественных исследованиях [1].
В зарубежном сравнительном исследовании чувствительности возбудителей смешанной инфекции U. urealyticum и M. hominis, выделенных у больных негонококковым уретритом, к семи антибактериальным препаратам (джозамицину, доксициклину, миноциклину, спарфлоксацину, рокситромицину, офлоксацину и азитромицину) также была показана их более высокая чувствительность к джозамицину, чем к препаратам сравнения [32]. При подобных инфекциях уровень резистентности возбудителей особенно высок, в связи с чем выбор препаратов с целью их лечения должен проводиться наиболее тщательно. Например, резистентность к азитромицину в данном исследовании составила 90,48 %.
Джозамицин накапливается в лимфатических узлах и половых органах, причем его концентрации в этих органах при воспалительных процессах повышаются, т. к. он способен проникать внутрь фагоцитарных клеток (макрофагов, фибробластов, полиморфно-ядерных гранулоцитов) и переноситься ими в очаг воспаления [33]. Концентрация препарата в полиморфно-ядерных лейкоцитах человека, моноцитах и альвеолярных макрофагах приблизительно в 20 раз выше, чем во внеклеточном пространстве [20].
В отличие от большинства других макролидов джозамицин наряду с хорошим проникновением внутрь клеток создает и высокие концентрации в сыворотке крови, что имеет большое значение при системном проявлении инфекции [36]. Препарат не связывается с изоферментами цитохрома Р450 и не влияет на НАДФ-цитохром-С- редуктазу, поэтому обладает значительно более низким, чем эритромицин и кларитромицин, риском лекарственных взаимодействий и не оказывает отрицательного влияния на функцию печени. Он обладает выраженными иммуномодулирующими свойствами, которые могут способствовать усилению эффекта на больных воспалительными заболеваниями [34].
Еще одним очень важным достоинством джозамицина является возможность его применения беременными женщинами. Он обладает наименьшим тератогенным эффектом среди всех макролидов [28]. Высокая эффективность (91,5 %) и отличная переносимость (побочных эффектов не зарегистрировано) джозамицина были, в частности, продемонстрированы в исследовании, включившем 47 беременных женщин (срок беременности – 24–32 недели) со смешанной хламидийно-уреаплазменной инфекцией [24].
Весьма интересно и важно с практической точки зрения сохранение в течение 5 лет стабильно высокой чувствительности U. urealyticum к джозамицину. Отметим, что и в других исследованиях in vitro джозамицин демонстрирует наивысшую активность в отношении уреаплазм по сравнению с другими макролидами [1].
Доказана и высокая клиническая эффективность джозамицина [11]. После приема внутрь джозамицин быстро абсорбируется из ЖКТ. Сmax достигается через 1–2 часа после приема. Через 45 минут после приема дозы 1 г средняя концентрация джозамицина в плазме составляет 2,41 мг/л. Связывание с белками плазмы не превышает 15 %. Прием препарата с интервалом в 12 часов обеспечивает сохранение эффективной концентрации джозамицина в тканях в течение суток. Равновесное состояние достигается через 2–4 дня регулярного приема.
Одно из преимуществ джозамицина – быстрое создание высокой концентрации препарата в клетках и тканях за счет его высокой липофильности. При пероральном применении концентрация препарата в лейкоцитах, моноцитах, фагоцитах, макрофагах и клетках эпителия приблизительно в 20 раз выше, чем в межклеточном пространстве. Поскольку микоуреаплазмы являются исключительно внутриклеточными возбудителями, вышеуказанные свойства джозамицина делают его идеальным препаратом лечения мико-, уреаплазменной инфекций. По данным Института исследования инфекционных кожно-венерических заболеваний (Австрия), степень излечения микоуреаплазмоза джозамицином составляет 97 % (для сравнения: эффективность применения доксициклина при данной патологии составляет 50 %, азитромицина – 55,5 %).
Достаточно широкий спектр антимикробного действия антибиотика делает его эффективным при лечении смешанных инфекций, включающих анаэробные, к которым женщины особенно восприимчивы. Для лечения урогенитального микоуреаплазмоза рекомендуемая доза препарата – по 500 мг 2 раза в сутки в течение 7–10 дней.
Таким образом, по данным клинических исследований и с учетом вышеизложенного, джозамицин является одним из наиболее эффективных и безопасных антибиотиков лечения инфекций, передаваемых половым путем. Его высокая клиническая эффективность в реальной медицинской практике обусловливает высокую экономическую значимость и выдвигает этот антибиотик в число основных средств лечения заболеваний, передаваемых половым путем. Изложенное выше убедительно показывает, что в настоящее время среди антибиотиков группы макролидов именно джозамицин является наиболее предпочтительным в лечении урогенитальных микоплазмозов. Наивысшую чувствительность в отношении U. urealyticum в настоящее время демонстрируют доксициклин (97,2 %) и джозамицин (94,4 %).
Чувствительность микроорганизмов к данным препаратам сохраняется на стабильно высоком уровне в течение 5 лет, что позволяет рекомендовать их к активному клиническому применению [21]. С учетом фармакодинамических и фармакокинетических свойств, высокой безопасности и хорошей переносимости джозамицин представляется одним из самых перспективных антибиотиков лечения урогенитальной инфекции, вызванной микоплазмами и уреаплазмами, у разных категорий пациентов, включая беременных женщин и детей.
Азитромицин является полусинтетическим антибиотиком широкого спектра действия, первым представителем подкласса азалидов. Подобно другим макролидам, обладает в основном бактериостатическим эффектом, но благодаря способности создавать очень большие внутриклеточные концентрации может действовать бактерицидно. К достоинствам азитромицина следует отнести его хорошую переносимость и низкий уровень побочных эффектов. Результаты клинических исследований показали, что азитромицин и доксициклин обладают практически одинаково высокой эффективностью (94,9 и 95,9 % соответственно).
Фторхинолоны
Группой антибиотиков, применяемых в лечении микоплазмозов, являются фторхинолоны. Среди фторхинолонов предпочтение при лечении микоплазменных инфекций рекомендуют отдавать офлоксацину и его левовращающему изомеру – левофлоксацину.
Согласно рекомендациям Амери-канского Центра по профилактике и контролю за заболеваниями, альтернативным препаратом, применяемым в лечении урогенитальной инфекции, является амоксициллин. Однако, несмотря на приводимые относительно высокие показатели излечения амоксициллином (82–94 %), нельзя забывать, что in vitro пенициллины оказывают неполный ингибирующий эффект по отношению к M. hominis, U. urealyticum.
На сегодня существует множество рекомендаций и схем лечения микоплазменной инфекции. Эффект лечения зависит от многих причин, поэтому обязательным условием успеха лечения остается комплексное обследование пациента до назначения лекарственного препарата с обязательным определением чувствительности выявленной инфекции к антибактериальным препаратам. Установление клинико-микробиологических критериев излеченности урогенитальных инфекционных заболеваний, вызванных микоплазмами, проводится через месяц после окончания лечения.
В отсутствие клинических проявлений заболевания и выявления возбудителя в количестве менее 104 КОЕ/мл осуществляется динамическое наблюдение за больными, в бóльших количествах – повторное лечение с заменой антибиотика [9].
С учетом всего вышеизложенного, а также основываясь на общих принципах лечения инфекционных больных, лечение микоплазменной инфекции должно быть комплексным, этиологически, патогенетически и симптоматически обоснованным и дифференцированным в соответствии с видом возбудителя, клинической формой и характером болезни, наличием осложнений и остаточных явлений.



