Деформирующий остеоартроз (ОА) является заболеванием, поражающим значительную часть населения. Около 80% среди всех пациентов с заболеваниями суставов составляют именно больные ОА [1, 2]. ХХ в. ознаменовался множеством технических новшеств, которые во многом изменили быт людей. С одной стороны, облегчение физического труда уменьшило нагрузки на суставы человека, но, с другой стороны, именно появление многих технических приспособлений привело к увеличению развития артроза у людей определенных профессий: бурильщиков, шахтеров, работников на виброустановках и т.д. Развитие транспортных средств привело к снижению двигательной активности значительной части населения, рост материального благополучия послужил причиной увеличения массы тела выше нормы более чем для половины населения земного шара. Нарастание распространенности ОА с возрастом [3] создает проблему коморбидности и связанных с этим трудностей в подборе безопасной терапии.
Основными клиническими проявлениями ОА являются боль и постепенное снижение функции. По современной классификации, боль разделяется в зависимости от основного патогенетического механизма: ноцицептивная, нейропатическая, функциональная (или дисфункциональная). При ОА основным служит ноцицептивный механизм развития боли, хотя у пациентов может быть и боль нейропатического характера, что следует дифференцировать при выработке терапевтической тактики. Синдром хронической боли является значимой медицинской проблемой. Хотя болевой синдром при ОА, особенно в дебюте болезни, не всегда сильно выражен, усилия врача должны быть направлены на его максимальное подавление. Именно боль становится фактором, ограничивающим активность пациентов, и способна приводить к функциональным нарушениям деятельности сердечно-сосудистой, дыхательной, пищеварительной систем и др. Наличие боли – независимый предиктор прогрессирования ОА и уменьшения продолжительности жизни преимущественно среди больных женского пола [4, 5]. При этом показано, что уменьшение продолжительности жизни пожилого контингента в большей степени зависит от интенсивности боли, чем от наличия или отсутствия сопутствующих потенциально жизнеугрожающих заболеваний (например, ишемическая болезнь сердца, артериальная гипертензия и пр.) [6]. Несмотря на успехи фармацевтической промышленности за последние десятилетия, значительная часть больных ОА не получают удовлетворительного обезболивания [7]. Именно наличие коморбидных состояний при ОА, по мнению многих экспертов, приводит к неудаче в терапии [8, 9]. По мнению экспертов Международного общества по изучению остеоартроза (Osteoarthritis Research Society International, OARSI), риск неудачи терапии умеренный при наличии у пациента сахарного диабета, артериальной гипертензии, хронических заболеваний желудочно-кишечного тракта (ЖКТ), депрессии и ожирения, а высокий риск имеет место при наличии в анамнезе желудочно-кишечных кровотечений, инфаркта миокарда и почечной недостаточности [9]. Именно эти заболевания и являются фактором риска развития осложнений при использовании нестероидных противовоспалительных препаратов (НПВП).
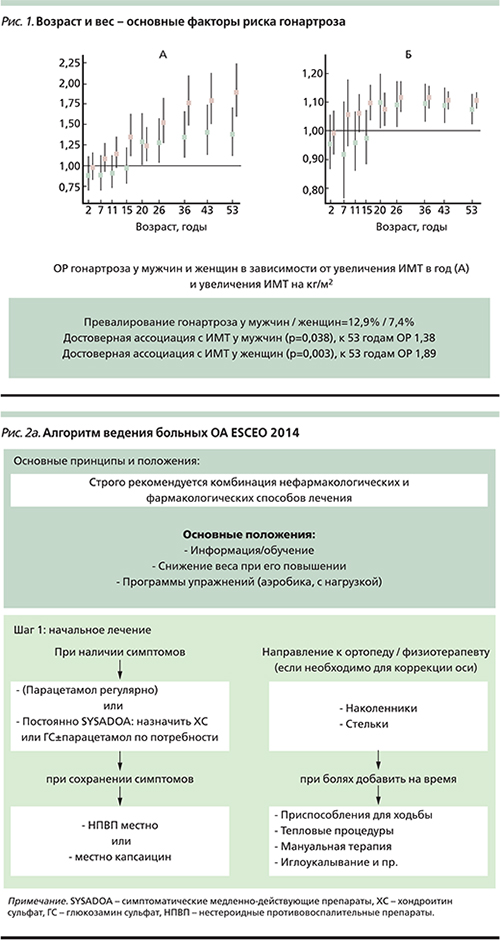
Наиболее часто при ОА отмечают артериальную гипертензию (более 50% больных), сахарный диабет (около 25% больных), заболевания ЖКТ (около 60% больных), ожирение, ишемическую болезнь сердца (около 15% больных) [7]. Увеличение массы тела не только является известным фактором риска развития и прогрессирования гонартроза (рис. 1) [10], но и затрудняет лечение больных, усугубляя коморбидные состояния.
В лечении ОА используются нефармакологические и фармакологические методы. К нефармакологическим методам относят физические упражнения (укрепление мышц, изотонические/изокинетические упражнения, аэробика, снижение веса). Эти методы не оказывают влияния на течение ОА, хотя способны на некоторое время уменьшить боль [11]. Отмечено, что снижение веса на 4–5 кг только в сочетании с физическими упражнениями способно уменьшить боль при ОА [11]. Фармакологическое лечение ОА включает использование быстродействующих препаратов (парацетамола, НПВП и других обезболивающих средств) и медленнодействующих препаратов («хондропротекторов»).
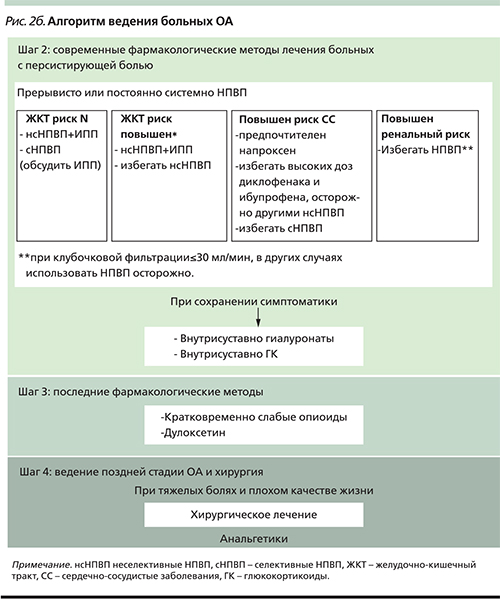
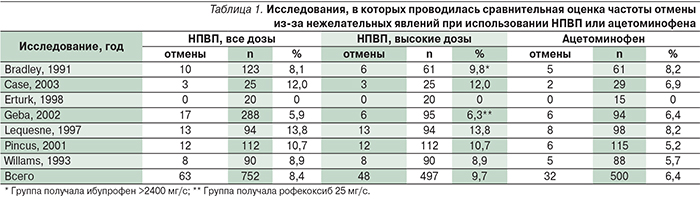
Европейское общество по клиническим и экономическим аспектам остеопороза и ОА (The European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis, ESCEO) провело анализ предложений различных экспертных групп для создания консенсуса по ведению больных ОА [12]. Был создан алгоритм ведения больных ОА (рис. 2а, 2б), в котором четко прослеживается осторожный подход к применению НПВП, понимание необходимости учета факторов риска их непереносимости, подтверждается эффективность медленнодействующих препаратов (хондроитин сульфата, глюкозамин сульфата и гидрохлорида, внутрисуставного введения гиалуронатов, диацериина, неомыляемых соединений авокадо и сои). Последние рекомендации по ведению больных ОА строго рекомендуют сочетание фармакологических и нефармакологических методов лечения, подчеркивается необходимость обучения больных, снижения веса (при его повышении) и применение программ физических упражнений. В рекомендациях различных обществ по лечению ОА (OARSI; European League Against Rheumatism, EULAR; American College of Rheumatology, ACR) парацетамол широко рекомендуется для лечения боли при ОА. Авторы при этом основываются на сообщениях о его безопасности. Однако, по последним обзорам и мета-анализам, парацетамол уступает НПВП не только по эффективности, но и по безопасности (рис. 3, табл. 1) [13]. Данные этого мета-анализа согласуются с рекомендациями OARSI, отмечающими малый обезболивающий эффект парацетамола [14]. Кроме того, использование парацетамола увеличивает риск осложнений со стороны ЖКТ и достоверного повышения аминотрансфераз [15]. Учитывая это, и принимая во внимание практическую недоступность слабых опиоидов для лечения ОА, основными препаратами для проведения анальгетической и противовоспалительной терапии больных являются НПВП.
В настоящее время врач имеет возможность выбора того или иного НПВП, в РФ зарегистрировано 19 непатентованных форм с различными действующими веществами. Все эти препараты имеют примерно одинаковую эффективность при использовании адекватных терапевтических доз. Для клинициста наибольшее значение при использовании НПВП имеет оценка риска развития нежелательных явлений, в первую очередь со стороны ЖКТ и сердечно-сосудистой системы. В исследовании LOGICA [16], включившем 3293 пациента с ОА, у 86,6% был повышен риск ЖКТ-осложнений, из них у 22,3% он был высоким, риск сердечно-сосудистых осложнений выявлен у всех больных: у 44,2% из них он был высоким, у 28,5% умеренным и у 27,3% низким. У 15,5% больных выявлен высокий риск и ЖКТ, и сердечно-сосудистых осложнений. В другом популяционном исследовании (17 105 больных ОА) у 93,4% больных имелись факторы риска ЖКТ-осложнений, при этом у 60,3% риск был высоким, 32% больных имели инфаркт миокарда в анамнезе, 57,6% получали антигипертензивную терапию, а 22,6% пациентов имели неконтролируемую артериальную гипертензию [17]. Высокая частота коморбидности у больных ОА и возможность у любого НПВП вызывать осложнения со стороны ЖКТ и сердечно-сосудистой системы, оказывать негативное влияние на функцию почек, печени, вызывать гематологические осложнения, кожные реакции диктуют необходимость профилактики нежелательных реакций: оценки факторов риска и выбора более безопасных НПВП.
Наиболее изученным является НПВП-обусловленное повреждение верхних и нижних отделов ЖКТ. Как правило, негативное влияние НПВП на слизистую ЖКТ связывают с подавлением циклооксигеназы-1 (ЦОГ) и как следствие – со снижением выработки протективных простагландинов. Действительно, внедрение в практику селективных НПВП (сНПВП) позволило значительно снизить частоту развития таких нежелательных явлений, хотя при высоких факторах риска и они не абсолютно безопасны. Кроме того, увеличение селективности подавления ЦОГ-2 не коррелирует со снижением риска тяжелых ЖКТ-осложнений (язвенное кровотечение, перфорация). На рис. 4 представлено распределение НПВП в зависимости от преимущественности подавления ЦОГ-2. Видно, что из зарегистрированных в РФ препаратов эторикоксиб обладает набольшей селективностью в отношении ЦОГ-2. Действительно, применение эторикоксиба значительно снижает частоту развития проявлений НПВП гастропатии (рис. 5) [18]; по данным программы MEDAL, частота осложненных событий при использовании эторикоксиба или диклофенака не различалась (р=0,561). Другой зарегистрированный в РФ коксиб – целекоксиб – в меньшей степени селективен, но демонстрирует высокую гастроинтестинальную безопасность. Как показал анализ контролируемых исследований, включивший результаты лечения целекоксибом и классическими НПВП 15 187 больных ОА и ревматоидным артритом, использование целекоксиба уменьшало частоту развития язв ЖКТ (в т.ч. осложненных перфорацией или кровотечением) с 61% (на фоне неселективных НПВП) до 4%, а у больных, получавших еще и аспирин, – с 72 до 14% [19]. Надо помнить, что НПВП-гастропатия, как правило, развивается в первые месяцы лечения и имеет тенденцию к рецидивированию [20]. Назначение Н2-блокаторов (ранитидина) или антацидов не предупреждает рецидивов НПВП-гастропатии: профилактическое значение в этой ситуации имеет использование ингибиторов протонной помпы (ИПП). Применение НПВП короткими курсами, к сожалению, не приводит к уменьшению частоты осложнений со стороны ЖКТ.

При развитии НПВП-энтеропатии, наличие которой удалось зарегистрировать после внедрения метода капсульной эндоскопии, ИПП не эффективны ни в отношении диспепсии, сопровождающей повреждение тонкой кишки, ни в отношении профилактики рецидивов язв или кровотечения этого отдела кишечника. Единственное, что уменьшает частоту развития НПВП-энтеропатии, – это использование сНПВП ингибирующих ЦОГ-2 (целекоксиб). Напомним, что клиническими проявлениями НПВП-энтеропатии являются диспепсия, не отвечающая на прием ИПП, железодефицитная анемия, не поддающаяся лечению препаратами железа, и гипоальбуминемия.
НПВП-гепатопатия может развиваться при приеме любых НПВП и носит характер метаболической или иммунологической идиосинкразии. Факторами риска ее развития являются пожилой возраст, женский пол, патология гепатобилиарной системы, тяжелые сопутствующие заболевания, сочетанный прием препаратов, влияющих на метаболизм НПВП, генетические аномалии, гипоальбуминемия, гепатотоксические реакции в анамнезе [21, 22]. В ряде стран риск осложнений со стороны печени стал причиной введения запрета на нимесулиды.
В крупном европейском популяционном исследовании гепатотоксичности нимесулида (Traversa G. et al.) представлен анализ частоты лекарственного поражения печени 400 тыс. больных, получавших различные НПВП за 1997–2001 гг. Было показано, что НПВП в целом повышают риск развития патологии печени, однако ее частота очень низкая (общая частота гепатопатий – 29,8 на 100 тыс. пациенто-лет, относительный риск – 1,4). При этом нимесулид вызывал гепатопатии в 35,3 случая на 100 тыс. пациенто-лет. Это значительно реже, чем диклофенак ( 39,2) и ибупрофен (44,6) [23]. Отсутствие повышенной гепатотоксичности нимесулида показано и в отечественных исследованиях [24]. Тяжелое поражение печени (цитолиз, холестатический синдром) при применении НПВП – редкое осложнение (1 случай на 10 тыс. больных).

Отрицательное действие неселективных НПВП на почки проявляется повреждением интерстиция, снижением клубочковой фильтрации, повышением артериального давления и уменьшением действия большинства антигипертензивных препаратов (β-блокаторов, диуретиков, антагонистов ангиотензинпревращающего фермента) [25]. Особое внимание в последние годы уделялось оценке кардиоваскулярного риска осложнений НПВП, особенно сНПВП.
Подводя итоги обсуждения представленных выше данных можно заключить:
Наиболее часто побочные реакции со стороны сердечно-сосудистой системы связаны с блокадой ЦОГ-1 (повышение артериального давления, задержка жидкости, уменьшение эффекта антигипертензивных препаратов) [26].
Побочные реакции со стороны сердечно-сосудистой системы гораздо чаще встречаются у больных с заболеваниями сердца и сосудов.
Лицами с риском тромбозов НПВП должны применяться в комбинации с дезагрегантами.
Потенциально опасными могут считаться только сверхвысокие дозы селективных ингибиторов ЦОГ-2 при длительном непрерывном приеме в группах риска развития сердечно-сосудистых осложнений. По заключению регуляторных органов США [27] и Европы [28] сердечно-сосудистые осложнения присущи всем НПВП, целекоксиб не более опасный в этом отношении препарат. По данным мета-анализа 1,4 млн больных (2 302 029 пациенто-лет), только диклофенак и индометацин (рис. 6) имеют повышенный риск развития острого инфаркта миокарда или внезапной смерти (рофекоксиб снят с производства), все остальные неселективные НПВП и сНПВП не увеличивают риск тяжелых осложнений со стороны сердечно-сосудистой системы [29].
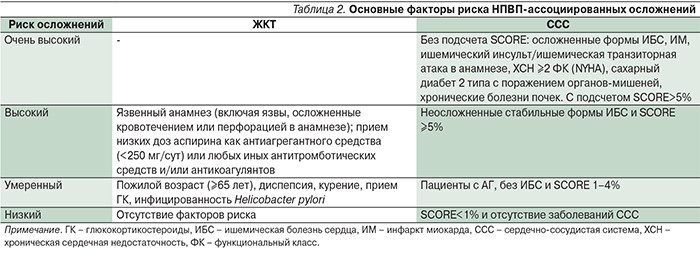
В изданных в 2015 г. отечественных клинических рекомендациях по рациональному применению НПВП в клинической практике [30] подчеркивается, что основным методом профилактики НПВП осложнений служит выбор наиболее безопасных препаратов и учет факторов риска непереносимости (табл. 2). Наименьший риск осложнений со стороны всех отделов ЖКТ показан для целекоксиба по сравнению с неселективными НПВП и плацебо, что подтверждается в мета-анализе 52 рандомизированных контролируемых исследований, включившем 51 048 больных [31]. Целекоксиб реже вызывает осложнения и у пациентов с факторами риска ЖКТ-осложнений (исследование CONDOR) [32] по сравнению с комбинацией диклофенака и омепразола. В отношении риска сердечно-сосудистых осложнений, по данным клинических и эпидемиологических исследований, наименьший риск имеет напроксен [33, 34].
С учетом данных рандомизированных контролируемых исследований и мета-анализов был разработан алгоритм назначения НПВП [30], представленный в табл. 3.
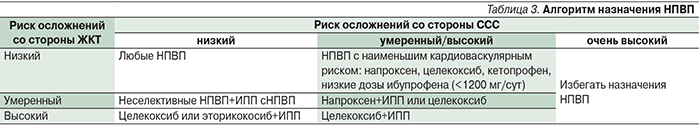
Как видно из данных таблицы, помимо целекоксиба наименьший кардиоваскулярный риск имеют производные пропионовой кислоты (напроксен, кетопрофен и ибупрофен в низких дозах). У ряда больных ОА анальгетический эффект неселективных НПВП выше, чем с НПВП. Использование, например, кетопрофена – препарата, обладающего высоким анальгетическим потенциалом, периферическим и центральным механизмами действия, позволяет добиваться надежного обезболивания больных. А появление новой формы кетопрофена – лизиновой его соли – определяет более высокую ЖКТ-безопасность.
Каковы же основы наиболее рационального применения НПВП?
Ответственное отношение врача к выбору НПВП, суточной его дозы должно сочетаться с повышением ответственности больного к лечению и устранению тех факторов, которые могут способствовать более частому развитию побочных эффектов. Напомним, что курение повышает риск кардиоваскулярных заболеваний на порядок больше, чем самый опасный в отношении ЖКТ и сердечно-сосудистой системы НПВП индометацин [35]; нарушения диеты, употребление алкоголя способствуют возникновению гепатопатий, гастропатий и т.п. Врачу следует проводить обследование больного, информировать его о возможных осложнениях лечения, оценивать факторы риска развития нежелательных явлений и при их выявлении назначать наиболее безопасные НПВП, своевременно проводить контроль за состоянием внутренних органов и профилактику возникновения или рецидива осложнений (ИПП, низкие дозы аспирина).



