До недавних пор системное лечение метастатического почечноклеточного рака (ПКР) было ограничено применением цитокинов и клиническими испытаниями новых препаратов. Несмотря на то что применение цитокинов являлось стандартным лечением ПКР на протяжении 15 лет, в настоящее время в качестве первой и второй линий терапии используются таргетные препараты на основе ингибиторов тирозинкиназы и моноклональных антител.
Выбор препарата первой линии терапии зависит от нескольких параметров. Во-первых, важно учитывать, к какой группе риска относятся пациенты. Наиболее широко используется модель стратификации риска по критериям Онкологического центра MSKCC (Memorial Sloan Kettering Cancer Center) [1].
Факторы риска, или критерии короткой выживаемости, включают:
- высокий уровень лактатдегидрогеназы (ЛДГ), более, чем в 1,5 раза превышающий верхнюю границу нормы;
- высокий уровень кальция в крови (скорректированный уровень кальция более 10 мг/дл, или 2,5 ммоль/л);
- анемию;
- время от момента установления диагноза до начала системной терапии менее года;
- плохое общее состояние (индекс Карновского < 80).
Пациенты, у которых отсутствуют вышеперечисленные факторы риска, относятся к группе благоприятного или хорошего прогноза, больные с двумя-тремя факторами – к группе промежуточного прогноза, с тремя и более факторами риска – к группе неблагоприятного прогноза.
Во-вторых, для выбора терапии необходимо учитывать гистологический вариант ПКР (светлоклеточный или несветлоклеточный).
К текущему моменту FDA Food and Drug Administration и EMEA (European Medicines Agency) одобрили шесть препаратов для лечения диссеминированного ПКР, пять из них изучались в первой линии терапии: сунитиниб, сорафениб, темсиролимус, пазопаниб и бевацизумаб в комбинации с интерфероном.
Сунитиниб (Сутент) – мультикиназный ингибитор, селективно ингибирующий несколько рецепторов тирозинкиназ: рецепторы факторов роста тромбоцитов (PDGFRб, PDGFRв) и фактора роста эндотелия сосудов (VEGFR1, VEGFR2, VEGFR3), а также рецептор фактора стволовых клеток (c-KIT), FMS-подобную тирозинкиназу (Flt3), рецептор колониестимулирующего фактора (CSF-1R) и рецептор нейротрофического фактора (RET). Согласно экспериментальным данным, противоопухолевая активность сунитиниба может быть связанной с подавлением как ангиогенеза, так и пролиферации клеток [2, 3].
Чтобы оценить клиническую эффективность сунитиниба у больных метастатическим ПКР, ранее не получавших лечение, было проведено крупное международное кооперированное исследование III фазы [4], в котором 750 пациентов с метастатическим светлоклеточным ПКР (относящихся к любой группе риска) были рандомизированы в две группы: в первой (n = 375) назначали сунитиниб внутрь в дозе 50 мг, во второй (n = 375) – интерферон (ИФН). Больные, отобранные для исследования, ранее не получали системного лечения, были в хорошем состоянии и имели измеряемые очаги. Основным критерием эффективности в данном исследовании была безрецидивная выживаемость (БВ), дополнительными – общее влияние терапии на пациентов, общая выживаемость (ОВ), частота ответов и безопасность препаратов. При стратификации учитывали активность ЛДГ сыворотки, оценку по шкале ECOG (0 баллов или 1 балл) и наличие нефрэктомии в анамнезе. Группы были хорошо сбалансированы; медиана возраста составила 60 лет, 90 % больных была выполнена нефрэктомия. Приблизительно 90 % пациентов относились к группам благоприятного или промежуточного прогноза по критериям MSKCC. Медиана БВ составила 11 месяцев в группе сунитиниба и 5 – в группе ИФН (различия достоверны; p < 0,001).
Частота объективных ответов, по оценке исследователей, составила 47 % в группе сунитиниба и 12 – в группе ИФН (различия достоверны; р < 0,001) [5]. Частота тяжелых побочных эффектов (токсичность III–IV степеней) была приемлемой. В группе пациентов, получавших сунитиниб, отмечены нейтропения (у 12 % больных), тромбоцитопения(8 %), повышение активности амилазы сыворотки (5 %), диарея (5 %), ладонно-подошвенный синдром (5 %) и артериальная гипертензия (8 %). В группе ИФН чаще наблюдалась утомляемость (12 против 7 % пациентов, получавших сунитиниб). Согласно обновленным результатам, применение сунитиниба в рамках первой линии терапии увеличивает ОВ больных: в группе сунитиниба ОВ составила 26,40 месяца по сравнению с 21,81 – в группе ИФН (р = 0,051). Медиана ОВ в группе больных, получивших только сунитиниб или ИФН, без последующего включения пациентов с прогрессированием болезни на ИФН в группу сунитиниба, составила 28,1 и 14,1 месяца для сунитиниба и ИФН соответственно (различия достоверны; р = 0,0033).
На основании результатов этих исследований и данных о переносимости сунитиниб был рекомендован в качестве первой линии терапии больным нерезектабельным ПКР IV стадии, а также пациентам с прогрессированием ПКР (уровень обоснованности рекомендаций для светлоклеточного ПКР – 1, для несветлоклеточного – 2A). Согласно недавно полученным результатам исследований с расширенным доступом, сунитиниб безопасен и эффективен у пациентов с метастазами в головной мозг, несветлоклеточным ПКР и у больных с плохим общим состоянием [6, 7].
Бевацизумаб (Авастин) – рекомбинантное моноклональное антитело к VEGF-A, которое связывает и нейтрализует циркулирующий VEGF-A. В рандомизированном исследовании II фазы 116 пациентов с метастатическим ПКР, устойчивых к терапии интерлейкином-2 (ИЛ-2), были распределены в группы бевацизумаба в низкой дозе (n = 37), бевацизумаба в высокой дозе (n = 39) и плацебо (n = 40) [8]. Для группы больных, получавших бевацизумаб в высокой дозе, отмечено достоверное увеличение времени до прогрессирования по сравнению с группой, получавшей плацебо. Достоверных различий во времени до прогрессирования между группами “бевацизумаб в низкой дозе” и “плацебо” получено не было. Частота ответа при лечении бевацизумабом составила 10 % (у нескольких пациентов отмечена продолжительная стабилизация заболевания или небольшое уменьшение опухолевых очагов), а время до прогрессирования – 4,8 месяца против 2,5 по сравнению с плацебо (р < 0,001). Вероятность прогрессирования заболевания в группе, получавшей бевацизумаб в высокой дозе, была в 2,55 раза ниже по сравнению с плацебо. Достоверных различий в ОВ (основной критерий эффективности в этом исследовании) между группами отмечено не было (р > 0,20). Побочные эффекты всех степеней токсичности были достоверно выше в группе “бевацизумаб в высокой дозе” и включали артериальную гипертензию (36 %), бессимптомную протеинурию (64 %,) гематурию (13 %), а также носовое кровотечение (20 %).
Впоследствии было проведено кооперированное рандомизированное двойное слепое исследование III фазы (AVOREN) по сравнению эффективности комбинации бевацизумаба и ИФН с комбинацией плацебо и ИФН. Рандомизации было подвергнуто 649 больных (лечение получил 641 пациент) [9]. Добавление бевацизумаба к ИФН статистически значимо увеличило БВ (10,2 месяца по сравнению с 5,4; р = 0,0001) и частоту объективных ответов (31 против 13 %; р = 0,0001). Новые побочные эффекты, помимо ожидаемых, для каждого препарата по отдельности при их применении в комбинации не отмечены. Кроме того, наблюдалась тенденция к повышению ОВ. Согласно окончательным результатам исследования AVOREN, медиана ОВ пациентов, получавших бевацизумаб в комбинации с ИФН, составила 23,3 месяца по сравнению с 21,3 –у больных, получавших плацебо в комбинации с ИФН. Различия были статистически незначимыми (р = 0,1291) [10].
Сходное исследование (CALGB 90206) провела в США исследовательская группа B по изучению рака и лейкозов (CALGB —Cancer and Leukemia Group B). В этом исследовании 732 больных, ранее не получавших лечение, были рандомизированы в две группы: в первой применяли только ИФН, во второй —комбинацию бевацизумаба и ИФН. По сравнению с одним ИФН применение комбинации сопровождалось увеличением БВ (8,5 месяца по сравнению с 5,2; р < 0,0001) и частоты объективных ответов (25,5 против 13,1 %; р < 0,0001). Однако в группе пациентов, получавших комбинацию препаратов, отмечено увеличение токсичности.
Результаты этого исследования были представлены в виде тезисов на ежегодном конгрессе ASCO в 2009 г. Согласно этим тезисам, медиана ОВ пациентов, получавших комбинацию бевацизумаба и ИФН (18,3 месяца), была выше, чем в группе, получавшей комбинацию ИФН и плацебо (17,4 месяца). Однако в этом исследовании различия также не были достоверными (р = 0,097) [11].
На основании данных о достижении первичной конечной точки эффективности (БВ) бевацизумаб в комбинации с ИФН был рекомендован в качестве одного из вариантов первой линии терапии больных метастатическим светлоклеточным ПКР с хорошим прогнозом (уровень доказательности 1).
Сорафениба тозилат (Нексавар) – низкомолекулярный ингибитор многочисленных изоформ внутриклеточной серин-треониновой киназы Raf, в т. ч. c-raf и b-raf, а также ряда рецепторов с тирозинкиназной активностью, в т. ч. VEGFR1, VEGFR2, VEGFR3, PDGFRβ, Flt3 и c-kit [12–14]. В рандомизированном исследовании II фазы была изучена эффективность и безопасность сорафениба по сравнению с ИФН у больных светлоклеточным ПКР, ранее не получавших лечение [15]. Больные (n = 189) были рандомизированы в две группы: первую – сорафениба (400 мг внутрь 2 раза в сутки длительно), вторую – ИФН. В исследовании была предусмотрена возможность повышения дозы сорафениба до 600 мг 2 раза в сутки и перехода с ИФН на сорафениб в дозе 400 мг 2 раза в сутки при прогрессировании заболевания. Основным критерием эффективности была БВ. В группе ИФН лечение было проведено 90 из 92 больных, прогрессирование отмечено у 56 пациентов, 50 из них получали сорафениб в дозе 400 мг 2 раза/сут. В другой группе лечение сорафенибом получали все 97 больных. Медиана БВ в группе сорафениба (400 мг 2 раза в сутки) составила 5,7 месяца по сравнению с 5,6 – в группе ИФН. Достоверных различий выявлено не было.
В целом частота побочных эффектов в обеих группах была сходной, хотя кожная токсичность (сыпь, ладонно-подошвенный синдром) и диарея чаще наблюдались в группе сорафениба, а гриппоподобный синдром – в группе ИФН. Медиана БВ у больных (n = 50), переведенных с ИФН на сорафениб в дозе 400 мг 2 раза в сутки, составила 5,3 месяца. Медиана БВ в группе пациентов (n = 44), у которых доза сорафениба была повышена до 600 мг 2 раза в сутки, составила 3,6 месяца. Пациенты хорошо переносили препарат в такой дозе. Дальнейший анализ эффективности сорафениба в высоких дозах требует набора большего числа больных. На основании данных исследований был сделан вывод о возможности использования сорафениба в первой линии только у некоторых пациентов с ПКР в отсутствие других вариантов лечения, соответствующих уровню доказательности 1.
Темсиролимус (Торизел) – мощный специфический ингибитор белка mTOR (mammalian target of rapamycin – мишень рапамицина у млекопитающих). Этот препарат одобрен FDA30 мая 2007 г. для лечения ПКР и в настоящее время уже зарегистрирован в России. Белок mTOR регулирует потребление питательных веществ клетками, их рост и ангиогенез за счет разнонаправленных влияний на ряд протеинов. Эффективность и безопасность темсиролимуса продемонстрированы во втором промежуточном анализе глобального кооперированного открытого рандомизированного исследования III фазы ARCC, в которое включили пациентов, ранее не получавших лечение, с метастатическим ПКР и тремя или более неблагоприятными прогностическими факторами [16]. Этими факторами были: срок с момента постановки диагноза до начала системного лечения менее года, оценка по шкале Карновского 60–70 %, уровень гемоглобина ниже нижней границы нормы, скорректированный уровень кальция сыворотки более 10 мг/дл, активность ЛДГ сыворотки, более чем в 1,5 раза превышающая верхнюю границу нормы, и/или метастатическое поражение более одного органа. 626 больных были рандомизированы в три группы: в первой (n = 207) назначали только ИФН, во второй (n = 209) – только темсиролимус в дозе 25 мг, в третьей (n = 210) – комбинацию темсиролимуса в дозе 15 мг и ИФН. При стратификации учитывали наличие нефрэктомии в анамнезе и географический регион, 70 % больных были младше 65 лет, 69 % пациентов составляли мужчины. Темсиролимус вводили внутривенно в течение 30–60 минут еженедельно до развития прогрессирования или неприемлемой токсичности. Рекомендовали премедикацию антигистаминными средствами. В группе пациентов, получавших только темсиролимус, отмечено статистически значимое увеличение ОВ (р = 0,008), которая была основным критерием эффективности в данном исследовании. Медиана ОВ в группе темсиролимуса была 10,9 месяца по сравнению с 7,3 – в группе ИФН. Дополнительным критерием эффективности в данном исследовании была БВ. Медиана этого показателя в группе темсиролимуса (5,5 месяца) была выше, чем в группе пациентов, получавших ИФН (3,1 месяца). Применение комбинации темсиролимуса и ИФН не приводило к статистически значимому повышению продолжительности жизни больных по сравнению с применением одного ИФН, но увеличивало число разнообразных побочных эффектов. Среди побочных эффектов III–IV степеней, которые чаще встречались у больных, получавших темсиролимус, по сравнению с пациентами, получавшими ИФН, были зарегистрированы сыпь, стоматит, боль, инфекционные осложнения, периферические отеки, тромбоцитопения, нейтропения, гиперлипопротеидемия, гиперхолестеринемия и гипергликемия.
На основании полученных данных члены экспертных групп по раку почки отнесли темсиролимус к первой линии терапии диссеминированного светлоклеточного и несветлоклеточного ПКР с неблагоприятным прогнозом (уровень обоснованности рекомендаций 1).
Пазопаниб (Вотриент) – пероральный мультикиназный ингибитор ангиогенеза, подавляющий активность VEGFR1, VEGFR2, VEGFR3, а также PDGFR. Эффективность и безопасность пазопаниба оценены в рандомизированном многоцентровом исследовании III фазы [17]. Пациенты с метастатическим ПКР, не получавшие лекарственное лечение или получавшие 1-ю линию терапии цитокинами, были распределены в соотношении 2 : 1 в группу пазопаниба или плацебо. Пазопаниб назначали в дозе 800 мг перорально 1 раз в сутки до прогрессирования болезни. В исследование были включены 435 пациентов (290 – в группу пазопаниба, 145 – в группу плацебо). БВ составила 11,1 и 2,8 месяца для пазопаниба и плацебо у пациентов, не получавших ранее лечения (различия достоверны, р < 0,0001), а в группе больных с прогрессированием на цитокинах – 7,4 и 4,2 месяца (различия достоверны; р < 0,001). Общая частота ответов на терапию пазопанибом и плацебо составила 30 и 3 % соответственно (р < 0,001). Таким образом, на основании достоверных различий был сделан вывод об эффективности терапии пазопанибом у пациентов с метастатическим ПКР в первой линии (уровень доказательности 1 для светлоклеточного и 3 – для несветлоклеточного ПКР).
Эффективность различных таргетных препаратов представлена в сводной табл. 1.
Таблица 1. Эффективность таргетных препаратов первой линии по сравнению с ИФНили плацебо в рандомизированных исследованиях.
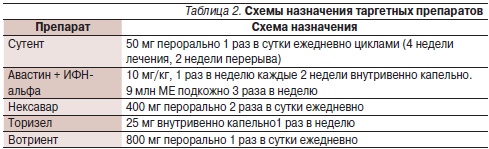
Схемы назначения таргетных препаратов приведены в табл. 2.
Таким образом, результаты рандомизированных исследований свидетельствуют об эффективности различных таргетных препаратов первой линии терапии метастатического ПКР. Особое внимание должно быть уделено стандартизации подходов к оказанию медицинской помощи согласно критериям эффективности, внедрению новых препаратов в повседневную практику врача.
Информация об авторе:
Тимофеев Илья Валерьевич – директор Бюро по изучению рака почки, член научного совета международной Ассоциации по раку почки.
E-mail: office@kidneytumor.org



