Актуальность
Пандемия новой коронавирусной инфекции, начавшаяся в 2019 г., явилась вызовом в т.ч. и дерматовенерологической службе всех стран, заставившим задуматься над разработкой новых терапевтических подходов к кожным поражениям у больных COVID-19, оптимизировать тактику лечения тяжелых дерматозов иммуносупрессивными средствами, активизировать использование теледерматологии, оценить побочные эффекты использования различных средств индивидуальной защиты для медицинского персонала и пациентов, определить методы их нейтрализации [1]. Большое значение приобрели трихологические аспекты инфекции, вызванной вирусом SARS-CoV-2, т.к. после начала пандемии COVID-19 вопрос выпадения волос у лиц, перенесших данное заболевание, приобрел угрожающие масштабы. Выпадение, изменение объема и качества волос – это ведущие причины обращения пациента к врачам дерматологам и трихологам.
В связи с необходимостью сформулировать эффективный протокол лечения изучение патогенеза постковидного выпадения волос представляется актуальной задачей.
Патофизиологические факторы развития постковидных осложнений
Разнонаправленная активность вируса SARS-CoV-2 связана с его высокой генетической изменчивостью, способностью вызывать извращенный иммунный ответ; патологическая реакция врожденного иммунитета может вызывать чрезмерное выделение провоспалительных цитокинов [2]. Оценка сывороточных цитокинов у тяжелобольных пациентов, инфицированных SARSCoV-2, при поступлении в стационар показала, что уровни интерлейкина-2R (ИЛ-2R), -6, -10 и фактора некроза опухоли-α (ФНО-α) были заметно выше в тяжелых случаях инфекции, чем при средней тяжести течения [3]. Данная патологическая реакция провоцирует в организме человека обширный воспалительный процесс [4]. Механизмы этих явлений не совсем ясны, но считаются многофакторными. Выпадение волос, как и другие кожные проявления COVID-19, могут быть обусловлены отсроченными иммунологическими реакциями на инфекцию [4].
Представляется принципиальным рассмотрение роли эндотелия в воспалении при новой коронавирусной инфекции. Эндотелиальные клетки являются основными участниками и регуляторами воспалительных реакций. При воспалении решающую роль играют различные изменения активности эндотелия, а именно увеличение проницаемости, расширение сосудов, усиление экстравазации лейкоцитов, повышение коагуляции и тромбообразования. Это приводит к срыву адаптационно-компенсаторных механизмов и системному повреждению эндотелия с последующей гибелью большого числа эндотелиальных клеток, что сопровождается дисрегуляцией сосудистого тонуса, процессов гемостаза и потерей базовой барьерной функции. В результате роль эндотелия как регулятора сосудистого тонуса утрачивается.
Указанные изменения приводят к нарушению перфузии тканей, развитию их гипоксического повреждения и последующей органной недостаточности. Соответственно, системная активация и повреждение эндотелия сосудов являются важнейшими компонентами патогенеза полиорганной дисфункции. Эндотелиальная дисфункция – сложный многогранный процесс, в основе которого лежит, во-первых, дисбаланс между вазоконстрикцией и вазодилатацией, во-вторых, нарушение выработки факторов воспаления и пролиферации сосудов, в-третьих, повреждение в системе тромбообразования [6]. Интенсивное воспаление сосудистой стенки приводит к обширному повреждению эндотелия, активации тромбоцитов с последующим нарушением процессов коагуляции. При нарушении функции или структуры эндотелия резко меняется спектр выделяемых им биологически активных веществ [7].
Современные знания в области иммунологии, патофизиологии, клинической медицины позволяют сделать предположение о ведущей роли в патогенезе инфекционного процесса, обусловленного SARS-CoV-2, эндотелиальной дисфункции с вовлечением в реализацию морфофункциональных нарушений системы адгезивных молекул эндотелиоцитов, тромбоцитов и иммуноцитов [8]. Эндотелиит при COVID-19 может усугублять состояние пациентов с уже имеющейся эндотелиальной дисфункцией. При этом мужской пол пациента, пожилой возраст и хронические сопутствующие заболевания способствуют неблагоприятным исходам [9].
У пациентов с тяжелым течением COVID-19 наблюдаются различные тромботические осложнения, в т.ч. тромоэмболии легочной артерии. Вместе с тем у больных часто отмечается развитие тромбозов микроциркуляторного русла. Многочисленные исследования выявили наличие системной коагулопатии, которая развивается на фоне COVID-19. В связи с этим при обследовании пациентов с подозрением на COVID-19 или госпитализации с уже подтвержденным заболеванием рекомендуется проведение тестов для скрининга нарушений системы гемостаза [10]. Очень высокие уровни в плазме факторов свертывания и фактора Виллебранда, а также гистологическое исследование аутопсийных материалов различных органов пациентов с тяжелым течением COVID-19 указывают на глубокое поражение эндотелия при коагулопатии у больных в критическом состоянии. В эндотелиальных клетках обнаружено наличие вирусных частиц и скопление воспалительных клеток с признаками гибели. Эти данные свидетельствуют о том, что инфекция SARS-CoV-2 способствует развитию эндотелиита в органах и тканях как прямое следствие вирусного поражения. Кроме того, индукция апоптоза и пироптоза может играть важную роль в повреждении эндотелиальных клеток у пациентов с COVID-19. Развитие эндотелиита у пациентов с COVID-19 может объяснить системные нарушения микроциркуляторной функции в различных сосудистых руслах и их клинические последствия [11]. Продолжающаяся активация свертывания, связанная с тяжестью заболевания, дополнительно характеризуется тромботической микроангиопатией и эндотелиитом. Эти микроангиопатические изменения нельзя классифицировать как классическое диссеминированное внутрисосудистое свертывание [12]. В патогенез критического состояния пациентов, вызванного инфекцией SARS-CoV-2, могут быть вовлечены по крайней мере 4 патофизиологические системы: ренин-ангиотензиновая, калликреин-кининовая, система комплемента и система свертывания [13–15].
Система гемостаза, будучи первой по скорости реагирования и наиболее чувствительной, является также одной из самых уязвимых систем организма. Существующие стандартные лабораторные тесты позволяют оценивать лишь активность отдельных звеньев системы гемостаза. Изучение литературных данных показывает, что единой динамики показателей стандартной коагулограммы у пациентов с различной степенью тяжести COVID-19 не наблюдается, в т.ч. совокупность этих тестов не дает ответа о группах риска развития гемостазиологических осложнений у больных на фоне течения новой коронавирусной инфекции [16]. Для комплексной оценки плазменного звена системы гемостаза может с успехом быть использован метод тромбодинамики, основанный на имитации повреждения стенки кровеносного сосуда и оценке последующего роста фибринового сгустка. Именно этот метод был использован в нашем исследовании. Выявление повреждения микрососудов у пациентов с постковидным выпадением волос позволит обосновать введение в протоколы комплексной терапии постковидного синдрома наружных и системных препаратов, мишенью которых является восстановление перифолликулярной васкуляризации.
Кожные и трихологические поражения при COVID-19
По мере развития пандемии возрастало число случаев дерматологических и трихологических проявлений COVID-19 [5]. Показано, что на выпадение волос влияют подавление ряда факторов роста ввиду коллапса иммунной привилегии, местное и системное воспаление, оксидативный стресс, состояние тканевой гипоксии, микрососудистая недостаточность, проявляющаяся стойким спазмом капилляров [17].
Полиорганное поражение, в т.ч. кожи и волосяных фолликулов, вирусом SARS-CoV-2 связано с использованием для проникновения в клетку рецепторов ангиотензин-превращающего фермента – АПФ-2 [18, 19]. Рецепторы АПФ-2 расположены в альвеолах, клетках тонкого и толстого кишечника, желчного пузыря, ствола головного мозга, пищевода, сердца и крупных и мелких сосудов, в базальном слое эпидермиса, а также в волосяных фолликулах [20]. Таким образом, любые клетки, в т.ч. кожи, несущие рецептор АПФ-2, являются потенциальной мишенью SARS-CoV-2 [21–23]. Рецепторы АПФ-2 экспрессируются также эндотелиальными клетками. В настоящее время изучается, связаны ли сосудистые нарушения при COVID-19 с поражением эндотелиальных клеток вирусом [24].
Очевидно, что изменения кожи при инфицировании SARS-CoV-2 отличаются чрезвычайным полиморфизмом. Ранее мы обобщили сведения о многочисленных кожных проявлениях новой коронавирусной инфекции, связанных с COVID-19 [1, 25]. S. Matar et al. предложили свою классификацию кожных поражений [26]. Гистологически чаще всего выявлялась микроангиопатия в виде деструктивно-продуктивного тромбоваскулита [27].
Трихологические последствия инфекции, вызванной SARS-CoV-2, оказались не менее разнообразными, наиболее стойкими и психотравмирующими для пациентов, они требуют особого внимания. S. Lopez-Leon et al. зарегистрировали выпадение волос после перенесенного COVID-19 более чем у 25% пациентов [28]. В ходе исследования клинических последствий перенесенного COVID-19 в Ухани (Китай) показано, что распространенность алопеции как осложнения достигла 48,5%. С каждым днем появляется все больше доказательств, указывающих на волосы и ногти как на еще одну возможную мишень действия новой коронавирусной инфекции [29–31].
Наблюдения показали ассоциацию между COVID-19 и различными типами алопеций, включая андрогенетическую (АГА), очаговую (АА – alopecia areata), телогеновую (TE – telogen effluvium) и анагеновую алопецию (AE – аnagen effluvium) [5, 32]. H. Olds et al. (2021) сообщили, что у 10 пациентов с разнообразным этническим происхождением (средний возраст – 48,5 лет) диагностирована ТЕ в среднем через 50,1 дня после постановки диагноза COVID-19 [33]. В исследовании В. Nguyen et al. (2022) выделено 3 наиболее распространенных типа алопеции: АГА (n=561/1826; 30,7%), ТЕ (n=362/1826; 19,8%) и АЕ (n=143/1826; 7,8%). Преобладание мужчин наблюдалось при АГА (n=504/561; 89,8%), тогда как в группе ТЕ и АА преобладали женщины (n=284/352; 80,7% и n=6/10, 60% соответственно). Показатели выживаемости у пациентов со всеми типами алопеции стремились к 100%, кроме АГА с показателем выживаемости 79,2% (n=38/48). Сообщается, что всем пациентам с COVID-19, у кого были симптомы АГА, диагноз АГА уже был установлен ранее. Аналогично большинству пациентов с COVID-19 с проявлениями АА этот диагноз выставлялся уже ранее. Напротив, пациенты с установленной постковидной ТЕ ранее не имели проблем с выпадением волос [34]. А. Goren et al. (2020) отмечают повышенную распространенность АГА среди пациентов с тяжелой формой COVID-19. Показано, что у 41 (71%) пациента, госпитализированного в Испании с пневмонией, связанной с COVID-19, имелась АГА. Последующее исследование, проведенное теми же авторами, обобщило полученный расширенный клинический материал. Анализ этих и других данных свидетельствует, что АГА связана с развитием тяжелого течения COVID-19 [35–37].
После перенесенной коронавирусной инфекции также нередко наблюдается дебют различных аутоиммунных патологий. COVID-19 вследствие гиперстимуляции иммунной системы и молекулярной мимикрии, характерной для вирусных инфекций, может стимулировать выработку ряда аутоантител, которые в свою очередь могут провоцировать развитие различных аутоиммунных патологий, таких как тромбоцитопеническая пурпура, синдром Гийена–Барре, аутоиммунный тиреоидит, аутоиммунная гемолитическая анемия и т.д. [38]. К данной группе патологий относится и очаговая алопеция (АА). АА, развившаяся после перенесенного COVID-19, имеет характерные клиническую и дерматоскопическую картины. Литературные данные свидетельствуют, что наиболее часто АА развивается у пациентов, в анамнезе которых уже был эпизод данного заболевания, т.е. фактически после перенесенной инфекции COVID-19 болезнь рецидивирует. Однако отмечено, что между интенсивностью выпадения волос и тяжестью перенесенной коронавирусной инфекции нет четкой корреляции [34]. Следует отметить, что выпадение волос после заражения SARS-CoV-2 не пощадило и самых юных пациентов, что налагает на дерматологов еще большую ответственность. Y. Hayran et al. (2021) описали пациентов в возра-сте 10 и 13 лет, у которых развились ТЕ и АА соответственно [39], под нашим наблюдением также есть пациентка 15 лет с явлением постковидной ТЕ.
На текущий момент проведены многочисленные исследования коагулопатий у пациентов с новой коронавирусной инфекцией, находившихся на стационарном лечении в отделениях реанимации и интенсивной терапии, обычных терапевтических отделениях, но мало изучены отдаленные последствия данной инфекции для системы гемостаза в амбулаторной практике, к которой относятся и массовые обращения пациентов с постковидным выпадением волос к дерматологам и трихологам. Стандартные тесты свертывания не показали себя надежными критериями для оценки системы свертывания у больных COVID-19.
Цель исследования: оценка состояния системы гемостаза у пациентов с постковидной алопецией методом тромбодинамики.
Методы
Исследуемые пациенты были разделены на 3 группы: 1-я (n=26) – пациенты с постковидной алопецией, 2-я (n=13) – пациенты с алопецией, не болевшие коронавирусной инфекцией, 3-я (n=10) – здоровые люди без проявлений алопеции. Основная 1-я группа исследования состояла из 26 больных женщин с проявлениями постковидного выпадения волос. Средний возраст пациенток составил 38,40±11,14 года. В этой группе выпадение волос у пациенток начиналось в среднем через 2,6 месяца после перенесенной инфекции, 42,3% женщин с симптомами алопеции перенесли COVID-19 в тяжелой форме, 57,7% лечились амбулаторно со средней и легкой формами заболевания; 46,1% пациенток этой группы были с диффузной реактивной алопецией, 34,6% – со смешанной алопецией, 15,5% – с андрогенетической алопецией, 3,8% – с обострением очаговой алопеции.
Группу сравнения составили 13 пациенток женского пола преимущественно с андрогенетической алопецией, без Covid-19 в анамнезе, средний возраст пациенток – 35,8±11,9 года. Группу физиологического контроля составили 10 женщин без острых и хронических патологий, без симптомов выпадения волос, без лекарственной нагрузки. Средний возраст – 26,30±2,08 года.
Материалом для исследования системы гемостаза служили образцы венозной крови, взятие которых осуществляли из периферической вены c помощью закрытых систем S-Monovette® (SARSTEDT, Германия) с цитратом натрия 3,2%. Бедную тромбоцитами плазму получали центрифугированием в течение 15 минут при 1600 g, затем часть плазмы повторно центрифугировали при 10 тыс. g в течение 5 минут для получения плазмы, свободной от тромбоцитов.
Оценку состояния системы гемостаза проводили с помощью теста тромбодинамики (ТД) на лабораторной диагностической системе «Регистратор тромбодинамики Т-2» (ООО ГемаКор, Россия). Тест ТД используется для диагностики нарушений системы плазменного гемостаза, выявления рисков кровотечений и тромбообразования [40, 41]. Основу метода ТД составляют фоторегистрация и анализ пространственно-временной динамики роста фибринового сгустка в гетерогенной in vitro системе без перемешивания (рисунок). Процесс запускается в одноразовой измерительной кювете от локализованного активатора свертывания (тканевого фактора) и распространяется в тонком слое образца плазмы. Процесс возникновения и роста фибринового сгустка регистрируют прибором в режиме последовательной фотосъемки цифровой фотокамерой в течение 30 минут. На основе полученной серии фотоизображений процесса свертывания в измерительной кювете строится зависимость размера сгустка от времени и рассчитываются численные параметры пространственной динамики роста фибринового сгустка и спонтанного тромбообразования: Tlag – время задержки роста сгустка (мин), V – средняя скорость роста сгустка, рассчитанная на 15–25-й минуте (мкм/мин), Vi – начальная скорость роста сгустка вблизи активаторной области (мкм/мин), Vst – стационарная скорость роста сгустка вдали от активной поверхности (мкм/мин), оценивающая автоволновую составляющую распространения тромба в пространстве, CS – размер сгустка на 30-й минуте исследования (мкм), D – относительный показатель плотности образовавшегося фибринового сгустка (у.е.) [42].
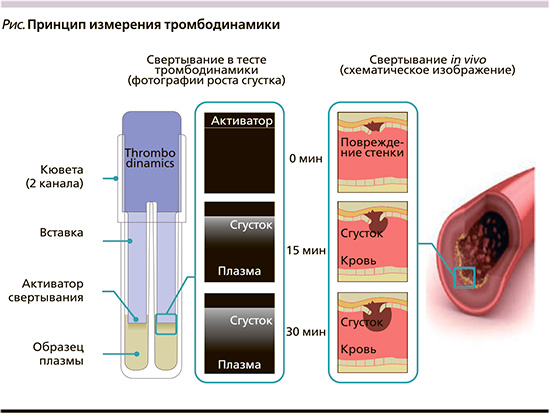
Результаты
При оценке показателей теста ТД выявлены изменения у больных алопецией, перенесших коронавирусную инфекцию (см. таблицу). Были достоверно повышены параметры стационарной скорости Vst: 31,80±0,30 у больных, 22,4±1,6 у здоровых людей; начальная скорость Vi составила 57,25±4,10 у больных и 46,8±2,9 у здоровых людей, размер фибринового сгустка CS был достоверно больше у больных (1246,3±49,5) по сравнению со здоровыми лицами (934±41,4). Также был отмечен высокий прокоагулянтный потенциал плазмы у больных алопецией после перенесенной коронавирусной инфекции: из 26 обследуемых образование спонтанных сгустков зарегистрировано у 10. В группе лиц, не перенесших Covid-19, спонтанные фибриновые сгустки не выявлены.
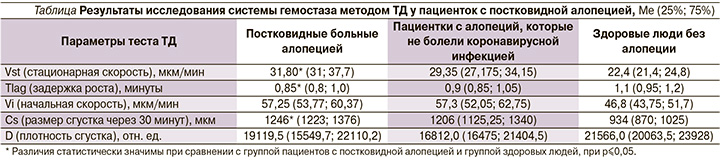
Оценка состояния системы гемостаза с помощью теста ТД показала высокую частоту развития гемостазиологических нарушений разной степени выраженности у 87% пациенток группы постковидных алопеций. В частности, у 35% обследованных из данной группы выявлялись умеренная гиперкоагуляция, у 38,5% – выраженная, у 4% – массивная гиперкоагуляция. Гиперкоагуляция у 39% пациенток сопровождалась образованием патологических спонтанных сгустков. Диагностированная у 8% пациенток гипокоагуляция, вероятнее всего, была обусловлена снижением белоксинтезирующей функцией печени, подтвержденной снижением уровня альбумина в сыворотке крови. Наиболее выраженные изменения показателей ТД были характерны для пациенток с диффузной реактивной алопецией в составе группы постковидных алопеций. В группе пациенток с алопециями, не перенесших COVID-19, статистически значимых различий параметров тромбодинамики по сравнению с группой здоровых лиц не выявлено.
Обсуждение
Выявление признаков поражения микроциркуляторного русла у пациенток с развившимся постковидным выпадением волос, указывает на клиническую значимость данного симптома и необходимость целенаправленной коррекции методами системной и наружной терапии, улучшающими кислородный метаболизм тканей. Наличие разнонаправленных изменений микроциркуляции у данного профиля больных подтверждают результаты исследования кровотока в области волосистой кожи головы методом лазерной допплеровской флоуметрии [43]. Следовательно, при выборе терапии следует учитывать необходимость коррекции выявленных нарушений микроциркуляции.
Заключение
Таким образом, анализ сообщений различных авторов об алопециях как о последствии перенесенной COVID-19 показал что: 1) острое телогеновое выпадение волос является наиболее частым вариантом постковидного выпадения волос у людей без выпадения волос в анамнезе; в патогенезе TE лежит преждевременное завершение фазы анагена; 2) AA и АГА чаще встречаются как рецидив ранее установленного диагноза алопеции; АГА – это фактор тяжелого течения инфекции COVID-19; 3) рецепторы АПФ-2 играют важную роль в патогенезе и характере клинических проявлений COVID-19.
Сообщения о развитии у больных COVID-19 нарушений микроциркуляторной функции, активации свертывания, характеризующейся тромботической микроангиопатией и эндотелиитом, подтверждаются результатами проведенных исследований, которые выявили у большинства пациентов с постковидными алопециями нарушения системы гемостаза протромботической направленности (по данным теста ТД). Тест гемостаза ТД может быть важным инструментом для контроля состояния пациентов с постковидными алопециями, коррекции и оценки эффективности терапии.
Несмотря на завершение пандемии, ее отголоски еще долго будут проявляться в структуре дерматологического и трихологического приема. По мере накопления клинических знаний об особенностях течения инфекционного процесса у различных пациентов будут изменяться подходы к коррекции патологических изменений, вызванных COVID-19, в т.ч. протоколы лечения поражений кожи и волос как в период активного течения болезни, так и в рамках коррекции постковидного синдрома.
Дополнительная информация
Публикация статьи осуществляется в рамках диссертационной работы: «Разработка алгоритма обследования и лечения постковидных алопеций на основании изучения состояния микроциркуляции, особенностей метаболизма».



