Головная боль (ГБ) – одна из самых частых причин обращения пациентов за неврологической помощью. Согласно международной классификации головных болей II пересмотра – МКГБ-II (2003), выделяют первичные формы ГБ (мигрень, ГБ напряжения, тригеминальные вегетативные цефалгии; другие редкие формы первичных ГБ – первичная кашлевая ГБ, гипническая ГБ и др.) и вторичные формы, причинами которых могут служить травмы, поражения сосудов, опухоли, употребление различных веществ, инфекционные заболевания [7]. Несмотря на то что у большинства (98 %) пациентов ГБ носит доброкачественный характер, внимание невролога прежде всего направлено на исключение ГБ, связанной с потенциально опасными состояниями. Необходимо отметить, что первичные формы ГБ не имеют специфических параклинических признаков и их диагностика основана лишь на клинических критериях [9]. Тщательный сбор жалоб и анамнеза, а также данные неврологического осмотра являются достаточными методами диагностики в большинстве случаев. Дополнительные методы диагностики требуются лишь в случаях, когда имеются настораживающие симптомы (“сигналы опасности”) или изменения неврологического статуса (табл. 1).
Таблица 1.“Симптомы опасности” при ГБ.
Негативная диагностика – исключение вторичной ГБ
Критерии вторичной ГБ:
- наличие подтвержденного заболевания, способного вызывать ГБ;
- ГБ возникает или усиливается во временнoй связи с развитием или прогрессированием заболевания, предположительно лежащего в основе цефалгии;
- ГБ регрессирует или уменьшается во временнoй связи с регрессом заболевания, предположительно лежащего в основе цефалгии;
- ГБ имеет характеристики заболевания, предположительно лежащего в основе цефалгии;
- существуют другие доказательства взаимосвязи ГБ и основного заболевания;
- ГБ не соответствует критериям другой формы цефалгии [21, 22].
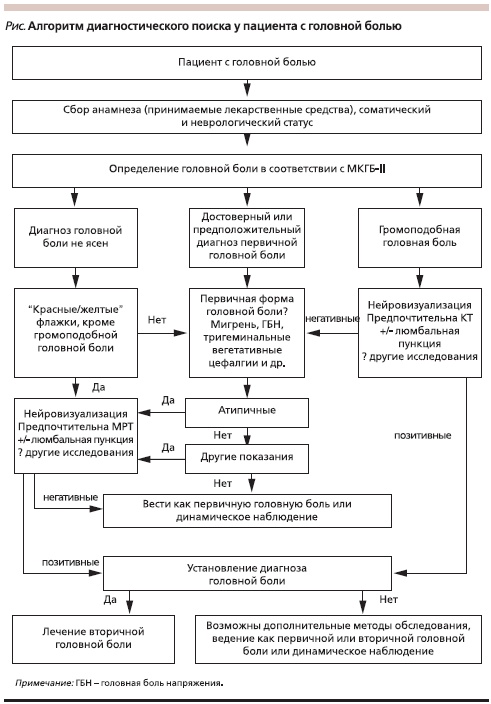
В основе диагностики формы ГБ лежит в первую очередь клинический подход, включающий сбор жалоб, анамнеза и неврологический осмотр. На первом этапе клинического осмотра исключается вторичная ГБ при помощи следующего алгоритма [16, 18]:
- Выявление признаков системного заболевания. Следует выяснить, имеются ли у пациента лихорадка, озноб, потливость в ночное время, миалгия, потеря массы тела. В случае положительного ответа необходимо исключать наличие гигантоклеточного артериита, инфекционных заболеваний, новообразований. Далее необходимо задать вопрос о наличии в анамнезе онкологического заболевания, иммунодефицита, ВИЧ-инфекции. При положительном ответе необходимо исключать метастатическое поражение центральной нервной системы (ЦНС) или оппортунистические инфекции.
- Выявление очаговой и общемозговой неврологической симптоматики, в т. ч. поведенческие нарушения. При наличии неврологической симптоматики необходимо исключать новообразования, воспалительные, инфекционные и сосудистые поражения. Необходимо задать вопрос о двоении в глазах, транзиторных зрительных нарушениях, шуме в ушах и голове, особенно у пациентов с ожирением для исключения идиопатической внутричерепной гипертензии.
- Внезапное начало ГБ (громоподобная ГБ). Для количественной оценки времени развития ГБ у пациента необходимо спросить, за какое время возросла интенсивность ГБ (от своего начала до пика интенсивности). Внезапное начало ГБ характеризуется нарастанием интенсивности боли в течение доли секунд наподобие удара молнии. Громоподобная ГБ характерна для сосудистых эпизодов (субарахноидального кровоизлияния, тромбоза венозных синусов, инсульта, обратимого церебрального вазоконстрикторного синдрома, диссекции церебральных артерий).
- Начало ГБ в возрасте старше 50 лет. Первичные ГБ крайне редко дебютируют в возрасте старше 50 лет. Необходимо исключать новообразования, воспалительные и инфекционные заболевания ЦНС, гигантоклеточный артериит.
- Изменение паттерна ГБ может являться симптомом вторичной ГБ. Под изменением паттерна ГБ подразумеваются прогрессирование ГБ с утратой светлых промежутков, провокация ГБ эквивалентами пробы Вальсавы (кашлем, чиханием, натуживанием, физической нагрузкой; необходимо исключать аномалию Арнольда–Киари, объемные образования, которые приводят к нарушению циркуляции ликвора, ликворею), зависимость интенсивности ГБ от положения тела – усиление боли в положении стоя или лежа (необходимо исключать снижение внутричерепного давления вследствие ликвореи, повышение внутричерепного давления), а также от движения в шейном отделе позвоночника (цервикогенная ГБ).
- Отек диска зрительного нерва. Указание пациента на транзиторные зрительные расстройства, двоение, ограничение полей зрения могут указывать на развитие внутричерепной гипертензии. “Симптомы опасности” при ГБ представлены в табл. 1.
Позитивная диагностика формы ГБ
При исключении вторичной формы ГБ проводится позитивная диагностика первичной ГБ на основании критериев МКГБ-II. Несмотря на то что ГБ напряжения в популяции распространена шире, чем мигрень, среди пациентов, обращающихся к врачу, большинство страдает мигренью. Это связано с тем, что мигрень вызывает существенно бoльшую дезадаптацию. Кроме этого большинство пациентов купируют приступы мигрени неспецифическими лекарственными средствами, недостаточно эффективными.
Критерии диагностики мигрени:
А. По меньшей мере пять приступов, отвечающих критериям Б–Г.
Б. Продолжительность приступов составляет 4–72 часа (без лечения или при неэффективном лечении).
В. ГБ имеет минимум две из следующих характеристик: (1) одностороннюю локализацию; (2) пульсирующий характер; (3) интенсивность боли от средней до значительной; (4) ГБ ухудшается от обычной физической активности или требует прекращения обычной физической активности (например, ходьба по лестнице).
Г. ГБ сопровождается минимум одним из следующих симптомов: (1) тошнотой и/или рвотой; (2) фото- или фонофобией;
Д. ГБ не связана с другими причинами.
Если цефалгия частично соответствует критериям мигрени (имеются лишь типичная ГБ или типичные сопутствующие симптомы), диагностируется вероятная мигрень. Другими словами, если у пациента наблюдается умеренная двусторонняя пульсирующая ГБ, которая усиливается при физической активности, но не сопровождается тошнотой, рвотой, фото- или фонофобией, ее следует расценивать как вероятную мигрень, но не ГБ напряжения. Недостаточная диагностика мигрени и возможной мигрени, а также гипердиагностика ГБ напряжения являются распространенной клинической ситуацией [1, 18]. Для скрининговой диагностики мигрени в клинической практике может быть использована шкала ID-мигрень, состоящая из трех следующих вопросов: за последние 3 месяца приступы Вашей ГБ сопровождались:
- тошнотой и/или недомоганием;
- повышенной чувствительностью к яркому свету;
- мешали выполнению работы или других повседневных дел [24].
Позитивный ответ на два из трех вопросов с высокой долей вероятности соответствует диагнозу “мигрень”.
ГБ напряжения в клинической практике должна быть диагнозом исключения. Как упоминалось, несмотря на широкую распространенность в популяции, ГБ напряжения в редких случаях является поводом для обращения за медицинской помощью. В то же время критерии ГБ напряжения недостаточно специфичны. Так, ГБ у 75 % пациентов с первичными и метастатическими опухолями ГБ соответствуют критериям ГБ напряжения [4, 18].
Тригеминальные вегетативные цефалгии, к которым относятся пучковая ГБ, пароксизмальная гемикрания, гемикрания континуа и SUNCT(Short-lasting, Unilateral, Neuralgiform headache with Conjunctival injection and Tearing)-синдром (кратковременные односторонние невралгические ГБ с инъецированием конъюнктивы и слезотечением), встречаются в клинической практике гораздо реже. Для этих форм характерна односторонняя ГБ, сопровождающаяся выраженными вегетативными симптомами (слезотечением, покраснением глаза, заложенностью носа, ринореей, синдромом Горнера, отечностью, покраснением или побледнением лица на стороне боли). Ключевыми диагностическими критериями тригеминальных вегетативных цефалгий являются продолжительность приступа ГБ и частота возникновения атак в течение суток (табл. 2).
Таблица 2.Основные формы тригеминальных вегетативных цефалгий.
Необходимо отметить, что частота атак различных форм тригеминальных вегетативных цефалгий может варьироваться в значительной степени, боль может не возникать в зоне иннервации первой ветви тройничного нерва, могут отмечаться сопутствующие симптомы, характерные для мигрени (тошнота, фото-, фонофобия).
Дополнительные методы обследования
Диагностика первичных ГБ осуществляется лишь при помощи клинических методов (сбор жалоб, анамнеза, неврологический осмотр). Применение дополнительных методов диагностики необходимо лишь при подозрении на вторичный характер ГБ (см. рисунок). Компьютерная томография (КТ) имеет ограниченные возможности в диагностике вторичных ГБ. Такие состояния, как аневризма, артериовенозная мальформация, расслоение артерий, тромбоз синуса, обратимый церебральный вазоконстрикторный синдром, опухоли, особенно локализованные в задней черепной ямке, гипофизе, мосто-мозжечковой области, метастатические опухоли и карциноматоз оболочек, аномалия Арнольда–Киари, менингоэнцефалит, абсцесс мозга, ликворея, могут не быть диагностированы при помощи КТ. При подозрении на вторичную ГБ, связанную с патологией сосудов ГБ, необходимо проведение неинвазивной КТили магнитно-резонансной (МР)ангиографии. Впервые возникшая громоподобная ГБ является показанием к проведению магнитно-резонансной томографии (МРТ) и МР-ангиографии интракраниальных и экстракраниальных сосудов, даже при нормальных результатах КТ и исследования ликвора [16].
Мигрень с аурой может быть проявлением ряда наследственных заболеваний, а также васкулита. Пациентам молодого возраста с мигренью с аурой, перенесшим ишемический инсульт, показано проведение генетических тестов на выявление синдрома MELAS (myopathy, encephalopathy, lactic acidosis, stroke-like episodes – миопатия, энцефалопатия, лактат-ацидоз, инсультоподобные эпизоды) и синдрома CADASIL (cerebral autosomal dominant arteriopathy with subcortical infarcts and leukoencephalopathy – церебральная аутосомно-доминантная артериопатия с субкортикальными инфарктами и лейкоэнцефалопатией). При подозрении на васкулит необходимо проведение общего анализа крови, коагулограммы, ревмопроб, исследования антител к кардиолипину. При возникновении сосудистых эпизодов у пациентов молодого возраста, страдающих мигренью, показаны транскраниальная допплерография и чреспищеводная эхокардиография (для выявления открытого овального окна). Необходимо отметить, что у 10–20 % больных мигренью с аурой могут быть выявлены “немые” субкортикальные ишемические очаги, генез которых не ясен. Клиническое течение мигрени у этих пациентов не имеет особенностей, и в дополнительных методах диагностики они не нуждаются [19, 20].
В проведении МРТ также нуждаются пациенты с гипнической ГБ, поскольку это лица старшего возраста с дебютом цефалгии. Имеются описания случаев опухолей задней черепной ямки, протекающих под маской гипнической ГБ. Нейровизуализация также показана пациентам с впервые возникшими кашлевой ГБ, вызванной физической активностью, и оргазмической ГБ, т. к. появление цефалгии при кашле и физической активности является симптомом вторичной ГБ [3, 10].
Купирование ГБ
Несмотря на высокую распространенность ГБ напряжения в популяции, за медицинской помощью чаще обращаются пациенты с мигренью, т. к. самостоятельное купирование приступа мигренозной ГБ не всегда эффективно. Согласно Европейским принципам ведения пациентов с наиболее распространенными формами ГБ [15], для купирования приступа мигрени могут быть использованы простые анальгетики (ацетилсалициловая кислота в дозе 900–1000 мг, ибупрофен – 400–800 мг, диклофенак – 50–100 мг, парацетамол – 1000 мг) с противорвотными средствами (домперидоном в дозе 20 мг, метоклопрамидом по 10 мг), а также специфические противомигренозные средства триптаны (суматриптан 50 мг, элетриптан 40 мг, золмитриптан 2,5 мг) и препараты эрготамина тартрата (Номигрен).
Выбор противомигренозного средства осуществляется индивидуально, с учетом частоты и тяжести мигренозных приступов, степени нарушения повседневной активности пациента, выраженности сопутствующих симптомов, а также эффективности ранее проводимой терапии и сопутствующих заболеваний [2, 6, 11–13]. Так, для быстрого купирования приступов с быстрым нарастанием цефалгии препаратами выбора являются парентеральные формы триптанов, тогда как препараты эрготамина показаны пациентам с возвратом ГБ [14]. Одной из пероральных форм эрготамина является комбинированный препарат Номигрен, содержащий 0,75 мг эрготамина тартрата, 80 мг кофеина, 200 мг пропифеназона, 20 мг меклоксамина цитрата и 25 мг камилофина хлорида. Препарат сочетает высокую эффективность с его хорошей переносимостью [17].
В многоцентровое рандомизированное исследование клинической эффективности Номигрена был включен 401 пациент с мигренью. В 80 % случаев приступы были тяжелыми, цефалгия сопровождалась тошнотой и рвотой, в 51 % случаев приступы мигрени продолжались более 6 часов. Применение Номигрена было эффективным у 91,6 % пациентов: у 70 % больных ГБ купирована полностью или значительно уменьшились ее выраженность и продолжительность; у 21 % пациентов произошло умеренное снижение интенсивности ГБ и продолжительности приступа. В другом исследовании пациенты принимали одну таблетку препарата в начале атаки. Полное купирование боли или ее значительное уменьшение отмечалось у 86 % пациентов [8]. В исследовании И.А. Григоровой и соавт. прием Номигрена купировал приступ или позволял значительно уменьшать выраженность цефалгии у 73,5 % пациентов [5].
Для купирования приступа ГБ напряжения используются простые анальгетики – ацетилсалициловая кислота (600–100 мг), ибупрофен (400–800 мг), менее эффективен парацетамол (1000 мг). Пациентам с частыми приступами ГБ напряжения необходимо избегать приема опиатсодержащих средств, кофеина и барбитуратов, т. к. чрезмерное использование этих средств может привести к развитию хронической медикаментозно-индуцированной ГБ [9].
Лечение тригеминальных вегетативных цефалгий в большей степени должно быть профилактическим, т. к. продолжительность приступа ГБ невелика и эффект большинства средств развивается к завершению атаки. Приступ кластерной ГБ может быть купирован путем подкожного введения суматриптана (6 мг), применения назального спрея суматриптана (20 мг) или ингаляций 100 %-ного кислорода (≥ 7 л/мин в течение 15 минут). Анальгетики и опиатсодержащие средства для купирования пучковой ГБ не используются.
Редкие формы первичных ГБ продолжительностью более получаса также требуют применения лекарственных средств для их купирования. Так, существуют данные об эффективности индометацина при лечении первичной кашлевой ГБ [22]. Следует отметить, что индометацин может быть эффективным и для купирования вторичной кашлевой ГБ, что следует учитывать при проведении дифференциальной диагностики. Первичная ГБ, связанная с физической активностью, а также оргазмическая ГБ могут быть купированы индометацином или эрготамина тартратом [1, 10, 23].
Таким образом, алгоритм ведения пациентов с ведущей жалобой на приступы ГБ включает следующие мероприятия:
- клиническую, а при наличии показаний параклиническую негативную диагностику вторичной ГБ;
- клиническую позитивную диагностику формы первичной формы ГБ, согласно критериям МКГБ-II;
- индивидуальный стратифицированный подбор средства для купирования ГБ.
Информация об авторах:
Азимова Юлия Эдвардовна – кандидат медицинских наук, научный сотрудник отдела неврологии
и клинической нейрофизиологии НИЦ ГОУ ВПО “Первый МГМУ им. И.М. Сеченова”.
Тел. 8 (499) 248-69-44, e-mail: julia_azimova@mtu-net.ru;
Табеева Гюзяль Рафкатовна – доктор медицинских наук, профессор, заведующая отделом неврологии
и клинической нейрофизиологии НИЦ ГОУ ВПО “Первый МГМУ им. И.М. Сеченова”.
Тел. 8 (499) 248-69-44



