Кишечная микрофлора имеет большое значение в обеспечении здоровья человека, в т.ч. как одного из факторов профилактики избыточной массы тела и ожирения. В связи с этим значительный интерес представляет концепция пробиотиков, разработанная G.R. Gibson и M.B. Robertroid в 1995 г. В соответствии с этой концепцией под пробитиками понимают «микробиологические пищевые добавки, которые благотворно влияют на здоровье хозяина путем улучшения микробиологического баланса его кишечника».
В 1998 г. F. Guarner и G.J. Schaafsma дали определение пробиотикам как «живым микроорганизмам, которые при их потреблении человеком в адекватных количествах оказывают благоприятное влияние на здоровье». Несмотря на некоторые различия в этих определениях, они указывают на то, что пробиотики – это живые микроорганизмы, причем для проявления эффектов необходимо их поступление в организм в адекватных дозах.
Среди массы пробиотиков важное место занимает наиболее хорошо изученная пробиотическая культура Bifidobacterium animalis subsp. lactis ВВ-12. Опубликовано более 300 работ, в т.ч. 130 клинических исследований, в которых доказано благоприятное действие ВВ-12 на здоровье взрослых и детей, в т.ч. на гастроинтестинальную и иммунную функции.
В этих исследованиях показана, в частности, устойчивость пробиотической ВВ-12 к действию соляной кислоты желудочного сока и желчи и ее способность к связыванию с кишечным эпителием, что подтверждает правомерность отнесения ВВ-12 к пробиотическим микроорганизмам.
Так, при изучении устойчивости 60 изолятов кишечных бифидобактерий ВВ-12 проявила сходную или лучшую устойчивость к действию соляной кислоты и желчи по сравнению с другими видами бифидобактерий. В другой работе показано, что при использовании искусственной модели кишечной системы, отражающей пассаж через соляную кислоту желудка и желчь, 60–80% ВВ-12 сохраняли жизнеспособность [1, 2].
Адгезия является необходимым этапом колонизации, ингибирования роста патогенных микроорганизмов, иммунных реакций и повышения барьерной функции кишечника. Исходя из этого, степень адгезии является одним из важных критериев наличия пробиотических свойств у микроорганизмов.
При изучении модели адгезии пробиотиков in vitro на 60 изолятах бифидобактерий кишечника человека установлено, что адгезия пробиотических микроорганизмов к неповрежденной слизистой оболочке, так же как и к слизистой оболочке, обработанной муцином, была высокой, причем максимальный уровень адгезии в обоих случаях наблюдался при использовании ВВ-12. В другом исследовании in vitro показано, что до 30% бифидобактерий ВВ-12 связываются с образцами слизистой оболочки из фекалий человека [3].
В другом исследовании была изучена способность 24 линий бифидобактерий, выделенных из слизистой оболочки кишечника человека и коровы, связываться с иммобилизированными гликопротеинами. При этом было установлено, что наивысший уровень адгезии также был выявлен в случае бифидобактерий ВВ-12 [4].
Таким образом, продемонстрирована высокая связывающая способность ВВ-12 в различных моделях in vitro. Эти данные доказывают, что ВВ-12 обладают способностью к колонизации слизистой оболочки кишечника, персистированию в этих зонах слизистой оболочки, и таким образом положительно влияют на здоровье человека.
В ряде исследований показана также способность ВВ-12 сохранять жизнеспособность в пищеварительной системе взрослых и детей [5–7].
Безопасность Bifidobacterium ВВ-12
Необходимым условием отнесения микроорганизмов к пробиотикам служит доказательство их безопасности.
Безопасность ВВ-12 подтверждается прежде всего длительной историей ее использования в разных странах в питании человека без негативных эффектов на здоровье. Кроме того, она была изучена в многочисленных клинических исследованиях, в которых также не было выявлено негативных эффектов. Отсутствие негативных эффектов отмечено в т.ч. и у наиболее чувствительных групп населения, таких как младенцы, беременные и кормящие женщины. В этих исследованиях ВВ-12 потребляли в ежедневной дозе от 0,1 до 400 биллионов КОЕ. При этом длительность обогащения ВВ-12 колебалась от 2 недель до 12 месяцев. ВВ-12 вводили в виде порошка или пищевой добавки в форме капсул.
В Европе линиям, принадлежащим к видам Bifidobacterii animalis, был присвоен статус доказанной безопасности [8]. В США BB-12 включен в список GRAS FDA (Generally recognized as safe Food and Drug Administration) как ингредиент молочных детских смесей, предназначенных для потребления детьми 4 месяцев и старше [9, 10]. Безопасность ВВ-12 подтверждена также гигиеническими стандартами Швеции, Польши, Дании, Австрии.
Помимо клинических исследований на человеке действие ВВ-12 исследовали на животных с нарушенным иммунитетом. Эти исследования не выявили каких-либо побочных эффектов со стороны иммунной системы животных.
Исходя из приведенной информации, можно заключить, что использование B. animalis subsp. lactis ВВ-12 безопасно при использовании в качестве пищевых ингредиентов или пищевых добавок, потребляемых здоровым населением, в т.ч. детьми раннего возраста [9, 10].
Механизмы пробиотического действия Bifidobacterium ВВ-12
Основными механизмами пробиотического действия ВВ-12 являются ингибирование роста патогенных микроорганизмов, повышение барьерной функции эпителия кишечника и коррекция иммунного ответа.
Ингибирование роста патогенных микроорганизмов осуществляется с помощью ряда механизмов, включая продукцию ингибиторных веществ (органические кислоты, Н2О2, бактериоцины), удаление или деградация токсинов, конкуренция за места связывания с клеточными рецепторами и эпителием слизистой оболочки. Изучение in vitro действия 4 различных микроорганизмов, включая ВВ-12, в отношении продукции антагонистической субстанции следующими микроорганизмами: Bacillus cereus, Clostridium difficile, Clostridium perfringens TYPE A, Escherichia coli ATCC 4328, Enterococcus faecalis, Listeria monocytogenes, Pseudomonas aeruginosa, Salmonella enterica subsp enterica serovar Typhimurium, S. enterica subsp. enterica serovar Typhi, Shigella flexneri, Shigella sonnei и Candida albicans, показало что, только ВВ-12 и еще одна линия микроорганизмов ингибировали рост патогенных микроорганизмов. ВВ-12 проявляют антагонистическую активность в отношении 8 из 12 изученных патогенов [11].
Таким образом, ВВ-12 способна к ингибированию патогенных микроорганизмов в кишечнике с помощью продукции антимикробных субстанций и конкуренцией за связывание с эпителием кишечника.
Изучение влияния ВВ-12 на барьерную функцию кишечника показало, что ВВ-12 увеличивает прочность межклеточных контактов и защищает эпителиальный барьер от повреждения [12].
Клинические исследования
В клинических исследованиях была доказана эффективность ВВ-12 в коррекции как замедленной (запор), так и ускоренной (различные виды диареи) кишечной перистальтики. Доказано увеличение частоты стула у здоровых взрослых женщин, которые получали ВВ-12 в дозе 1:109 КОЕ в течение 2 недель [13]. Сходные данные получены в наблюдениях за 35 здоровыми женщинами, получавшими ВВ-12 в составе ферментированного молока в дозе 4:109 КОЕ в день, и за 30 здоровыми взрослыми, также получавшими ВВ-12 в ферментированном молоке 5,2:109 КОЕ. Эти данные указывают на способность ВВ-12 увеличивать перистальтику кишечника, особенно у лиц, склонных к запорам [14].
При исследовании эффективности молочной смеси, обогащенной ВВ-12, в профилактике острой диареи у 90 здоровых младенцев в возрасте до 8 месяцев была отмечена тенденция к снижению частоты диареи с 38,6% в группе плацебо до 28,3% [15]. В другом двойном слепом плацебо-контролируемом исследовании младенцы, наблюдавшиеся в Центре профилактики, получали либо стандартную формулу, либо ту же формулу, обогащенную ВВ-12 и Streptococcus thermophilus. Исследовали частоту диареи и анализ кала на ротавирусы. Были обследованы 55 младенцев в течение 17 месяцев. Установлено, что у 8 (31%) из 26 детей, получавших контрольную формулу, и только у 2 (7%) из 29 детей, получавших обогащенную формулу, отмечали диарею. Ротавирусную инфекцию во время исследований перенесли 39% детей, которые получали контрольную смесь, и 10% детей, получавших смесь, обогащенную ВВ-12 [16].
ВВ-12 оказывает также положительный эффект в отношении диарей, вызванных антибиотиками. В частности, исследовали эффективность ВВ-12 для 343 пациентов, получавших антибиотики в течение 7 дней. Через 14 дней лечения частота антибиотико-ассоциированных диарей в группе пробиотиков снижалась до 10,8% по сравнению с 15,6% в группе плацебо. Длительность диареи была достоверно ниже (2,32 дня) в группе пробиотика по сравнению с плацебо (4,58 дня). Частота тяжелой диареи в группе плацебо была также достоверно выше (96%), чем в группе пробиотиков (31,6%). Эти результаты показывают, что ВВ-12 может достоверно уменьшать длительность и тяжесть антибиотико-ассоциированных диарей [17].
В отдельной серии исследований доказано, что ВВ-12 повышает эффективность эрадикации Helicobacter pylori у 88 практически здоровых пациентов, инфицированных H. pylori, получавших пастеризованное ферментированное молоко, содержавшее ВВ-12 и Lactobacillus acidophilus LA-5, или ферментированное молоко, содержавшее ВВ-12 и L. acidophilus LA-5, в течение 8 недель. Пациенты контрольной группы получали ферментированное молоко, не содержавшее ВВ-12 и L. acidophilus LA-5, также в течение 8 недель. Показано, что у пациентов, получавших молоко с ВВ-12, длительность антибиотико-ассоциированных диарей была менее продолжительной (до 4 дней) по сравнению с контрольной группой пациентов (10 дней). Показано также, что ВВ-12 нормализовала микрофлору кишечника у пациентов, инфицированных H. pylori. Таким образом, ВВ-12 снижают частоту и длительность антибиотико-ассоциированных диарей у пациентов после антибактериальной терапии и повышают эффективность эрадикации [18].
Важным аспектом действия ВВ-12 на организм человека является ее влияние на иммунную функцию. Пробиотики могут взаимодействовать с иммунной системой различными способами, в т.ч. увеличивать продукцию антител, увеличивать клеточную активность иммунокомпетентных клеток, модулировать сигналы эпителиальных и иммунных клеток. Исследование влияния ВВ-12 на функцию иммунной системы у здоровых людей с помощью оценки интенсивности вакцинации выявило увеличение специфических и общих антител против гриппа по сравнению с плацебо, а также цитокинов интерлейкина-2 (ИЛ-2), ИЛ-10, интерферона γ, причем влияние ВВ-12 было дозозависимым [19].
ВВ-12 уменьшали также риск инфекций респираторной системы, что было показано в рандомизированном двойном слепом плацебо-контролируемом исследовании. В этом исследовании было продемонстрировано, что средняя длительность острых респираторных вирусных инфекций (ОРВИ) была достоверно меньше на 2 дня, а средняя тяжесть инфекции – на 34% ниже в группе студентов, получавших пробиотик, по сравнению с плацебо [20]. Эти данные показывают, что обогащение рациона ВВ-12 может увеличивать сопротивляемость организма к общим инфекциям путем усиления иммунного ответа. ВВ-12 может также снижать частоту и длительность ОРВИ.
Изучение влияния ВВ-12 на риск развития острых инфекций у 109 младенцев в возрасте от 2 до 8 месяцев жизни показало, что прием ВВ-12 не влиял на частоту кишечных инфекций и частоту среднего отита, однако уменьшал распространенность респираторных инфекций по сравнению с детьми, получавшими плацебо [21].
В другом клиническом исследовании 81 младенец начиная с 2-месячного возраста получал пробиотики или плацебо в течение 12 месяцев. Было показано, что частота ранних инфекций и использование антибиотиков были ниже, чем в группе плацебо. В течение первого года жизни дети, получавшие пробиотики, также реже страдали от респираторных инфекций [22].
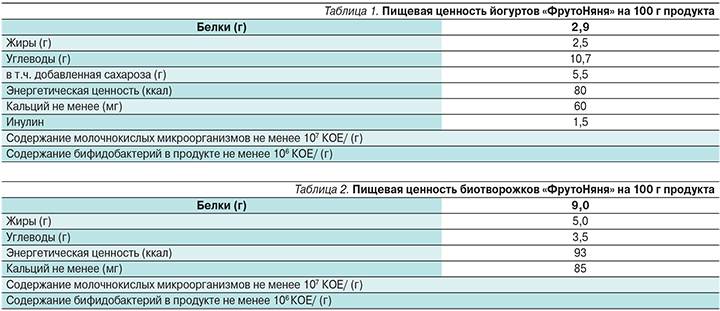
Высокая физиологическая активность и выявленная способность пробиотиков к профилактике и лечению кишечных инфекций, атопического дерматита и других заболеваний простимулировали разработку и организацию промышленного выпуска широкого спектра пробиотических продуктов, т.е. продуктов, содержащих живые микробные культуры с доказанными пробиотическими свойствами. Разработана серия продуктов, содержащих пробиотический штамм бифидобактерий – B. animalis subsp. lactis ВВ-12. К числу таких продуктов принадлежат инстантные адаптированные стартовые молочные смеси (пресные и кисломолочные); последующие формулы (пресные и кисломолочные), а также формулы для питания детей от 0 до 12 месяцев жизни. Разработаны также различные группы продуктов прикорма, обогащенных пробиотическим штаммом бифидобактерий, в частности сухие инстантные каши, питьевые йогурты (табл. 1).
В последние годы отечественный производитель продуктов детского питания АО «ПРОГРЕСС» (Россия) разработал и выпускает две группы продуктов, обогащенных B. animalis subsp. lactis ВВ-12: питьевые йогурты (для детей старше 8 месяцев) и биотворожки (для детей старше 6 месяцев) под торговой маркой «ФрутоНяня». Питьевой йогурт «ФрутоНяня» содержит в своем составе молоко цельное и молоко сухое обезжиренное, фруктовые наполнители (сахар, вода, пюре фруктовое, загуститель – крахмал кукурузный, сок лимонный концентрированный, ароматизатор натуральный, сок фруктовый или овощной концентрированный), пребиотики – инулин (пищевые волокна), закваску молочнокислых культур (Lactobacillus bulgaricus и S. thermophilus). К особенностям этого продукта относится включение в его состав пробиотической культуры B. animalis subsp. lactis ВВ-12. В состав биотворожков «ФрутоНяня» входят нормализованное молоко, закваска молочнокислых культур и пробиотическая культура B. animalis subsp. lactis ВВ-12. Пищевая ценность питьевых йогуртов и биотворожков «ФрутоНяня» представлена в табл. 1 и 2.
Продукты детского питания, а именно питьевые йогурты и биотворожки, содержащие B. animalis subsp. lactis ВВ-12, выпускаемые АО «ПРОГРЕСС» под торговой маркой «ФрутоНяня», на протяжении последних нескольких лет успешно используются в питании российских детей.



