Воспалительные заболевания кишечника (ВЗК): болезнь Крона (БК) и неспецифический язвенный колит (НЯК) становятся, согласно тревожной статистике, все более частой патологией среди как взрослых, так и детей. Этиология этих заболеваний не ясна, но большинство специалистов, занимающихся этой проблемой, сходятся во мнении, что в основе ВЗК лежит нарушение взаимодействия иммунной системы кишечника с кишечной микробиотой в результате потери иммунологической толерантности. Дисбиотические изменения просветной и мембранной микрофлоры обнаружены у всех пациентов с ВЗК, причем количество микробов, как правило, увеличено, а их состав изменен [1]. Роль кишечной микрофлоры в развитии ВЗК доказана в эксперименте на ИЛ (интерлейкин)-10дефицитных мышах, у которых экспериментальный колит не возникал в стерильных условиях, но развивался при обычном микробном окружении [2]. Изучение роли кишечной микрофлоры в генезе ВЗК послужило поводом к предположению о возможности применения пробиотиков для профилактики и лечения этой патологии.
Согласно определению рабочей группы ВОЗ, пробиотики – это живые микроорганизмы, применение которых в адекватных количествах вызывает улучшение здоровья организма хозяина. Большинство пробиотиков относится к роду бифидобактерий или лактобацилл, некоторые содержат аэробные виды (энтерококки, стрептококки и кишечные палочки). Наиболее часто при различных заболеваниях применяют дрожжевые грибки Saccharomyces boulardii, которые являются небактериальным пробиотиком. Хотя S. boulardii не входят в состав микрофлоры кишечника человека и имеют растительное происхождение, многолетний опыт их использования в разных клинических ситуациях и многочисленные исследования механизма действия показали, что они обладают всеми свойствами пробиотиков, а по эффективности превосходят многие из них.
Использование пробиотиков при ВЗК имеет пока короткую историю и в большей степени касается лечения поучита (pouchitis – резервуарный илеит) – воспаления культи подвздошной кишки, которая образуется после колэктомии по поводу НЯК и наложения илеоанального анастомоза.
Недавние исследования показали, что причиной поучита является усиленный рост условно-патогенной микрофлоры, который сопровождается снижением числа облигатных лакто- и бифидобактерий. Назначение антибиотиков при поучите дает временный эффект, и после их отмены процесс вновь возобновляется. Недавнее исследование Gionchetti P. и соавт. [3] показало эффективность комплексного пробиотического препарата VCL#3 (на российском фармацевтическом рынке его пока нет), представляющего собой коктейль из 4 штаммов лактобацилл (Lactobacillus casei, L. plantarum, L. acidophilus, L. bulgaricus), 3 штаммов бифидобактерий (Bifidobacteriumlongum, B. breve, B. infantis) и 1 штамма стрептококка (Streptococcusthermophilus). В исследовании участвовали 40 пациентов с поучитом, рандомизированных в 2 группы, одна из которых получала пробиотик, а другая – плацебо. Результаты были оценены через 9 месяцев. В группе, получавшей плацебо, спустя 9 месяцев обострение наступило у всех 20 больных, а в группе, получавшей пробиотик, – только у 3, но и у них не во время лечения пробиотиком, а на протяжении 4 месяцев после его отмены.
Второе независимое исследование также подтвердило эффективность VCL#3 при поучите: ремиссия была достигнута у 17 из 20 больных, получавших пробиотик, и лишь у 1 из 16, получавших плацебо [4]. В противоположность этому L. rhamnosus GG (LGG) оказались неэффективными в лечении поучита. Kuisma J. и соавт. провели рандомизированное двойное слепое плацебо-контролируемое исследование эффективности применения LGG в течение 3 месяцев [5]. Результаты не имели достоверных отличий от плацебо. Не было получено и доказательств эффективности комбинации L. acidophilus + B. lactis [6].
Таким образом, пробиотики существенно различаются по своей эффективности, что следует учитывать при их выборе. Каждый штамм и вид микробов, каждый препарат должны доказать возможность их применения при конкретной патологии, особенно когда речь идет о таких тяжелых заболеваниях, как ВЗК.
Два исследования были посвящены оценке эффективности пробиотиков для профилактики поучита. В обоих из них показано, что применение пробиотиков сразу после операции способно отсрочить развитие поучита. В одном из них спустя год после операции поучит развился у 2 из 20 (10 %) больных, получавших VCL#3, и у 8 из 20 (40 %) – получавших плацебо [7]. В открытом исследовании с трехлетним катамнезом поучит развился у 7 % больных, получавших LGG, и 29 % – не получавших пробиотики.
Возможным объяснением рецидивирующего течения поучита и эффективности пробиотиков, а также их сочетания с антибиотиками является предполагаемое участие Clostridium difficile в развитии этого осложнения. Поскольку среди всех пробиотиков S. boulardii обладают наиболее доказанным подавляющим действием в отношении C. difficile, препараты, содержащие S. boulardii (Энтерол), являются предпочтительными как для профилактики, так и для лечения поучита.
Применению пробиотиков в лечении обострения НЯК было посвящено несколько исследований. Так, Bibiloni R. и соавт. оценили эффективность VSL#3 у 34 больных НЯК легкой и средней степеней тяжести [8]. К концу 6-недельного курса лечения ремиссия была достигнута у 53 % пациентов, принимавших пробиотики. В другом исследовании Rembacken B.J. и соавт. 116 больным НЯК, не ответившим на терапию месалазином, был назначен препарат, содержащий Esherichia coli штамм Nissle 1917 [9]. После достижения ремиссии пациенты были рандомизированы в две группы и в качестве поддерживающей терапии получали либо месалазин, либо тот же пробиотик в течение года. Эффект терапии оказался равноценным в обеих группах, ремиссия в течение года наблюдалась у 25 % больных, получавших месалазин, и у 26 % – пробиотик. Попытка использования B. longum в лечении НЯК не увенчалась успехом [10]. В противоположность другим пробиотикам оценка эффективности S. boulardii в лечении НЯК, проведенная Guslandi M. и соавт. в пилотном исследовании, показала обнадеживающие результаты [11]. На фоне назначения S. boulardii в течение 4 недель ремиссия была достигнута у 17 из 25 больных, т. е. в 68 %. Это наиболее высокий результат, полученный при применении пробиотиков.
Ценность некоторых пробиотиков была также изучена в поддержании ремиссии НЯК. Kruis W. и соавт. в двух исследованиях сравнили эффективность месалазина и E. coli Nissle 1917 [12, 13]. В первом из них, включившем 103 пациента, через 3 месяца приема препаратов в состоянии ремиссии оставались 89 и 84 % больных, получавших месалазин и пробиотик соответственно. Во втором – 116 пациентов получали лечение либо месалазином в низкой дозе (1,2 г/сут), либо E. coli Nissle 1917 в течение года. Обострение за тот период отмечено у 73 % больных, получавших месалазин, и 67 % – E. coli Nissle, т. е. результат был сравнимым в обеих группах. Однако достаточно высокий процент рецидивов не позволяет делать выводы об эффективности данного пробиотика. Эти пациенты стали участниками еще более крупного исследования [13], в которое вошли 327 пациентов, в течение года получавших те же препараты. К концу года в группе месалазина обострение наблюдалось у 33,9 %, а в группе E. coli Nissle – у 36,4 %. Таким образом, при увеличении объема исследования данный пробиотик оказался несколько менее эффективным, чем месалазин.
Ishikawa H. и соавт. рандомизировали 21 пациента в 2 группы, получавшего либо плацебо, либо кисломолочный продукт Yakult, обогащенный смесью пробиотических культур B. breve, B. bifidum и L. acidophilus в течение года [14]. Клинически ремиссия в течение года поддерживалась у 73 % больных, получавших Yakult, и лишь у 10 % – плацебо. Однако эндоскопическое исследование, проведенное у этих больных через год, не подтвердило успеха применения кисломолочного продукта с пробиотиками, что ставит под сомнение возможность оценки результативности лечения НЯК только по клиническим данным. Как известно, клинические симптомы при этом заболевании не всегда полностью соответствуют эндоскопическим данным, поэтому выводы могут быть сделаны только с учетом эндоскопической картины. Открытое пилотное исследование Venturi A. и соавт., в котором изучалась эффективность пробиотика VSL#3 в поддержании ремиссии НЯК, достигнутой на фоне глюкокортикостероидов, после их отмены показало, что в течение года ремиссия сохранялась у 15 из 20 (75 %) больных [15].
Лечению БК с использованием пробиотиков посвящены лишь единичные работы с очень малыми объемами исследования. В них изучалась способность пробиотиков индуцировать ремиссию при обострении БК и поддерживать ее после достижения. Первоначально в пилотном исследовании у детей [16] были получены обнадеживающие результаты назначения LGG. Однако позднее в более крупных рандомизированных двойных слепых исследованиях препараты, содержащие LGG, не подтвердили никакого значимого преимущества при назначении их после курса глюкокортикостероидов или на фоне месалазина [17]. В поддержании ремиссии БК Bousvaros A. и соавт. [18] показали небольшое преимущество LGG (31 %) по сравнению с плацебо (17 %).
Два исследования по изучению риска послеоперационного рецидива БК значимого эффекта пробиотической терапии также не подтвердили. В одном из них 45 взрослых пациентов после операции по поводу БК были рандомизированы в 2 группы, одна из которых получала LGG, вторая – плацебо в течение года [19]. При контрольном эндоскопическом исследовании, несмотря на клиническую ремиссию, обострение было констатировано у 60 % пациентов, получавших LGG, и 35 % – получавших плацебо. При оценке эффективности другого штамма лактобацилл – L. johnsonii LA1, обострение через 6 месяцев было диагностировано у 43 % больных, получавших пробиотик, и у 64 % – плацебо. Однако неудачные попытки применения одних пробиотиков не исключают возможного успеха других.
В рандомизированном плацебо-контролируемом исследовании Plein K. и соавт. была оценена эффективность S. boulardii в поддержании ремиссии БК [20]. Двадцать пациентов, получавших S. boulardii в течение 7 недель, продемонстрировали улучшение симптомов болезни: уменьшение частоты стула и индекса активности. У такого же числа больных группы сравнения, получавших плацебо, клиническая картина не изменилась. В другом исследовании на фоне приема S. boulardii в период ремиссии БК снижалась частота обострений с 37,5 % (в группе месалазина) до 6,25 % (в группе, получавшей комбинацию месалазина и S. boulardii), т. е., как и в случае лечения НЯК, эффект пробиотической терапии зависел прежде всего от вида используемого пробиотика: штаммы лактобацилл оказались неэффективными, в то время как S. boulardii продемонстрировали обнадеживающие результаты [21].
К сожалению, абсолютное большинство исследований эффективности пробиотиков при ВЗК проводили у взрослых пациентов. Относительно использования пробиотиков у детей имеются лишь единичные сообщения.
Целью пилотного исследования стала оценка эффективности S. boulardii (Энтерола) в поддержании ремиссии БК у детей.
Материал и методы
Под нашим наблюдением находились 24 ребенка в возрасте от 6 до 17 лет с установленным диагнозом БК. У всех пациентов заболевание протекало с поражением дистального отдела подвздошной кишки и участков толстой кишки, имело слабую или умеренную активность. После применения месалазина (Салофалька) ремиссия была достигнута у 8 пациентов, преднизолона – у 16. К моменту исследования все больные находились в клинической ремиссии, индекс Беста у всех составлял менее 150 баллов. Перед исследованием всем пациентам проведена оценка уровня кальпротектина в кале. Пациенты были рандомизированы в 2 равные группы по 12 человек. Больные первой группы продолжали получать Салофальк в суточной дозе 50 мг/кг, во второй группе к этой терапии был добавлен Энтерол в дозе 500 мг (1 капсула 2 раза/сут). Продолжительность курса лечения Энтеролом составила 3 месяца, затем препарат был отменен и больные обеих групп получали одинаковую терапию месалазином еще в течение 3 месяцев. Заключительная оценка результатов лечения была проведена через 6 месяцев. Она включала: клинический осмотр, контроль клинических и биохимических анализов крови и оценку кальпротектина в кале.
Результаты и обсуждение
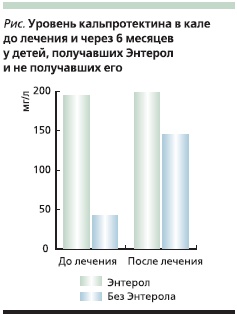
Из 12 больных, получавших Энтерол в сочетании с Салофальком, в течение первых трех месяцев обострений не наблюдалось ни у одного из пациентов. В течение последующих трех месяцев после отмены Энтерола на фоне приема Салофалька обострение возникло у одного пациента, т. е. процент рецидивов в течение 6 месяцев в этой группе составил 8,3 %. В контрольной группе, получавшей месалазин, за тот же период рецидивы отмечены у 3 из 12 больных, что составило 25 %. Средний уровень кальпротектина в кале в начале исследования не имел достоверных различий у пациентов обеих групп и составил в первой группе 198 ± 48,3, во второй – 195 ± 62,4 мг/л (см. рисунок). Через 6 месяцев средний уровень кальпротектина в первой группе снизился незначительно (p > 0,05) и составил 145 ± 58,6 мг/л, а в группе, получавшей Энтерол, – достоверно снизился и составил 43,5 ± 18,6 мг/л; различия между показателями групп высокодостоверны (p < 0,01). Полученные нами результаты согласуются с данными зарубежных исследований Plein K. [20] и Guslandi M. [21], проведенных у взрослых, и подтверждают эффективность S. boulardii в поддержании ремиссии БК у детей.
Каков вероятный механизм действия пробиотиков, в частности Энтерола, при ВЗК? Недавние исследования in vitro и in vivo показали, что пробиотики, в т. ч. S. boulardii, оказывают прямое воздействие на эпителиальный барьер, уменьшая его проницаемость за счет восстановления белка зонулина, обеспечивающего плотность межклеточных соединений [22]. Более того, S. boulardii способны замедлять процессы апоптоза, усиливающиеся при воспалении [23]. S. boulardii ослабляют провоспалительное действие токсинов многих бактерий, обладая как непосредственным нейтрализующим действием на них, так и опосредованным противовоспалительным действием, поскольку не стимулируют активацию ключевого внутриклеточного фактора воспаления NF-kB и снижают синтез провоспалительных цитокинов [24]. Снижение уровня провоспалительных цитокинов (фактора некроза опухоли α, интерферона γ) также способствует нормализации проницаемости кишечного эпителия [25]. В ряде работ была доказана способность пробиотиков усиливать синтез секреторного иммуноглобулина A, что укрепляет защитные функции кишечного барьера [26]. Доказано, что пробиотики способны влиять на функции дендритных клеток, модулируя дальнейшую дифференцировку Th (Т-хелперных) лимфоцитов и способствуя формированию иммунологической толерантности [27].
Таким образом, в настоящее время получены многочисленные доказательства того, что пробиотики способны регулировать и снижать воспаление за счет комплекса присущих им эффектов. Однако эти эффекты штаммоспецифичны и способность различных пробиотиков к осуществлению этих функций отнюдь не равнозначна. Сегодня среди представленных на отечественном рынке пробиотиков S. boulardii (Энтерол) имеет богатую научную доказательную базу как наиболее мощный пробиотический препарат, способный оказывать реальное лечебное воздействие в разных клинических ситуациях.
Однако следует признать, что, несмотря на полученные нами данные, применение пробиотиков, в т. ч. Энтерола, при ВЗК у детей изучено пока недостаточно, поэтому для выработки каких-либо определенных практических рекомендаций необходимы дальнейшие исследования. Первые работы, проведенные с целью раскрытия этой важной проблемы, дают обнадеживающие результаты. Тем не менее в настоящее время мы не можем ответить на такие вопросы: при каких формах ВЗК у детей, на какой срок и в каких дозах следует назначать пробиотики, насколько безопасно их применение в период обострения, возможно ли их сочетать со стандартной противовоспалительной и иммуносупрессивной терапией? Для ответов на них необходимы многоцентровые плацебо-контролируемые исследования.
Информация об авторах:
Корниенко Елена Александровна – профессор, зав. кафедрой гастроэнтерологии ФПК и ПП
Санкт-Петербургской государственной педиатрической медицинской академии.
Тел. 8 (911) 919-88-39, e-mail: elenkornienk@yandex.ru;
Ломакина Екатерина Александровна – аспирант кафедры гастроэнтерологии ФПК и ПП
Санкт-Петербургской государственной педиатрической медицинской академии.
Тел. 8 (812) 778-06-61;
Залетова Надежда Константиновна – аспирант кафедры гастроэнтерологии ФПК и ПП
Санкт-Петербургской государственной педиатрической медицинской академии.
Тел. 8 (812) 778-06-61.
Фадина Светлана Алексеевна – заведующая отделением гастроэнтерологии
(№ 13) ДГКБ № 5 им. Н.Ф. Филатова, Санкт-Петербург.
Тел. 8 (812) 778-06-61



