Введение
Современные принципы лечения бактериального вагиноза (БВ) включают применение комплексного двухэтапного лечения с последующим восстановлением нормальной микрофлоры влагалища. При этом первый этап лечения направлен на эрадикацию условно-патогенных микроорганизмов и анаэробов, тогда как на втором этапе применяются препараты, способствующие восстановлению pH влагалища и нормальной микрофлоры [4, 5].
Как известно, главной целью терапии БВ является обеспечение стойкой колонизации влагалища жизне- и конкурентоспособными лактобактериями, активно продуцирующими молочную кислоту и способными формировать полезные биопленки, что приводит к гибели патогенных микроорганизмов. Данные, полученные в in vitro исследованиях, свидетельствуют о способности лактобактерий эффективно разрушать биопленки [10], а сочетание антибактериальных препаратов с пробиотиками рассматривается как перспективный подход к лечению БВ. Однако во многих источниках отмечается низкий уровень приживаемости лактобактерий, что объясняется недостаточной колонизацией и быстрой элиминацией вводимых чужеродных бактериальных штаммов [2]. Предполагается, что адсорбция лактобактерий носит специфический характер и зависит от соответствия рецепторов данного конкретного штамма лактобактерий рецепторам клеток вагинального эпителия конкретной женщины [2], что может быть причиной низкой эффективности лечения и частого рецидивирования БВ. Вместе с тем установлено, что реализация лечебных эффектов пробиотиков осуществляется не только за счет наличия в их составе живых бактерий, но и главным образом за счет синтезируемых ими продуктов жизнедеятельности – биологически активных веществ (молочной кислоты) [3].
По мнению многих авторов, разнообразная бактериальная структура БВ требует применения дополнительной антибактериальной терапии или комбинации препаратов, способных устранять широкий спектр возможных патогенных микроорганизмов [6, 7]. Отдельного внимания заслуживает проблема, связанная с применением антибиотиков, в ряде случаев приводящая к усугублению дисбиоза и росту резистентных к ним возбудителей. Большой интерес, обусловленный благоприятными характеристиками в этом плане, представляют антисептики [1, 11].
Важно также учитывать, что у женщин с вагинальным микробиоценозом без доминирования лактобактерий, соответствующим CST IV, выявленные результаты диагностики могут быть ошибочно сформулированы как БВ, что делает неуместным антибиотикотерапию в данном случае, и это может способствовать явному нарушению межмикробных отношений с развитием БВ [8, 9, 12].
Как видно из представленных данных, вопрос эффективного лечения БВ остается дискуссионным. Адекватная и эффективная медикаментозная коррекция вагинального дисбиоза должна учитывать полимикробную этиологию БВ, особенности его патогенеза, резервные способности лактобактерий. В связи с этим поиск наиболее оптимальных методов лечения, способствующих оказывать позитивные эффекты на вагинальную микрофлору с длительной ремиссией заболевания, представляется актуальным.
Цель исследования: определить эффективность разных методов лечения БВ путем оценки состава микробиоты влагалища.
Методы
Проведено клинико-лабораторное обследование 110 женщин с БВ, тщательно собран гинекологический анамнез, изучены особенности экстрагенитальной патологии.
С целью разработки эффективного метода лечения нами был проведен дифференцированный подход к двухэтапной терапии на основе молекулярно-биологической характеристики микробиоты влагалища. Для этого пациентки были разделены на 3 группы: в I группе, состоявшей из 38 больных, у которых состояние микробиоты влагалища соответствовало выраженному анаэробному дисбиозу (с превалированием Gardnerella vaginalis), терапию проводили препаратами метронидазола по 500 мг перорально 2 раза в сутки в течение 7 дней. Во ІІ группе – 40 пациенток, которым был установлен выраженный анаэробный дисбиоз (с преобладанием облигатных анаэробов), терапию проводили препаратами клиндамицина в течение 7 дней. В ІІI группе – 32 пациентки, у которых был верифицирован выраженный аэробно-анаэробный дисбиоз с учетом присутствия как аэробных, так и анаэробных представителей микробиоты, лечение проводили антисептическими средствами (хлоргексидин) в течение 7 дней. При повышенном содержании грибов Candida одновременно назначали антимикотическую терапию.
На 2-м этапе лечения в зависимости от исходного числа лактобактерий назначали пребиотики – кислотосодержащий препарат или пробиотики.
После проведенного лечения проводили оценку эффективности через 1, 3 и 6 месяцев, а также по предъявлению жалоб. Определяли наличие специфических выделений из влагалища (жидкие и однородные), выполняли аминный тест, измеряли рН влагалищной жидкости и проводили анализ микроскопии влагалищных мазков на «ключевые клетки». Молекулярно-биологическое типирование микробиоты влагалища проводили с использованием тест-системы Фемофлор-16.
Результаты
При контрольном визите через месяц после лечения жалобы и клинические симптомы заболевания отсутствовали у женщин всех трех групп. В I группе значение рН влагалищных выделений снизилось от исходных 6,04±0,03 до 4,07±0,06, в II и III группах – от 6,33±0,05 до 4,18±0,05 и от 6,17±0,05 до 4,19±0,05 соответственно (р<0,001). Достоверных различий между группами по числу лейкоцитов, десквамированных эпителиальных клеток и микробных клеток в мазках не выявлено (р>0,05). Эффективность терапии в отношении Gardnerella vaginalis, Bacteroides spp., грамотрицательных и грамположительных кокков была сопоставимой и статистически значимой во всех трех группах (р<0,001), что подтверждает адекватный выбор нами различных методов лечения с учетом молекулярно-биологических вариантов дисбиоза влагалища.
При повторном обследовании через 3 месяца после лечения характерных для БВ жалоб и клинических симптомов у женщин І группы не выявлено. У женщин ІІ и ІІI групп отмечены жалобы на патологические выделения с неприятным запахом в 7,5 и 6,2% случаев соответственно. Число случаев выявления пограничных значений рН влагалищных выделений (рН=4,5) было выше в III группе (25,0%), как и превышение порогового значения (рН>4,5) в 6,2% случаев. «Ключевые клетки» обнаружены у 2,5 и 3,1% женщин, обсеменность неоднородной микрофлорой влагалища нарастала в 7,5 и 12,5% мазков II и III групп соответственно. Абсолютный нормоценоз установлен у 39,5%, 30,0 и 28,1%, условный – у 55,3%, 52,5 и 53,2%, умеренный дисбиоз – у 5,2%, 17,5 и 18,7% пациенток I, II и III групп соответственно (рис. 1). Случаи выраженного дисбиоза отсутствовали во всех группах.
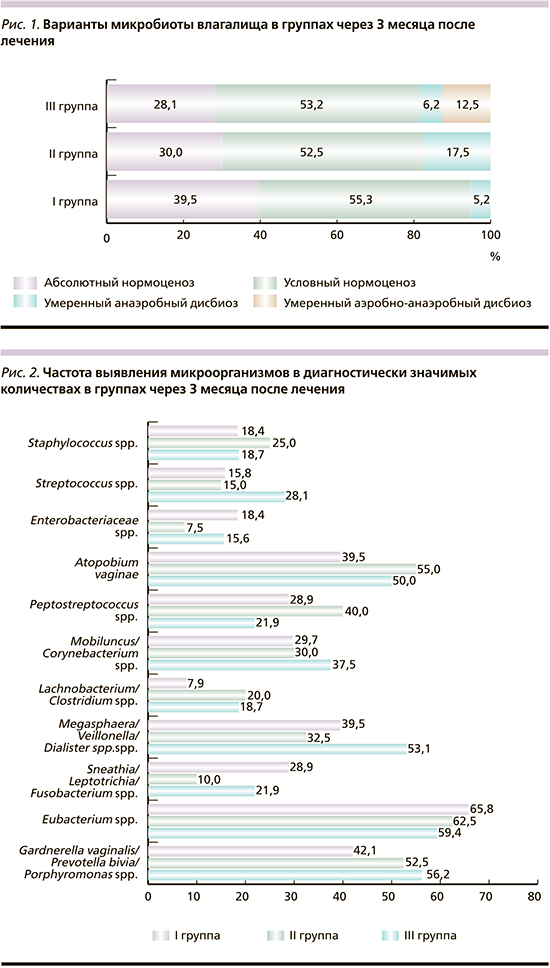
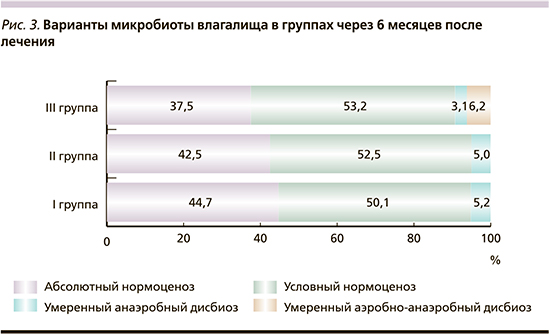
Как видно, после лечения в группах с выраженным дисбиозом по сравнению с I группой превалируют случаи восстановления микробиоты влагалища до умеренного нормоценоза, что показывает зависимость результатов коррекции дисбиоза влагалища от исходного состояния микробиоты слизистой оболочки. Снижение частоты встречаемости группы G. vaginalis/Prevotella bivia/Porphyromonas spp. была более выраженной в I группе (от 90,2 до 42,1% – в 2,2 раза) по сравнению со II (от 100 до 52,5% – в 1,9 раза) и III группами (от 90,6 до 56,2% – в 1,6 раза) (рис. 2). Частота встречаемости Sneathia/Leptotrichia/Fusobacterium spp., Megasphaera/Veillonella/Dialister spp. и Lachnobacterium/Clostridium spp. была резко сниженной во всех группах, но эта тенденция отчетливо проявлялась в группах с выраженным дисбиозом (до 5 раз во II группе и до 3 раз в III).
Картина нарастания содержания лактофлоры приняла следующий характер: в I группе средняя концентрация лактобактерий увеличилась от 6,61±0,19 до 7,09±0,12, во II – от 3,92±0,22 до 6,82±0,14 и в III группе – от 4,82±0,41 до 6,64±0,18. Как видно, более выраженная динамика наблюдалась в последних двух группах, где на втором этапе лечения использованы пробиотики.
Несмотря на это, повышение содержания условно-патогенной флоры выявлено в 5,3%, 17,5 и 18,7% образцов у женщин I, II и III групп соответственно. Согласно анализу количественного содержания выявленных микроорганизмов, установлено, что чаще других практически во всех ассоциациях микроорганизмов встречается G. vaginalis – до 96%, затем Atopobium vaginae. При контроле лечения через 3 месяца Atopobium vaginae выявляли у трети пациенток в ассоциации с другими микроорганизмами. Eubacterium spp. стабильно определялась приблизительно в 20% случаев БВ после лечения. Несколько реже встречались Peptostreptococcus spp. и Mobiluncus spp. – 17–20%.
Для коррекции имеющихся нарушений с целью профилактики усугубления дисбиоза нами использованы средства, улучшающие микробиоту слизистых оболочек в целом. Для этого были применены пребиотики группы олигосахаридов (инулин). Пребиотики – это субстанции или продукты функционального питания, в составе которых есть вещества, неперевариваемые в верхних отделах желудочно-кишечного тракта. Проходя через кишечник, они являются питательной базой для определенной группы микроорганизмов, преимущественно для бифидо- и лактобактерий, заселяющих толстый кишечник человека и положительно влияющих на состав микробиоты. Наиболее известные пребиотики – олигофруктоза, инулин, галакто-олигосахариды, лактулоза (препараты Дюфалак, Нормазе и др.), олигосахариды грудного молока и др. Растет число фактов, согласно которым прием в качестве пробиотиков таких веществ, как инулин и фрукто-, олигосахариды, может стимулировать рост некоторых штаммов лакто- и бифидобактерий в кишечнике, потенциально изменяя их защитную антиинфекционную функцию. Однако последующий эффект этих добавок на микробиоту влагалища и течение дисбиотического процесса остается неизученным.
В связи с этим после противорецидивной терапии спустя 3 месяца проведена повторная оценка микроскопической и микробиологической картины влагалища. Встречаемость лактобактерий увеличилась во всех мазках по сравнению с аналогичными показателями, выявленными 3 месяца назад (от 92,5% во II и 90,6% в III группах до 100% через 6 месяцев). Как морфотипы G. vaginalis, Bacteroides spp., Mobiluncus spp., так и грамотрицательные и грамположительные кокки выявлены в единичных мазках.
Микробиота влагалища после противорецидивной терапии приобрела более стабильный характер. Абсолютный нормоценоз зарегистрирован в 44,7%, 42,5 и 37,5% случаев, условный – в 50,1%, 52,5 и 53,2% в I, II и III группах соответственно (рис. 3). Частота выявления ассоциаций аэробных и анаэробных микроорганизмов во влагалищном отделяемом женщин трех групп достоверно резко сократилась и не отличалась друг от друга (р>0,05).
В целом во всех трех группах в течение 6 месяцев после двухэтапной терапии удалось сохранить снижение колонизации эпителия влагалища анаэробными микроорганизмами, ассоциированными с БВ, и усилить представительство там лактобактерий. Однако как в количественном, так и в качественном отношении использование пребиотиков группы олигосахаридов в качестве противорецидивной терапии имело преимущества: среднее число лактобактерий оказалось на порядок выше, а видовое представительство лучше по сравнению с группами, где не был применен противорецидивный этап терапии.
У 2 (5,3%) женщин I группы, профиль микробиоты влагалища которых соответствовал умеренному дисбиозу, отмечалось сохранение этого состояния по истечении 6 месяцев. С учетом отсутствия клинических симптомов заболевания можно предположить, что данный микробиологический профиль может быть вариантом нормы для этих женщин. С учетом данного обстоятельства возникает вопрос о целесообразности коррекции состояния умеренного дисбиоза в этом случае. Наши наблюдения показали, что микробиота влагалища у этих женщин без дополнительных медикаментозных вмешательств со временем спонтанно может переходить в условный нормоценоз. Микробиота влагалища при этом характеризуется частым временным переходом в условный нормоценоз и обратно.
Таким образом, формирование микробиоты влагалища после лечения зависело как от характера проводимой терапии, так и от исходного состояния микробиоты влагалища. Состояние микробиоты влагалища оставалось более стабильным на протяжении 6 месяцев после лечения в I группе. В группах с исходно сформированным выраженным дисбиозом (II и III группы) намечается тенденция к увеличению разнообразия и концентрации условно-патогенной микрофлоры к 3 месяцам после лечения. Поэтому повторный клинико-микроскопический, а при необходимости молекулярно-биологический контроль микробиоты влагалища с противорецидивной терапией являются превентивной мерой глубоких дисбиотических нарушений данного биотопа.
Заключение
Согласно результатам проведенного обследования, можно сделать вывод: двухэтапная схема лечения БВ, подобранная с учетом молекулярно-биологических вариантов дисбиоза влагалища, имела стойкий эффект лечения в 87,3% случаев. Дополнительное использование пребиотиков группы олигосахаридов в качестве противорецидивной терапии усиливает колонизацию лактобактерий и обеспечивает стабильность биотопа влагалища в 95,4% случаев.
Дополнительная информация
Публикация статьи осуществляется в рамках диссертационной работы: «Новые подходы в выборе тактики ведения и профилактики бактериального вагиноза вне и во время беременности».



