Введение
Неалкогольная жировая болезнь печени (НАЖБП) – общее понятие, включающее ряд патологических состояний, таких как стеатоз (СП), стеатогепатит (НАСГ), фиброз (ФП) и цирроз печени (ЦП), вследствие накопления липидов в клетках печени более 5% от массы печени при доказанном потреблении алкоголя менее 40 г в сутки для мужчин и 20 г для женщин [1]. НАЖБП в настоящее время – одна из наиболее актуальных проблем медицинского сообщества: распространенность НАЖБП в развитых странах достигает 30% населения. Особенно высок этот показатель в группе больных ожирением и сахарным диабетом. По данным Всемирной организации здравоохранения, среди причин смерти ожирение как фактор риска занимает 5-е место. Более 2,8 млн человек в год умирают по причинам, связанным с ожирением [2]. Точные показатели распространенности ожирения в РФ неизвестны, однако, по данным различных источников, эта цифра достигает 30% в популяции [Дедов И.И., 2006; Бокерия Л. А., 2010].
Оценка распространенности НАЖБП представляет значительные трудности, в первую очередь вследствие сложности диагностики заболевания на ранних стадиях: до сегодняшнего дня не существует специфических биохимических маркеров СП. Однако благодаря разработке и активному внедрению в клиническую практику неинвазивных методов диагностики – фиброэластометрии печени с функцией контролируемого параметра ультразвукового затухания, лабораторных тестов – получены достоверные данные о распространенности НАЖБП [3, 4].
В России эпидемиология НАЖБП изучалась в исследованиях DIREG: было показано, что частота НАЖБП в популяции достигает 37% населения и за последние годы эта цифра значительно возросла [5, 6]. Среди больных ожирением, метаболическим синдромом и сахарным диабетом 2 типа (СД2) частота НАЖБП особенно высока и варьируется в пределах от 70 до 100% [1, 7]. Масштабное исследование, посвященное распространенности НАЖБП в США, проведено в 2004 г.: были обследованы 2287 человек различного пола, возраста и этнической принадлежности. В результате было показано, что 34% обследуемых имеют НАЖБП [8]. Сходные результаты имело и другое исследование среди населения США – около 33% обследуемых страдали НАЖБП, причем были выявлены различия в зависимости от этнической принадлежности: заболевание встречалось чаще у латиноамериканцев, чуть реже – у лиц европеоидной расы и реже всего – у афроамериканцев [9].
Прогрессирование заболевания в течение длительного времени приводит к формированию фиброза и цирроза печени, хотя и не столь быстро, как при поражениях печени другой этиологии (аутоиммунный гепатит, вирусные гепатиты и т.п.) [10]. Стеатогепатит является патогенетически значимой стадией НАЖБП: при развитии воспаления прогрессирование фибротических изменений идет быстрее, нежели на стадии стеатоза: в 2004 г. представлены данные исследования, по результатам которого прогрессирование фиброза печени при неалкогольном стеатогепатите зарегистрировано в 30% случаев (морфологическое исследование печени через 4,3 года после первой биопсии) [11].
С учетом широкой распространенности НАЖБП, особенно в развитых странах, а также неуклонного роста показателей заболеваемости за последние два десятка лет проблеме НАЖБП уделяется все большее внимание. Патология печени занимает непоследнее место среди причин смертности во всем мире и составляет около 2% [12]. Как и многие другие, заболевания печени служат результатом сложного взаимодействия внешних (питание, токсические и экологические воздействия и т.п.) и генетических факторов [13]. В свете последних достижений в области генетики в рутинную клиническую практику все больше входят подходы персонализированной медицины, что позволяет не только проводить лечение уже имеющегося заболевания, но и дает возможность разработки индивидуальной профилактической и лечебной стратегии для каждого конкретного больного на основе выявления у него тех или иных факторов риска. Таким образом, геномные исследования должны обеспечить базу для развития предиктивной медицины.
Такие заболевания, как ожирение, СД2, НАЖБП, относятся к полифакторным патологиям и определяются не только внешними, но и генетическими детерминантами. Количественная оценка риска развития той или иной патологии при выявлении генетической предрасположенности сложна ввиду нелинейности реализации наследственной информации вследствие тесного взаимодействия внешних и генетических факторов [14]. Блестящей иллюстрацией значимого влияния генетических факторов в гепатологии служит определение роли области гена IL28B в оценке исходов противовирусной терапии HCV-инфекции с использованием интерферонов. Несколько исследовательских групп представили данные о том, что однонуклеотидный полиморфизм, расположенный в области гена IL28B, является предиктором эффективности интерферон-содержащей противовирусной терапии, определение которого впоследствии вошло в обязательный стандарт обследования пациентов-претендентов на противовирусную терапию и не теряло своей актуальности до наступления эры препаратов прямого противовирусного действия [15].
До этого группа ученых из США под руководством Helen Hobbs провели масштабное исследование, включившее более 6000 многонациональных представителей городского населения Далласа, с целью выявления новых факторов риска и лабораторных маркеров метаболического синдрома и сердечно-сосудистой патологии. Были исследованы 9229 однонуклеотидных полиморфизмов на предмет ассоциативной связи с наличием СД2. Было показано, что вариант rs738409 C>G, расположенный в 22-й хромосоме в пататиноподобном домене фосфолипазы 3 (PNPLA3), ассоциировался с повышенным риском развития НАЖБП, причем эта связь прослеживалась независимо от наличия ожирения, СД2, инсулинорезистентности, уровня потребления алкоголя и других факторов. Кроме того, прослеживалась связь между данным вариантом PNPLA3 и повышением уровня аланинаминотрансферазы (АЛТ) у латиноамериканцев [16].
В другом масштабном исследовании SOS, опубликованном в 2012 г., показано, что в группе пациентов с ожирением, имевших вариант I148M (s738409), частота инсулинорезистентности и СД2 была выше, в то время как уровень триглицеридов в крови – ниже. Это исследование подтверждает гипотезу, будто общее ожирение и стеатоз печени имеют патогенетическую связь с СД2 [17]. Другие авторы показали, что данный вариант PNPLA3 определяет повышенную частоту не только простого стеатоза печени, но и всего спектра проявлений НАЖБП. Недавние исследования выявили еще один вариант полиморфизма PNPLA3 (rs2294918 A>G), определяющий повышенный риск развития НАЖБП [18].
Изучение взаимосвязи генетических вариантов и увеличения частоты НАЖБП проводилось с использованием различных инструментальных методик оценки стеатоза и фиброза печени: биопсия печени, МР-спектроскопия, оценка плотности печени, но не объясняло молекулярных механизмов такой взаимосвязи. Интерес представляет расшифровка патогенетических процессов при различных вариантах полиморфизма PNPLA3, что является предметом ряда исследований в настоящее время.
В 2015 г. в Великобритании были опубликованы результаты масштабного исследования WELCOME по оценке эффектов генотипов PNPLA3 и TM6SF2 (2-й член трансмембранного суперсемейства 6): 103 пациента с НАЖБП получали омега-3-полиненасыщенные жирные кислоты (докозагексаеновая и эйкозапентаеновая кислоты) и плацебо. В результате была продемонстрирована связь между наличием варианта 148M/M PNPLA3 и изменением содержания липидов в печени [19]. В том же году проведено исследование, включившее 361 человека (226 пациентов с гистологически доказанной НАЖБП и 135 – в группе контроля). Анализ показал, что вариант TM6SF2 rs58542926 ассоциировался с умеренным риском развития НАЖБП [20].
В предыдущих исследованиях уже изучалось влияние генетических полиморфизмов Gly482Ser PPARGC1A на частоту ожирения и СД2. Было показано, что риск развития данных патологий у носителей этих генетических вариантов зависит от пола и возраста. Так, в 2006 г. в журнале «Диабетология» были опубликованы результаты исследования, в котором изучалась взаимосвязь между генотипическими особенностями, возрастом, уровнем физической активности и риском ожирения. Были обследованы 899 женщин и 902 мужчины из Швеции. Установлено, что 56% мужчин и 57 % женщин имеют вариант Gly482Ser PPARGC1A. Мужчины старше 50 лет с Gly482Ser с низкой физической активностью имеют повышенный риск ожирения, в то время как старшие мужчины с высокой физической активностью, молодые мужчины, а также женщины не имели повышенного риска ожирения. Данное исследование подтверждает, что пол и возраст следует учитывать при проведении исследований влияния полиморфизма PPARGC1A Gly482Ser на обменные нарушения: риск ожирения, ассоциированный с полиморфизмом 482Ser, доказан лишь для группы мужчин старше 50 лет с низкой физической активностью [21].
В японском исследовании в 2007 г. изучалась взаимосвязь между полиморфизмом гена PPARGC1A и НАЖБП. Были обследованы 115 пациентов с морфологически верифицированной НАЖБП, 65 из которых имели стеатогепатит, 50 – стеатоз, и 441 здоровый доброволец в группе контроля. Было исследовано 15 однонуклеотидных полиморфизмов PPARGC1A, в результате чего было определено его участие в развитии НАЖБП, ожирение и СД2. Так, вариант rs2290602 значимо повышал частоту НАЖБП, причем в большей степени – на стадии стеатогепатита, и частота Т-аллели rs2290602 была достоверно выше у пациентов с НАСГ, нежели в группе контроля. Также было показано, что экспрессия PPARGC1A микро-РНК в группе ТТ была достоверно ниже, чем GG или GT однонуклеотидного полиморфизма rs2290602 [22].
PPARGC1A Gly482Ser полиморфизм также ассоциировался с ожирением, артериальной гипертонией и диабетом [23]. НАЖБП часто сопровождается ожирением, гипертриглицеридемией, СД2 и инсулинорезистентностью [24]: в моделях животных было доказано, что мыши с удаленным геном PPARGC1A чаще имели стеатоз печени [25]. Так, предполагается влияние вариантности rs2290602 гена PPARGC1A на жировой и углеводный обмен и повышение частоты развития НАЖБП [22].
Взаимосвязь варианта PPARGC1В с ожирением изучалась среди датского населения. Исследование «случай–контроль» включило 7790 пациентов, разделенных на 3 группы: с нормальным индексом массы тела, избыточным весом и ожирением. Частота Ala203Pro встречалась значимо реже в группе пациентов с ожирением. Для оценки связи варианта PPARGC1В с СД2 были обследованы 1433 пациента с диабетом и инсулинорезистентностью и 4935 – в группе контроля: в результате повышения частоты СД ни с одним из вариантов гена связано не было [26].
В исследовании, опубликованном в 2010 г. в журнале BMC Gastroenterology, исследовались эффекты однонуклеотидных полиморфизмов PPARGCА и PPARG2, ранее известных как предикторы инсулинорезистентности и дислипидемии, на прогрессирование повреждения гепатоцитов при НАЖБП. Присутствие варианта PPARGCА 162Val ассоциировалось с более высоким риском инсулинорезистентности, но не дислипидемии. Присутствие PPARGCА 162Val и PPARG2 12Ala одновременно не повышало частоты стеатоза, стеатогепатита или фиброза печени при НАЖБП [27]. Исследования влияния вариантов гена FTO показали его взаимосвязь с предрасположенностью к СД2 и ожирению [28]. Как уже было отмечено, многочисленные работы подтверждают наличие генетических детерминант, ассоциирующихся с повышенным риском ожирения и СД2. Также выявлены варианты генов, обусловливающих предрасположенность к развитию НАЖБП, однако исследований, посвященных оценке прогностического влияния данных генов на прогрессирование фиброза печени у больных СД2 и НАЖБП, найдено не было.
Материал и методы
В условиях Московского клинического научно-практического центра (ГБУЗ МКНЦ им. А.С. Логинова) комплексно обследован 81 человек в возрасте от 29 до 82 лет с диагнозом СД2. В исследование не включались больные с положительными маркерами HBsAg и/или a-HCV. В исследование включены пациенты с СД2, которым был установлен диагноз НАЖБП, – 62 человека. Диагноз установлен на основании рутинных лабораторно-инструментальных данных, оценки степени стеатоза и стадии фиброза печени с помощью неинвазивных методов: панели ФиброМакс (BioPredictive, France) и непрямой ультразвуковой фиброэластометрией (ФЭ) на аппарате FibroScan (Echosens, Франция).
У всех больных СД2 и НАЖБП был изучен полиморфизм генов, определяющих наследственную предрасположенность к ожирению и СД2: PPARGC1A (коактиватор 1альфа-рецептора активатора пероксисом – полиморфизм Gly482Ser (G>A), PPARGC1B (коактиватор 1α-рецептора, активируемого пролифераторами пероксисом типа, полиморфизм Аla203Рro, G>C), PPARG2 (фактор транскрипции PPAR гамма, полиморфизм Pro12Ala), FTO (ген, ассоциированный с жировой массой, полиморфизм c.IVS1 A>T). Материалом для исследования послужила ДНК, выделенная из цельной крови. С образцом выделенной ДНК параллельно проводились реакции амплификации с 2 парами аллель-специфичных праймеров, предназначенных для анализа олигонуклеотидного полиморфизма PPARG2 Pro12Ala, PPARGC1A, PPARGC1B и FTO (система «SNP-Экспресс – РВ» отечественного производителя ООО НПФ «Литех»). Детекция продуктов амплификации осуществлена амплификатором Rotor-Gene Q (QIAGEN, Германия) автоматически в каждом цикле амплификации. На основании этих данных управляющая программа строит кривые накопления флюоресцентного сигнала. Результаты анализа позволяют дать три типа заключений: гомозигота по 1 аллели, гетерозигота, гомозигота по 2 аллели.
Панель ФиброМакс включает алгоритм определенных показателей сыворотки крови (AЛT, АСТ, глюкоза, триглицериды, холестерин, общий билирубин, гаммаглутамилтранспептидаза [ГГТП], a2-макроглобулин, аполипопротеин A1, гаптоглобин, выполненных на анализаторе Olympus AU 400/Ireland с помощью реактивов Achitect 8000, Abbott/USA), а также пол, возраст, индекс массы тела. Согласно рекомендациям разработчиков панели ФиброМакс, заключение выдается по стадии фиброза (F), степени стеатоза (S), активности некровоспалительного процесса (А), определения степени стеатогепатита (N), наличия/отсутствия алкогольного стеатогепатита (H). В отношении данной когорты пациентов на аппарате FibroScan еще раз оценивалась стадия фиброза печени. У пациентов со стадией F-4 по шкале METAVIR (соответствует циррозу печени) оценивались признаки портальной гипертензии, синдрома гепатодепрессии, гиперспленизма. При этом части больных для подтверждения стадии фиброза печени выполнялась биопсия печени. Все исследования выполнялись с согласия пациентов.
Результаты исследования
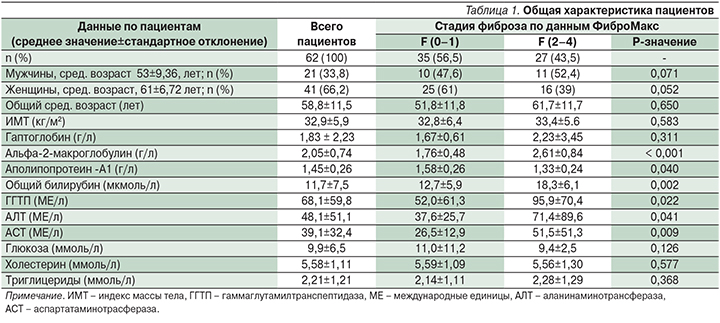
Пациенты старше 50 лет составили 81%; не имевшие ожирения – 32%, лица с ожирением – 68%. Ожирение 1-й степени диагностировалось у 40% пациентов, 2-й и 3-й стадий – у 27%. Все пациенты (100%) имели стеатоз (S), при этом 11% из них имели 1-ю степень (S1), 2-ю степень (S2) – 24% пациентов, а стеатоз 3-й степени (S3) – 65%. Общая характеристика пациентов с СД2 в зависимости от пола, возраста, степени ожирения (индекс массы тела), уровня АЛТ, АСТ, ГГТП, глюкозы, холестерина, триглицеридов представлена в табл. 1.
В табл. 2–4 представлена частота встречаемости полиморфизма генов PPARGC1A, PPARGC1B, PPARG2 Pro12Ala, FTO при гомозиготном (риск высокий) и гетерозиготном носительстве (риск низкий) и без полиморфизма у пациентов с СД2 и НАЖБП со степенью стеатоза (S) и стадией фиброза (F). При этом F 0–1 расценивается как отсутствие фиброза, F 2–4 – клинически значимый фиброз, в т.ч. и отдельно F 4 – цирроз печени; S-1 – минимальная степень стеатоза, S2 – умеренная степень и S3 –высокая.
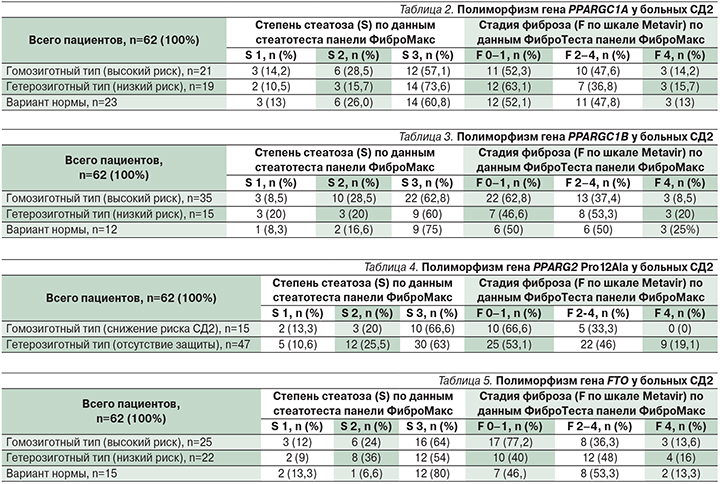
Во всех случаях с помощью непараметрических методов оценивалась взаимосвязь между полиморфизмом генов PPARGC1B, PPARG2 Pro12Ala, FTO и развитием фиброза/стеатоза печени с помощью Z-критерия, а для количественных характеристик (индекс массы тела, уровень холестерина, триглицеридов, глюкозы) критерий Манна–Уитни–Уилкоксона. Во всех случаях определялся p-value, который показывает, насколько данные согласуются с гипотезой, и если p-value <0,05, можно считать, что в группах есть разница, а значит, есть взаимосвязь. Во всех случаях статистически значимых отклонений найдено не было. Таким же образом были проанализированы показатели ИМТ, триглицеридов и холестерина. Оказалась, что для гена FTO выявлена статистическая взаимосвязь для холестерина: p-value=0,0104. Таким образом, показано, что у лиц, имеющих полиморфизм генов PPARGC1A, PPARGC1В, PPARG2 и FTO, определяющих риск развития СД2 и ожирения, риск прогрессирования фиброза и стеатоза печени не повышен по сравнению с пациентами, не имеющими таких генетических вариантов.
Обсуждение
Исследований, посвященных оценке влияния указанных генетических вариантов на прогрессирование фиброза печени при НАЖБП, ранее не проводилось. Известно, что варианты rs738409 C>G, rs2294918 A>G, расположенные в 22-й хромосоме в пататиноподобном домене фосфолипазы 3 (PNPLA3), rs2290602 гена PPARGC1A повышают риск развития у пациента НАЖБП, однако данных о темпах прогрессирования фиброза на сегодняшний день нет.
В последние годы все большее внимание уделяется изучению патогенеза НАЖБП, однако до настоящего момента единой теории не существует. Особое место занимает теория инсулинорезистентности: большинство авторов сходятся во мнении, будто имеется четкая взаимосвязь между снижением чувствительности ткани к инсулину и накоплением липидов в печени. Инсулинорезистентность способствует не только развитию жировой инфильтрации, но и усилению липогенеза в печени, что в дальнейшем инициирует процессы свободно-радикального окисления, развитие стеатогепатита и фиброза. Однако наличие стеатоза как такового не определяет прогноз болезни: именно скорость прогрессирования фибротических изменений обусловливает снижение качества жизни и исходы для пациента.
Отсутствие литературных данных о возможности такой корреляции, а также наши собственные результаты изучения генов PPARGC1A, PPARGC1В, PPARG2, FTO в группе больных СД2 и ожирением, возможно, могут свидетельствовать в пользу гипотезы, согласно которой течение НАЖБП, а также темп прогрессирования фиброза печени при данной патологии зависят в большей степени от компенсации других компонентов метаболического синдрома: достигнуты ли целевые уровни гликемии, контроль артериальной гипертонии, степень общего ожирения и т.п. Отсутствие влияния изученных генетических детерминант на прогрессирование фиброза печени не исключает наличия таковых в геноме человека и требует дальнейших исследований.
Заключение
Использование результатов исследований общегеномных ассоциаций (GWAS) для расчета риска развития заболеваний, в т.ч. для больных СД2, НАЖБП, прогрессирования фиброза печени представляется перспективным. Определение индивидуального генетического риска позволит проводить первичную профилактику заболеваний и, вероятно, будет являться основой персонализированной профилактической медицины.



