Одно из первых мест среди наследственных болезней занимают синдромы, связанные с нарушением биосинтеза или деградацией волокнистых структур соединительной ткани (СТ). Дисплазия СТ (ДСТ) – это нарушение развития СТ в эмбриональном и постнатальном периодах, которое происходит вследствие генетически измененного фибриллогенеза внеклеточного матрикса. ДСТ приводит к расстройству гомеостаза на тканевом, органном и организменном уровнях в виде различных морфофункциональных нарушений со стороны висцеральных и локомоторных органов с прогредиентным течением. При ДСТ наблюдаются весьма разнообразные клинические проявления, т. к. универсальных патологических повреждений СТ не существует [1].
Наиболее характерные клинические проявлениями ДСТ:
• скелетные изменения: астеническое телосложение, долихостеномелия (непропорционально длинные конечности), арахнодактилия (длинные тонкие пальцы), различные виды деформации грудной клетки (сколиозы, кифозы и лордозы позвоночника, синдром “прямой спины”), плоскостопие и др.; эти изменения связаны с нарушением строения хряща и задержкой созревания эпифизарной зоны роста, что проявляется удлинением трубчатых костей; в основе деформаций грудной клетки лежит неполноценность реберных хрящей;
• изменения со стороны кожи: гиперэластичность, истончение, склонность к травматизации и образованию шрамов в виде “папиросной бумаги” или келоидных рубцов;
• изменения со стороны мышечной системы: уменьшение мышечной массы, в т. ч. сердечной и глазодвигательной мускулатуры, что приводит к снижению сократительной способности миокарда и миопии;
• патология суставов: чрезмерная подвижность (гипермобильность), склонность к вывихам и подвывихам, обусловленная слабостью связочного аппарата;
• патология органов зрения: одно из самых частых проявлений ДСТ, представлено миопией различной степени, дислокацией хрусталика, увеличением длины глазного яблока, плоской роговицей, синдромом голубых склер;
• поражения сердечно-сосудистой системы, которые весьма разнообразны и нередко определяют прогноз; обычно диагностируются анатомические изменения клапанов сердца: дилатация фиброзных колец и пролапсы, аномальные хорды, расширение восходящего отдела аорты и легочной артерии с последующим формированием мешотчатой аневризмы; кроме того, деформации грудной клетки и позвоночника приводят к развитию различных типов торакодиафрагмального сердца;
• поражение сосудов проявляется аневризматическими расширениями артерий среднего и мелкого калибра и очень часто – варикозным расширением вен нижних конечностей;
• бронхолегочные поражения касаются как бронхиального дерева, так и альвеол; чаще всего диагностируют бронхоэктазы, простую и кистозную гипоплазию, буллезную эмфизему и спонтанный пневмоторакс;
• с патологией почек связывают нефроптоз и реноваскулярные изменения.
К неврологическим симптомам ДСТ относят разнообразные проявления вертеброгенного синдрома в виде ювенильного остеохондроза, межпозвонковых грыж, спондилолистеза, вертебробазилярной недостаточности. Однако в структуре клинической симптоматики пациентов с ДСТ наиболее часто лидируют психовегетативные нарушения, такие как вегетососудистая дистония, нейроциркуляторная дистония, панические атаки. Они формируются одними из первых уже в раннем детстве и рассматриваются как обязательный компонент диспластического фенотипа. У пациентов с ДСТ часто обнаруживается также астенический синдром, который проявляется снижением работоспособности, ухудшением переносимости физических и психо-эмоциональных нагрузок, повышенной утомляемостью, когнитивными нарушениями нейродинамического типа. Он выявляется в дошкольном и школьном, подростковом и молодом возрасте, сопровождая пациентов с ДСТ на протяжении всей жизни.
Наряду с присущими этим пациентам нарушениями в психической сфере в виде невротических расстройств, депрессии, ипохондрии, тревожнофобических расстройств, нервной анорексии возникают выраженные проблемы в сфере физической и социальной адаптации. В возрасте 14–15 лет проявления ДСТ усугубляются астеническими, вегетативными, тревожными и когнитивными симптомами. Известно, что пациенты с ДСТ формируют группу повышенного психологического риска с заниженной субъективной оценкой собственных возможностей, сниженными уровнями претензий, эмоциональной устойчивости и работоспособности, повышенными уровнями тревожности, ранимости, депрессивности. Закономерным следствием психологического дистресса становится ограничение социальной активности, ухудшение качества жизни и значительное снижение социальной адаптации, наиболее актуальные в подростковом возрасте.
Указанные синдромы тесно связаны с вопросами профессиональной подготовки, профессиональной пригодности и прогноза жизни подростков. Зачастую эта достаточно многочисленная группа пациентов остается без адекватной коррекции. Поэтому на сегодняшний день весьма актуальна проблема профилактики и лечения больных ДСТ с астеноневротическими, тревожновегетативными и когнитивными синдромами.
Традиционно при лечении ДСТ рекомендуют широко использовать такие методы, как психологическая поддержка, индивидуализация режима дня, лечебная физкультура, физиотерапия и массаж. Важна и диетотерапия с учетом повышенной потребности пациента в белках, незаменимых аминокислотах и микроэлементах. К медикаментозным методам следует отнести применение препаратов, позволяющих стимулировать коллагенообразование. Это прежде всего аскорбиновая кислота, препараты мукополисахаридной природы (хондроитинсульфат), витамины группы В (В1, В2, В3, В6) и микроэлементы (медь, цинк, магний). Рекомендовано включать в схемы лечения курсовую метаболическую терапию [5]. Специального обсуждения заслуживает терапия ацетил-L-карнитином (Карницетин; ООО “ПИК-ФАРМА”, Россия). L-карнитин (ЛК) и его производные, такие как ацетил-L-карнитин (АЛК), выполняют в организме человека важнейшую функцию. Они переносят остатки жирных кислот из цитоплазмы в матрикс митохондрий для образования энергии, необходимой для функционирования всех клеток, тканей и систем организма [2, 9]. В последние года АЛК начал широко использоваться в коррекции митохондриальных дисфункций различной этиологии наряду с ЛК и коэнзимом-Q [2, 3, 5]. Анализ многочисленных литературных источников позволяет сделать вывод, что АЛК имеет дополнительные, отличные от ЛК фармакологические свойства, которые позволяют использовать его в качестве лекарственного средства при астенических, психовегетативных и когнитивных нарушениях. Он свободно проходит через гематоэнцефалический барьер, легче усваивается клеточными структурами и быстрее включается в митохондрии, может функционировать как донор ацетильной группы для молекулы холина, образуя ацетилхолин, и более эффективен, чем ЛК, в нейропротекции, улучшая когнитивные функции [3, 10]. Показано, что АЛК влияет на работу мозга за счет широкого спектра нейрохимических свойств: повышает клеточную концентрацию аспартата и таурина, при длительном введении увеличивает плотность NMDA-рецепторов. АЛК способен модулировать эффекты не только холинергической, но и дофаминергической системы, усиливает действие серотонина, защищает клетки мозга от избытка глутамата и аммиака, чем можно объяснить его выраженное нейропротекторное действие [11–13, 15, 16].
Целью настоящего исследования явилась оценка клинической эффективности и переносимости АЛК (Карницетина) при лечении пациентов с ДСТ с выраженными астеноневротическими, тревожновегетативными и когнитивными синдромами.
Материал и методы
Объектом открытого сравнительного клинического исследования стали 60 пациентов с подтвержденным диагнозом ДСТ, находящихся на диспансерном учете у генетика в поликлинике НИИ терапии СО РАМН. Средний возраст больных составил 21,5 года.
Критерии исключения из исследования:
• лечение препаратами, влияющими на функции центральной нервной системы в течение 4 недель, предшествующих началу исследования;
• нестабильные сопутствующие заболевания, требующие лечения изменяющимися дозировками лекарств;
• депрессии в анамнезе или при оценке по шкале Гамильтона (> 10 баллов);
• наличие признаков хронического алкоголизма, лекарственной и наркотической зависимости;
• беременность.
Пациенты были распределены в две группы: основную (1-я группа) и контрольную (2-я группа). Пациенты 1-й группы получали монотерапию АЛК в суточной дозе 0,5 г (2 таблетки Карницетина по 295 мг). Пациентам контрольной группы проводили стандартную терапию ДСТ (немедикаментозная терапия: адекватный режим, лечебная физкультура, диетотерапия – использование продуктов, обогащенных белком, витаминами и микроэлементами, препараты магния) в течение 8 недель.
В программу обследования входили оценка соматического статуса (артериальное давление, частота сердечных сокращений, антропометрические данные, анализы мочи и крови, электрокардиография, ультразвуковое исследование сердца и почек); изучение когнитивных функций с использованием таблиц Шульте (исследование скорости обработки информации, концентрации внимания; норма – 40–50 секунд), теста Векслера (исследование скорости обработки информации, зрительно-моторной координации и избирательного внимания; норма – 40 секунд и более), теста 12 слов Гробера–Бушке (сумма непосредственного и отсроченного воспроизведения), Монреальской шкалы когнитивных нарушений (норма – сумма баллов не менее 26).
Применены следующие методы оценки вегетативных нарушений.
Опросник для выявления признаков вегетативных нарушений (заполняется пациентом); норма – до 15 баллов, сумма более 15 баллов говорит о высокой вероятности наличия синдрома вегетативной дисфункции (Вейн А.М., 1998).
Схема исследования для выявления признаков вегетативных нарушений (заполняется врачом); норма – до 25 баллов, сумма более 25 баллов говорит о высокой вероятности наличия синдрома вегетативной дисфункции (Вейн А.М.,1998).
Психовегетативные и астенические расстройства исследовались с помощью следующих шкал:
• Шкала Гамильтона для оценки тревоги (HARS); критерии оценки: 6 баллов и меньше – норма, 7–13 баллов – могут быть тревожные расстройства, 14–20 баллов – тревога, 21–28 баллов – симптоматическая тревога, более 29 баллов – выраженная тревога.
• Шкала субъективной оценки астении (MFI-20); показатели астении оценивались по 5 субшкалам: общая астения (норма до 12), физическая астения (норма до 12),снижение активности (норма до 12), снижение мотивации (норма до 12), психическая астения (норма до 12).
• Шкала глобального клинического воздействия для оценки улучшения (CGI-I); сравнительная оценка 1-й и 2-й групп.
• Шкала общего впечатления пациента; сравнительная оценка 1-й и 2-й групп.
Статистическая обработка данных используемых тестов и шкал проводилась при помощи компьютерной программы SPSS, версия 11.5. Для обработки данных использовались непараметрические критерии Уилкоксона–Манна–Уитни. При сравнении вариационных рядов учитывались достоверные различия (р < 0,001), а в отдельных случаях – тенденции к достоверности различий (р < 0,01 и р < 0,05 ). Различие долей в группах рассчитывалось по критерию χ² Пирсона.
Результаты исследования
У пациентов двух исследуемых групп выявлены: астенический синдром – 98 %; тревога – 95%; вегетативные симптомы – 82%; когнитивные нарушения – 47 %. Оценка астенических расстройств в основной группе к 60-му дню терапии показала, что у пациентов, получавших АЛК, достоверно уменьшились проявления общей астении (p < 0,01), повысилась физическая активность (p < 0,05), уменьшились проявления психологической астении (p < 0,01; рис. 1).
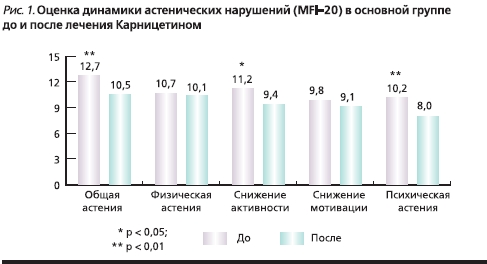
Было выявлено статистически значимое улучшение по нейродинамическим когнитивным шкалам: Гробера–Бушке и Шульте (p < 0,01), Монреальской шкале, тесту Векслера (p < 0,05). Клинически значимое улучшение ряда когнитивных функций и общее улучшение самочувствия пациентов отмечены уже к 30-му дню терапии. Статистически достоверно уменьшились вегетативные нарушения по результатам опросника Вейна (как по мнению врача, так и по субъективным ощущениям пациента; p < 0,01). К 60-му дню терапии уменьшились проявления тревоги (p < 0,01; рис. 2).
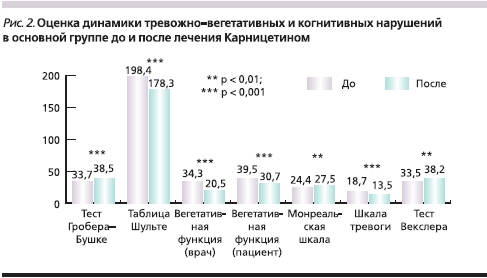
Установлен благоприятный профиль безопасности АЛК в суточной дозе 0,5 г/сут. Побочные эффекты в 1-й группе наблюдались у 3 пациентов, во 2-й группе – у 1; из исследования никто не выбыл. Основными жалобами, предъявляемыми пациентами в начале терапии, были дискомфорт в желудке и тошнота – 4 человека.
Сравнение результатов лечения в группах показало, что по шкале общего впечатления самого пациента к 30-му дню лечения существенных различий между основной и контрольной группами не наблюдалось, однако к концу исследования количество позитивных ответов в 1-й группе было существенно большим, чем во 2-й: значительно преобладало мнение об улучшении и сильном улучшении, тогда как в группе сравнения у половины пациентов улучшение было незначительным или отсутствовало (в основной группе – у 6,6 %; рис. 3).
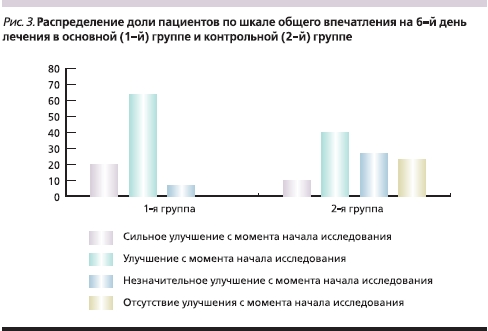
Оценка динамики состояния пациентов по шкале клинического воздействия–улучшения GGI-I в группах показала, что к 30-му дню лечения Карницетином частота улучшения и сильного улучшения составила в 1-й группе 90 % (оценка базировалась не только на субъективном мнении пациента, но и на динамике исследуемых шкал), тогда как во 2-й группе подобная оценка имела место только среди 46,6 % пациентов (почти в 2 раза реже). Более выраженная положительная динамика (76,7 % больных с выраженным улучшением против 50,1 %) сохранялась в основной группе и на момент завершения лечения (рис. 4).
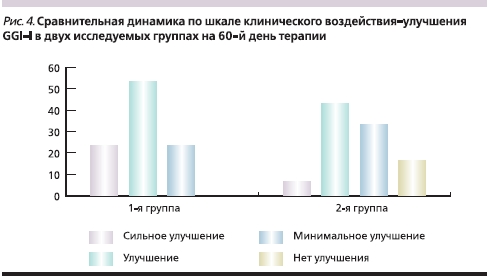
Выводы
1. У пациентов с ДСТ выявлена следующая неврологическая симптоматика: астенический синдром – 98 %; тревога – 95 %; симптомы вегетативной дисфункции – 82 %; когнитивные нарушения – 47 %.
2. Карницетин в суточной дозе 0,5 г/сут статистически достоверно снизил проявления общей астении, психической астении (p < 0,01), а также повысил физическую активность (p < 0,05).
3. Включение Карницетина (0,5 г/сут) в терапию пациентов с ДСТ достоверно уменьшает неврологическую симптоматику.
4. Выявлено статистически значимое улучшение по всем исследуемым когнитивным шкалам у получавших Карницетин пациентов. Клинически значимое улучшение ряда когнитивных функций нейродинамического типа (концентрация внимания, скорость выполнения заданий, память) и общего самочувствия пациентов отмечено к 30-му дня терапии.
5. На 60-й день исследования при лечении Карницетином статистически достоверно снизились тревожность (p < 0,01) и симптомы вегетативной дисфункции (p < 0,01).
6. Установлен благоприятный профиль безопасности Карницетина в дозе 0,5 г/сут.



