Введение
Дегенеративные заболевания позвоночника (ДЗП) являются одной из наиболее актуальных проблем клинической медицины. На протяжении жизни у 75–85 % взрослого населения индустриально развитых стран отмечаются эпизоды интенсивных болей в спине или шее. Достаточно длительно существовало мнение, что ДЗП являются исключительно результатом механической перегрузки [1, 2]. Более современные представления о ДЗП основаны на тщательном изучении гистологии и молекулярной биологии межпозвоночного диска (МПД). По мере накопления экспериментальных и клинических данных стало очевидным, что кровоснабжение и васкуляризация являются не менее важным фак-
тором развития ДЗП [3, 4]. Риск ДЗП также обусловлен интенсивностью системного воспаления, дефицитом эссенциальных макро- и микронутриентов, патологической компартментализацией минералов и генетическими факторами [5, 6]. МПД состоит из расположенного в центре пульпозного ядра и окаймляющего его фиброз-ного кольца. По современным представлениям, в состав обоих компонентов МПД входит три основных компонента соединительной ткани (СТ): образованная протеогликанами гелеобразная среда, коллагеновые и эластиновые волокна и клетки фибробластов,
являющиеся активным началом СТ. Основу гомеостаза МПД составляет тонкий баланс между процессами синтеза и деградации его компонентов [5, 7]. Развитие дисплазии СТ (ДСТ) и, следовательно, ДЗП связано с нарушениями метаболизма МПД, в первую очередь – со стороны компонентов СТ-матрикса.
По данным экспериментальных и клинических исследований, дефицит магния оказывает негативное воздействие на структуру и репаративную способность СТ. Например, в исследовании [8] установлено, что у пациентов с верифицированными магнитно-резонансной томографией (МРТ) грыжами МПД (ГМПД) имеет место нарушение содержания магния, цинка и мелатонина.
Проведенный нами ранее систематический анализ молекулярных механизмов, посредством которых может осуществляться воздействие магния на структуру и функцию СТ [5], показал, что ионы Mg2+ модулируют активность соответствующих биосинтетических ферментов. Например, гиалоуронансинтазы HAS1, HAS2 и HAS3, формирующие основу гелеобразной среды СТ, содержат ион магния в активном центре. Дефицит магния приводит к понижению активности гиалоуронансинтаз и как следствие – к ухудшению механических свойств нитей гиалоуронана гелеобразной среды внеклеточного матрикса. Дефицит магния способствует увеличению суммарной активности металлопротеиназ и более агрессивной деградации коллагеновых волокон, что также ухудшит механическую прочность СТ. Другими возможными механизмами влияния магния являются изменение активности эластаз (деградирующих эластичные волокна), трансглутаминазы (формирующей поперечные глутамин-лизиновые сшивки эластина), лизилоксидазы (поперечная сшивка цепей эластинов и/или коллагенов) и усиление аутоиммунных реакций (вариант Bw35 гена HLA-B).
Одним из перспективных направлений патогенетической терапии ДСТ является использование макро- и микронутриентов. Поскольку дефицит магния ассоциирован с нарушениями структуры СТ и широко распространен в самых различных популяциях, одним из наиболее перспективных направлений нутрициологической коррекции при ДСТ является использование препаратов органического магния. Кроме того, магний, являясь важным нейрорегулятором, оказывает значительное воздействие на функции центральной нервной системы [9].
Заметим, что дегенеративные заболевания МПД представляют собой сочетание нескольких проявлений
ДСТ – дегенерации вещества МПД и гипермобильности отдельных позвоночных двигательных сегментов. Наиболее ярким проявлением этой патологии является формирование ГМПД – состояния, сопровождающегося резким болевым синдромом, а в ряде случаев – стойкими неврологическими выпадениями двигательных и чувствительных функций. Следует также отметить, что проведенное оперативное вмешательство по удалению ГМПД не останавливает дегенеративный процесс, что в ряде случаев приводит к возникновению повторных грыж диска.
Таким образом, проведенные к настоящему времени многочисленные фундаментальные исследования убедительно свидетельствуют, что магнийнеобходим для поддержания структуры СТ. Однако, несмотря на очевидную вовлеченность метаболизма СТ в патогенез ДЗП, клинических исследований
по изучению данной патологии с позиций ДСТ проведено не было. В связи с этим нами проведено клиническое исследование, целью которого явилось изучение состояния пациентов после удаления ГМПД на фоне приема магния оротата (МО; Магнерот®).
Материал и методы
Дизайн исследования
Рандомизированное исследование, включившее 60 человек, требующих проведения хирургического лечения по поводу ГМПД пояснично-крестцового отдела позвоночника. Первую группу составили 30 пациентов, в послеоперационном периоде получавших Магнерот® 500 мг (2 таблетки 3 раза в
сутки) в течение 4 месяцев дополнительно к стандартному реабилитационному лечению. Во 2-ю группу вошли 30 пациентов, получавших только стандартную терапию.
Критерии включения в исследование:
• возраст от 40 до 60 лет;
• стойкий выраженный корешковый болевой синдром, сохраняющийся в течение не менее 6 недель, несмотря на проводимую стандартную консервативную терапию;
• данные МРТ, подтверждающие ГМПД пояснично-крестцового отдела позвоночника на одном уровне.
Критерии исключения: возраст менее 40 и старше 60 лет, каудальный синдром, выраженный моторный
дефицит, наличие операции на позвоночнике в анамнезе, фораминальные и экстрафораминальные ГМПД, МРТ-признаки спинального стеноза, патология позвоночника в анамнезе, тяжелая соматическая патология.
Протокол клинического исследования
Пациентам 1-й и 2-й групп до операции проводили МРТ-исследование (томограф GE SigmaOvation Excite 0,35), функциональную рентгенографию пояснично-крестцового отдела позвоночника, тщательный неврологический осмотр, оценку болевого синдрома по визуальной аналоговой шкале (ВАШ) и качества жизни по опроснику Oswestry (Oswestry Disability Index – ODI) [10], исследование фенотипических признаков дисплазии СТ, оценку гипермобильности суставов по Breighton, исследование клинических признаков дефицита магния. Сотрудниками кафедры клинической и лабораторной диагностики ГОУ ВПО РГМУ Росздрава выполнялся полиэлементный анализ операционного материала – ткани МПД, а также образцов волос пациента с использованием масс-спектрометра с индуктивно связанной плазмой (Pelker Elmer, США). Спустя 3 дня после операции пациенты 1-й группы начинали прием МО (Магнерот®), который продолжался в течение 4 месяцев. Проводили мониторинг побочных явлений во время терапии Магнеротом®. На 120-й день исследования у пациентов обеих групп проводили повторное обследование.
Для оценки выраженности болевого синдрома использовали 10-балльную ВАШ, где 0 – отсутствие боли, а 10 –максимальная ее выраженность.
Для оценки качества жизни использовали опросник Oswestry (ODI), русская версия 2.1. Шкала Oswestry разработана специально для оценки интенсивности боли в нижней части спины. Максимальная оценка составляет 50 баллов. Шкала разделяется на 10 подразделов: интенсивность боли, элементы ухода за собой, подъем тяжестей, ходьба, сидение, стояние, ночной сон, социальная жизнь, поездки, измене-
ние степени боли. Оценки по каждому подразделу находятся в диапазоне от 0 до 5 баллов.
Статистическую обработку собранных данных проводили с помощью пакета прикладных програма
“Statistica 6.0” и электронных таблиц Microsoft Excel. С учетом соответствия изучаемых признаков нормальному распределению использовали методы параметрической статистики.
Результаты и обсуждение
Средний возраст включенных в исследование пациентов 1-й группы составил 52 ± 8 лет, 2-й группы –
54 ± 6 лет; различий между группами выявлено не было. Средняя длительность корешковых болей до операции составляла 6,5 ± 3,0 недели в 1-й группе и 6,2 ± 2,4 недели во 2-й. По данным МРТ, у пациентов выявлены ГМПД L5-S1 (n = 32), L4-L5 (n = 23), L3-L4 (n = 3), L2-L-3 (n = 2) позвонков. На начало исследования у пациентов 1-й группы выраженность радикулярных (“корешковых”) болей
по ВАШ составила 6,30 ± 1,27 балла, оценка уровня жизни по ODI – 30,6 ±3,2 балла. Во 2-й группе соответствующие показатели составили 5,94 ± 1,1 и 30,25 ± 5,5 балла. Значимых различий между группами выявлено не было.
Отмечена высокая приверженность участников исследования проводимому лечению, в частности приему препарата Магнерот®. В многом это было обусловлено тем, что пациенты, получавшие Магнерот®, отмечали повышение работоспособности, снижение утомляемости и улучшение общего самочувствия. Это отражалось в более значительном по сравнению со 2-й группой улучшении качества
жизни через 4 месяца после операции. Поэтому даже по окончании 4-месячного курса лечения многие
пациенты обращались к лечащему врачу с просьбой о продлении терапии Магнеротом®.
Проводимый мониторинг побочных эффектов Магнерота® выявил хорошую переносимость препарата. У 4 пациентов в начале приема Магнерота® отмечено учащение стула, прекратившееся в течение 3–8 дней без отмены препарата. Иных побочных явлений выявлено не было.
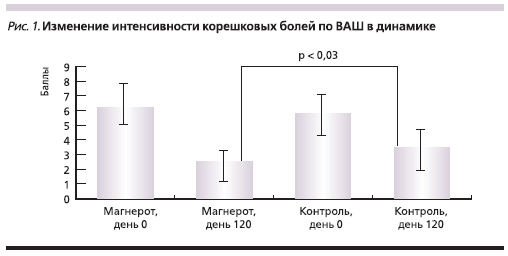
При динамическом наблюдении в течение 4 месяцев после операции было отмечено значительное уменьшение интенсивности болевого синдрома у пациентов обеих групп. По ВАШ на 120-й день ослабление боли было статистически более выраженным у пациентов 1-й группы (рис. 1). Также
на фоне приема органического магния в течение 4 месяцев более заметно снижалась выраженность остаточных болей в ногах (p = 0,004).
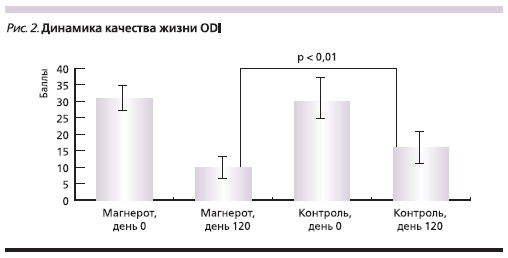
Важно подчеркнуть, что помимо эффективного ослабления болевого синдрома 4-месячное применение
Магнерота® приводило к более выраженному повышению качества жизни по шкале ODI (p = 0,01), чем при стандартном ведении послеоперационного периода (рис. 2).
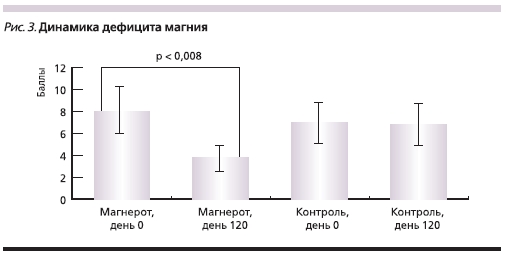
При повторном исследовании клинических проявлений магниевого дефицита через 4 месяцев после операции у пациентов, получавших МО, отмечено значительное уменьшение клинических проявлений дефицита магния со снижением балльной оценки по шкале дефицита (рис. 3). Пациенты отмечали улучшение сна, стабилизацию артериального давления, регресс неприятных ощущений в области сердца, уменьшение аритмии, судорог в ногах, значительное улучшение эмоционального фона
(табл. 1). Во 2-й группе значимого уменьшения клинических проявлений магниевого дефицита выявлено не было.
Таблица 1. Клиническая симптоматика в динамике лечения при сравнении группы 1 с группой 2.
Нами проведен корреляционный анализ клинических проявлений магниевого дефицита, ДСТ, интенсивности болевого синдрома и качества жизни в начале исследования и через 4 месяца после операции. Оказалось, что у пациентов 1-й группы отмечена положительная корреляционная зави-
симость между клиническими признаками дефицита магния и интенсивностью остаточных болей в ногах по ВАШ через 4 месяца после операции (r = 0,58; p = 0,05). Пероральный прием МО способствовал значимому по сравнению с контролем снижению риска аритмии в 10 раз (отношение шансов [ОШ] – 0,1; 95 % доверительный интервал [ДИ] – 0,01–0,8; р = 0,01), судорог икроножных мышц в 5 раз (ОШ – 0,2; 95 % ДИ – 0,04–1,0; р = 0,038) и беспокойного сна в 3 раза (включая вздрагивания при засыпании; ОШ – 0,3; 95 % ДИ – 0,1–1,0; р = 0,045). Судороги и вздрагивания при засыпании являются одними из наиболее часто встречаемых клинических проявлений дефицита
магния [11].
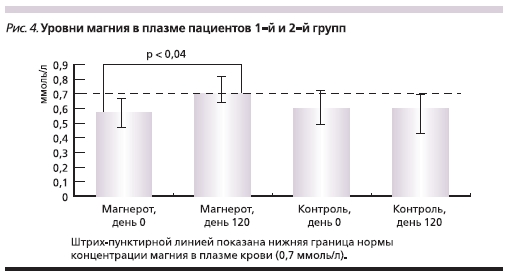
Исследование уровня магния в плазме крови показало заметную положительную динамику при приеме
Магнерота® (рис. 4). Обе группы характеризовались пониженным уровнем магния на момент начала исследования: 0,56 ± 0,33 ммоль/л в 1-й группе и 0,59± 0,24 ммоль/л во 2-й. Через 4 месяца уровень магния у пациентов 2-й группы не изменился (0,59 ± 0,30 ммоль/л), но значительно вырос в 1-й группе, получавшей МО (0,70 ± 0,1 ммоль/л; р <0,04). Таким образом, прием препарата Магнерот® способствовал пополнению магниевого депо пациентов, что и объясняет описанную выше положительную динамику клинической симптоматики.
Полученные в настоящем исследовании данные о благоприятном влиянии дотации магния на состояние пациентов в период реабилитации не являются случайными. Известно, что в процессе формирования болевых синдромов, в первую очередь хронических, значительную роль играет именно нарушение локального гомеостаза магния. Так, известно, что процессы трансдукции, проведения и модуляции нервных импульсов на уровне воротной зоны спинного мозга в значительной степени являются зависимыми от содержания ионов Mg2+ и опосредуются сотнями белков – молекулярных мишеней
магния [9]. Прежде всего в физиологических условиях ионы Mg2+ обеспечивают блокаду NMDA-рецепторов, препятствуя проведению избыточных ноцицептивных импульсов.
Важным наблюдением является сравнительная динамика клинических проявлений дефицита магния в исследованных группах. На фоне приема МО в виде препарата Магнерот® у пациентов 1-й группы отмечен полный регресс клинических проявлений такого дефицита. У пациентов 2-й группы, напротив, симптомы дефицита магния не регрессировали в послеоперационном периоде, несмотря на значительное уменьшение болей и улучшение общего эмоционального фона. Возможно, именно сохраняющийся дефицит магния является одним из важных факторов, способствующих возникновению и сохранению остаточных болей в послеоперационном периоде. Интенсивный болевой синдром запускает формирование порочного круга “боль–стресс–дефицит магния–усиление боли”, что и определяет эффективность включения органических солей магния в лечение ДЗП.
Одним из наиболее важных результатов данного исследования явилось установление различий элементного состава в тканях МПД с различной гистологией. В исследованных образцах грыж пациентов 1-й и 2-й групп было идентифицировано 2 условных гистологических типа СТ:
• 1-й тип – ткань рыхлая, хрупкая и крошащаяся (25 образцов);
• 2-й тип – ткань густая, вязкая, высокоэластичная (35 образцов).
Следует отметить, что эти 2 типа ткани были равномерно распределены по 1-й и 2-й группам пациентов. Элементный анализ образцов двух гистологических типов ткани МПД указывает на фундаментальные различия в патофизиологии их формирования. Ткань грыжи диска 1-го типа
содержала значительно меньшее количество структурных элементов (азот, сера, углерод) и эссенциальных микроэлементов. Существенно более низкое содержание макро- и микроэлементов
в ткани 1-го типа может указывать на ее гипотрофию тканей и усиление процессов дегенерации.
Несмотря на то что уровни меди в ткани грыжи 1-го и 2-го гистологических типов не различались, основополагающее соотношение Zn/Cu в ткани 1-го типа составило 1 : 1,6, а в ткани 2-го типа – 1 : 1. Преобладание меди в ткани 1-го типа указывает на более высокий уровень воспалительного
ответа и, соответственно, выраженные деструктивные изменения МПД у этих пациентов.
При проведении корреляционного анализа связей между элементным профилем исследованных грыж и
клинико-морфологическими характеристиками пациентов установлена обратная корреляция между уровнем боли по ВАШ и концентрацией лития в ткани ГМПД (r = -0,53; p < 0,001). Известно, что пониженные концентрации лития в плазме крови коррелируют с повышенной болевой чувствительностью (В.Г. Ребров, О.А. Громова, 2008).
Обнаружена корреляция между клиническими проявлениями дефицита магния и уровнем бора в ткани
грыжи: чем ниже концентрация бора, тем более выражен дефицит магния (r = -0,6; p < 0,0001). Известно, что поддержание здоровья не только костной ткани, но и хрящевого связочного аппарата зависимо от гармоничности соотношения концентраций макро- и микроэлементов – магния, кальция, бора, цинка и марганца.
Как известно, бром регулирует возбуждение коры при ноцицепции. В настоящем исследовании установлено, что более низкое содержание брома ассоциируется с повышенной болевой чувствительностью и длительностью болей. Выявлены обратные корреляции между содержанием брома в ткани грыж и длительностью болей, интенсивностью болей по ВАШ и ODI (r = -0,5; -0,7; p < 0,0001), а также с клиническими проявлениями дефицита магния (r = -0,73; p < 0,00001). Это сви-
детельствует о том, что микроэлементный состав ткани ГМПД в значительной степени коррелирует с исследованными клиническими параметрами.
Установлена корреляция между уровнем магния в ГМПД и суммой баллов по ODI (r = -0,44; p < 0,0001).
Аналогичная корреляция установлена для калия (r = -0,78; p < 0,0002).
Очевидно, что взятие проб МПД возможно только при оперативном вмешательстве. Поэтому представляет интерес изучение корреляций между содержанием микроэлементов в ткани диска и содержанием их концентраций в волосах пациентов – удобного биосубстрата для проведения микроэлементного анализа.
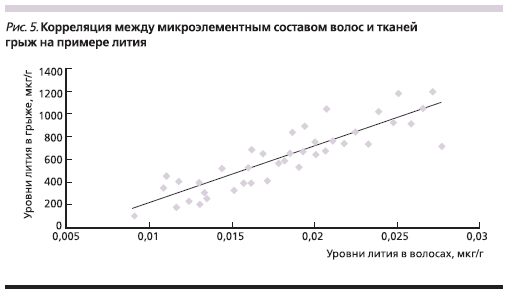
Наиболее сильные корреляции между тканью грыж и волосами были обнаружены для лития (r = 0,84; p < 0,00003, рис. 5) и бора (r = 0,79; p < 0,0006). Для остальных элементов корреляции были более слабыми, но статистически значимыми (r = 0,2-0,5; p < 0,001). Следует особо отметить достаточно
важное наблюдение, сделанное в ходе настоящего исследования: концентрация некоторых элементов в волосах заметно коррелировала с гистологическим типом грыж. Так, гипотрофические ГМПД с СТ 1-го типа характеризовались гораздо более низким содержанием лития, цинка, бора и магния.
Одновременно у пациентов с такими грыжами обнаруживался более низкий уровень лития, калия, цинка, бора и магния в волосах (табл. 2).
Таблица 2. Корреляции между концентрациями микроэлементов в волосах и типом СД ГМПД.
Установленные корреляции между микроэлементным составом волос и ткани ГМПД позволяют прогнозировать тип ткани грыж, что должно учитываться при разработке плана ведения пациента. Например, низкое содержание лития в волосах указывает на то, что у пациента будет выражен болевой синдром, а низкие концентрации бора указывают на снижение уровня магния в ткани диска.
Для иллюстрации полученных результатов приводим характерное клиническое наблюдение.
Пациент Р. 58 лет. Интенсивные боли в левой ноге возникли за 5 недель до госпитализации после неловкого движения. В связи с резковыраженным болевым синдромом был госпитализирован в неврологическое отделение по месту жительства с жалобами на интенсивные, постоянные боли в
области задней поверхности левого бедра и голени, онемение в области мизинца левой ноги, ночные судороги в ногах. При опросе отмечал учащение головных болей, преимущественно в затылочной области, появление частых сердцебиений, головокружения несистемного характера. Кроме того,
стали беспокоить нарушение ночного сна, снижение памяти, раздражительность.
Анамнез: туберкулез, венерические заболевания, вирусный гепатит отрицает; хронических заболеваний нет; курит до 1 пачки сигарет в день, алкоголем не злоупотребляет; работает водителем.
При осмотре: движения в конечностях в полном объеме, сила мышц – 5 баллов, выпадение ахиллова рефлекса слева, гиперальгезия в зоне S-1 корешка слева, симптом Ласега слева 25 градусов, справа перекрестный симптом Ласега – 30 градусов. Оценка по ВАШ: 9 баллов, оценка по ODI: 45 баллов.
Исследование фенотипических особенностей ДСТ обнаружило следующие явления: симптом большого пальца, сколиотическая деформация позвоночника, повышенная растяжимость кожи, гипермобильность суставов по Breighton (2 балла). Установлены следующие клинические признаки дефицита магния: кардиоваскулярные – повышение артериального давления, сердцебиения; церебральные – головные боли, головокружения, нарушение памяти, сна, раздражительность.
В течение 4 недель проводилась консервативная терапия, приведшая к незначительному уменьшению болевого синдрома. В связи с сохранением выраженных болей выполнено МРТ- исследование, выявившее грыжу диска L5–S1-позвонков; консультирован нейрохирургом, рекомендовано оперативное лечение.
Пациенту выполнено оперативное вмешательство: микродискэктомия на уровне L5–S1 слева. Через 3 дня начат прием Магнерота® в стандартной дозе. Уже в раннем послеоперационном периоде отмечено значительное уменьшение болей. Оценки по ВАШ и ODI перед выпиской – 4 и 24 балла соответственно, однако сохранялись непостоянные головные боли, головокружения, нарушение сна.
Через 4 месяца обратил внимание на исчезновение головных болей, ночных судорог в нога, головокружений, нормализацию ночного сна. Катамнестическое наблюдение через 6 месяцев после операции: полный регресс болей, оценки по ВАШ и ODI – 2 и 14 баллов соответственно. Регрессировали ночные судороги в ногах, головные боли, головокружения, артериальное давление – 130/70 мм рт. ст. Работает на прежнем месте. При подробном расспросе выявлено, что полный регресс “корешковых” болей был отмечен через 2 месяца после операции.
Приведенный клинический пример убедительно демонстрирует наличие грубых изменений магниевого
баланса при вертеброгенном болевом синдроме, с одной стороны, а с другой – необходимость и высокую эффективность нутрициологической коррекции данного состояния приемом препаратов органического магния.
Заключение
Терапия органическими препаратами магния способствует в т. ч. купированию клинических проявлений дефицита этого микроэлемента. Дефицит магния в значительной степени усугубляет клинические проявления ДЗП, приводя к усилению и хронизации болевого синдрома.
У пациентов, принимавших Магнерот®, наблюдалось отчетливое и статистически значимое снижение интенсивности “корешковых” болей и значимое улучшение качества жизни через 4 месяца после операции. При приеме препарата отмечено значительное уменьшение клинических проявлений
дефицита магния: пациенты отмечали улучшение сна, стабилизацию артериального давления, регресс неприятных ощущений в области сердца, аритмии, судорог в ногах. Установленные принципиальные различия в гистологии СТ (1-q тип – ткань рыхлая, хрупкая и крошащаяся; 2-q тип –
ткань густая, вязкая, высокоэластичная) и корреляции гистологического типа ткани грыжи с микроэлементным составом волос открывают перспективы персонализированного ведения пациентов, включая назначение препаратов органического магния.
По данным настоящего исследования, терапия Магнеротом® пациентов, перенесших операцию по удалению ГМПД, должна продолжаться не менее 4 месяцев с дозой МО не менее 500 мг/сут (в расчете на элементарный магний).



