Введение
Синдром раздраженного кишечника (СРК) – наиболее распространенная нозологическая форма функциональной патологии желудочно-кишечного тракта (ЖКТ). Высокая частота обращаемости пациентов в лечебные учреждения с жалобами на рецидивирующие боли в животе, снижение качества жизни и активности больных, неудовлетворительные результаты лечения заставляют считать СРК серьезной медицинской и социально-экономической проблемой современности [1, 2].
Современные представления о СРК
В 2016 г. состоялась официальная презентация объективных диагностических критериев СРК, предложенных Международной рабочей группой специалистов по изучению проблем функциональных гастроинтестинальных нарушений, известных как Римский консенсус-IV [3, 4]. Эксперты Римского комитета акцентируют внимание интернистов на сохраняющуюся актуальность и сложность проблемы функциональной патологии, в отношении которой найдено много предположений, но мало документальных доказательств, например, касающихся этиопатогенетических механизмов развития. По современным теоретическим представлениям, СРК – полиэтиологичное заболевание, возникающее в результате пошаговых изменений физиологических процессов в организме человека в ответ на действие первичных и вторичных раздражителей (наследственная предрасположенность, средовая обусловленность; рис. 1). Трактуется СРК как хроническое функциональное расстройство кишечника, при котором определяющим клиническим фактором служит боль в животе, облигатно (непременно) связанная с дефекацией или изменениями характера и консистенции стула. Болевые ощущения (чувство дискомфорта, боль) склонны к персистированию, они усиливаются или уменьшаются в связи с присутствием или отсутствием триггеров окружающей среды. Интенсивность их также варьируется и коррелирует с уровнем избыточного газообразования и порогом висциральной болевой чувствительности. При этом отмечено, что помимо рецидивирующего ощущения боли в животе СРК ассоциирован с клиническими проявлениями нарушенной гастроинтестинальной физиологии (диарея, запор, чередование того или другого, слизь в копрофильтратах). Существующие четкие различия между указанными нарушениями позволили выделить основные варианты заболевания: СРК с преобладающей диареей; СРК с преобладанием запоров; СРК с чередующимися диареей и запором [3, 4].

Пользуясь данными медицинской литературы по объяснению патогенеза многих хронических заболеваний, в т.ч. СРК, хочется подчеркнуть существующую современную концепцию «два мозга в организме человека» с понятием оси «головной мозг–кишечник–микробиота» [5–7] (рис. 2). Суммируя соответствующие факты, становится понятным, что ось – это двунаправленная разветвленная коммуникационная сеть, которая с помощью нейроиммуноэндокринных медиаторов преобразует и интегрирует функции центральной нервной системы и кишечника [5–9] (рис. 3). Существуют достоверные данные, указывающие на то, что микробиота через производство локальных нейротрасмиттеров кишечника (серотонин, гамма-аминомасляная кислота, мелатонин, гистамин, ацетилхолин) по системе нейроиммуноэндокринной иерархии координирует местные адаптивные реакции к стрессовых факторам [10]. Кроме того, микробиота может изменять физиологию мозга посредством продукции широкого спектра цитокинов, короткоцепочечных жирных кислот и усиления афферентной нервной активности.

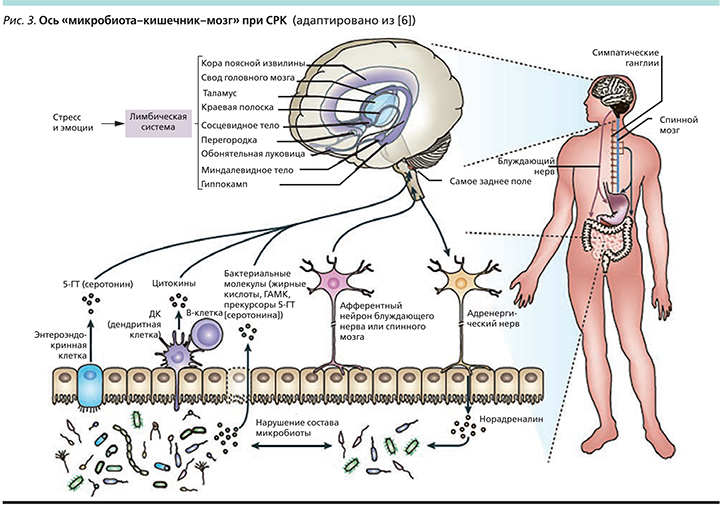
Состояние микробиоты при СРК
Патофизиологическим обоснованием взаимодействия состава фекальной микробиоты с развитием СРК служит нейроиммуноэндокринный дисбаланс, который влечет за собой патологические сдвиги в разных компонентах вышеупомянутой системы, а также через повышение концентрации норадреналина модифицирует ключевую микробиоту и ее функциональную стабильность [8, 9]. Как показали последние исследования, при СРК происходит закономерная дестабилизация защитного микробного равновесия, характеризующаяся изменением видового разнообразия и количественного состава бактериальных популяций в экологических нишах ЖКТ. При этом корректируются основные метаболические функции микробиоты: ферментация полисахаридов с образованием короткоцепочечных жирных кислот, поддерживающих энергетический баланс (бутират, пропионат, ацетат), утилизация водорода и углекислого газа, продукция важнейших интермедиаторов микробного метаболизма (лактат, сукцинат, формиат), метаболизм аминокислот, желчных кислот, холина; биосинтез витаминов и некоторых биологически активных соединений [11–16]. В качестве практической иллюстрации к сказанному можно привести результаты недавнего клинического исследования, где при СРК было наглядно показано статистически значимое снижение уровня бутират-продуцирующих бактерий и водород-утилизирующих микроорганизмов (метаногенов). Считается, что последние могут служить потенциальными диагностическими маркерами дисбиотических состояний при СРК и указывать на нарушение кишечного барьера, а также избыточного газообразования. Кроме того, эти индикаторы могут быть полезными для мониторинга пациентов с СРК и оценки чувствительности к мультитаргетной терапии [17].
С практических позиций важно также знать, что кроме вышеописанных эффектов симбиотической микробиоты с дисбиотическими изменениями выяснена ее существенная патологическая роль в формировании синдрома избыточного бактериального роста в тонкой кишке (СИБР) при СРК. Установлено, что у 30–84% больных СРК с помощью дыхательного теста выявляется СИБР. Мета-анализ результатов 11 исследований показал, что положительный водородный тест чаще регистрируется у пациентов с СРК, чем у здоровых (отношение шансов – 4,46; 95% доверительный интервал – 1,69–11,8) [18].
СИБР не является самостоятельным заболеванием, а трактуется как патологическое состояние, при котором эндогенные фекальные (анаэробные) или орофарингеальные (аэробные) бактерии имплантируются в не свойственный для них биотоп [19–21]. За счет такой чужеродной транслокации меняется видовой и функциональный состав доминирующих тонкокишечных популяций с потерей части «полезных» бактерий-комменсалов, поддерживающих гомеостаз и барьерную функцию кишечника [22]. Более того, усиленное размножение анаэробов в тонкой кишке нарушает природный механизм энтерогепатической циркуляции желчных кислот за счет повышенной способности микроорганизмов деконъюгировать связанные желчные кислоты и формировать токсичные эндогенные соли желчных кислот, в результате чего инициируется диарейный синдром. Такие тяжелые и сочетанные нарушения микробиоценоза (СИБР, дисбактериоз толстой кишки) ассоциированы со многими заболеваниями, включая СРК.
Пробиотическая коррекция нарушенного микробиоценоза при СРК: применение Lactobacillus rhamnosus
Современные клинические руководства при выборе адекватного варианта базисной терапии СРК предлагают учитывать характер и тяжесть клинических симптомов заболевания, их корреляцию с приемом пищи и дефекацией, наличие социальной дезадаптации и психологической коморбидности. При этом большинство специалистов полагают, что полное излечение СРК маловероятно [3, 4]. Из всех представленных в настоящее время фармакологических и биологических препаратов для коррекции нарушенного микробиоценоза наибольшую доказательную базу, подтвержденную международными и национальными исследованиями, имеют пробиотики. В последние годы накоплен достаточный объем информации о влиянии энтерально принятых лактобацилл на микробиоценоз тонкой и толстой кишки [23–25]. Суммарный анализ результатов плацебо-контролируемых исследований свидетельствовал о быстрой нормализации стула, купировании метеоризма и снижении показателя водородного дыхательного теста, сохраняющегося в течение 21 дня после завершения лечения.
В развернутой таксономической характеристике штаммов особый интерес представляет Lactobacillus rhamnosus, обладающий строгой доказательной базой (качественные многоцентровые контролируемые клинические испытания), подтверждающей совершенно разные функциональные возможности штамма, рассматриваемого большинством специалистов как ключевой компонент микробиоты тонкой и толстой кишки [26, 27]. L. rhamnosus – грамположительный гомоферментативный микроорганизм, ферментирующий полисахариды с образованием органических кислот, в норме входит в состав микробного сообщества ЖКТ, ротовой полости и влагалища, не содержит лактозы. Современный взгляд на результаты доклинических исследований штамма и его преимущества наиболее полно и аргументированно излагают H.M. Timmerman et al. [27]. Например, изучение выживаемости штамма L. rhamnosus показало, что он проявляет устойчивость к отрицательному воздействию модельных сред, имитирующих условия стресса в ЖКТ человека. Штамм L. rhamnosus хорошо переносит градиент кислотности/щелочности модельных сред и не снижает своей численности, что подтверждается высевом соответствующих суспензий на плотные питательные среды с подсчетом выросших колоний. Таким образом, доказано, что L. rhamnosus обладает высокой устойчивостью к низким значениям рН и способностью выживать в присутствии желчи и панкреатического сока.
Далее in vitro были исследованы адгезивные свойства в отношении клеток эпителия кишечника двух различных клеточных линий: Caco-2 и HT-29. Установлено, что штамм относится к высокоадгезивным, обладающим отличным тропизмом к эпителиоцитам, следовательно, имеет выраженную тенденцию к длительному персистированию в интестинальной экологической нише. Такая концентрация пробиотических бактерий остается метаболически активной, способной модифицировать кишечную флору и укреплять целостность кишечного барьера.
Практически аналогичные результаты получены в другой работе, выполненной с помощью биоптатов слизистой оболочки толстой кишки больных дивертикулитом, ректальной карциномой и СРК. Используя меченные 3Н-тимидином бактерии и технику жидкостной сцинтилляции, авторы определили, что тест-штаммы кисломолочных бактерий проявляют разную степень адгезивности к тканям кишки и слизи. Полученные гистологические данные свидетельствуют о том, что L. rhamnosus оказывает более выраженный и отчетливый адгезивный эффект, чем другие кисломолочные бактерии.
Сходные результаты получены в ходе клинических исследований, в которых L. rhamnosus получали здоровые младенцы и грудные дети с ротавирусным гастроэнтеритом. Удалось установить, что принятый внутрь пробиотик обладает максимально высокими показателями выживаемости и адгезивности. L. rhamnosus обнаруживался в каловых массах детей на протяжении 2–12 недель после завершения приема. Более того, исследование продемонстрировало четкие клинические проявления протективного действия пробиотика на слизистую оболочку кишки и его прямую противовирусную активность в отношении ротавирусного возбудителя.
Экспериментально изучалась антагонистическая активность L. rhamnosus в отношении клинических штаммов патогенных микроорганизмов с использованием метода диффузии в агар. Оказалось, что L. rhamnosus очень хорошо элиминирует ряд бактериальных возбудителей кишечных инфекций – Salmonella spp., Listeria spp., Escherichia coli, Staphilococcus, Enterococcus faecalis. L. rhamnosus исследовался также на способность замедлять пролиферацию in vitro грибов рода Candida. Штаммы пробиотика вносились в пробирку с 10 мл жидкой среды MRS. В ту же пробирку добавлялись штаммы грибов рода Candida. L. rhamnosus обеспечивал полное подавление роста дрожжей рода Candida, что является ее специфической характеристикой и делает данный штамм кисломолочных артерий перспективным для создания нового класса терапевтических агентов для терапии больных кандидозом [27].
Сохранность барьерной функции кишечника оценивали, измеряя трансэпителиальное электрическое сопротивление (ТЭС). Монослой клеточных линий эпителия Caco-2 растили на фильтре. Сначала к клеткам Caco-2 на 12 часов добавляли исследуемый пробиотик, а затем на 1 час – воспалительный стресс-фактор в присутствии L. rhamnosus. Затем измеряли ТЭС монослоя через 4 и 24 часа. Результаты сравнивали с ТЭС монослоя клеток, который подвергался только воздействию стресс-фактора, и с ТЭС монослоя, который не подвергался никаким воздействиям. Установлено, что L. rhamnosus проявляет раннее и длительное стимулирующее действие на репаративные процессы, что имеет большое значение с точки зрения восстановления нарушенной эпителиальной проницаемости и укрепления целостности защитного кишечного барьера [27].
С помощью экспериментальных работ убедительно доказано, что лактобациллы способны воздействовать на уровень активации противовоспалительной цитокиновой системы за счет сигнальных молекул интерлейкинов-6, -10 и -12. L. rhamnosus оказывают заметное влияние не только на иммунную толерантность слизистой оболочки, но и на развитие системных иммунных реакций, т.к. могут избирательно определять, какому типу иммунного ответа (Th1, Th2, Th3) способствуют дендритные клетки (DCs). Процесс распознавания DCs и селективный ответ на комменсалы или патогены осуществляются через семейство Toll-подобных рецепторов (TLR). TLR2 различает компоненты оболочки грамположительных бактерий, таких как мурамилдипептид и липотейхоевая кислота. TLR4 представляет собой рецептор для липополисахаридов, входящих в состав оболочки грамотрицательных бактерий [28, 29].
На кишечных эпителиальных клетках лабораторных животных, получавших с кормом пробиотические бактерии, показано, что L. rhamnosus, Bacteroides ovatus и E. coli, взаимодействуя с TLR2 и TLR4, индуцировали синтез разных цитокинов, причем противовоспалительное действие L. rhamnosus оказалось более значимым, т.к. при совместном культивировании подавлялся синтез цитокинов, индуцированных другими штаммами [30].
История доказательств многообразия клинических эффектов L. rhamnosus GG исчисляется десятилетиями, штамм до настоящего времени остается наиболее изученным. В ряде авторитетных научных работ показано, что L. rhamnosus GG демонстрирует стабильный результат в отношении сокращения риска развития острой диареи у детей, способствует усиленной выработке антител, синтезу вакциноспецифических антител после вакцинации, достоверно сокращает количество случаев респираторных инфекций у детей, ослабляет симптомы атопического дерматита, снижает риск развития кариеса [31–33]. Группой авторов проведено исследование, доказавшее способность L. rhamnosus GG положительно влиять на клинические исходы, проявлять наиболее характерные иммуномодулирующие эффекты (увеличение количества клеток, секретирующих иммуноглобулины), а также увеличивать продукцию специфического антиротавирусного секреторного IgA у младенцев и детей с ротавирусной инфекцией [31]. Та же группа исследователей сообщила, что иммуногенность антиротавирусной пероральной вакцины может быть увеличена при одновременном назначении L. rhamnosus GG [31]. Известно также, что пробиотическое действие штамма обусловлено наличием в структуре его ДНК иммуностимулирующих олигонуклеотидов, которая ингибировала in vitro IgE, что объясняет антиаллергическое действие L. rhamnosus.
На основании данных доказательной медицины, накопленных за последние годы, Европейское общество детских гастроэнтерологов, гепатологов и нутрициологов (ESPGHAN) совместно с Европейским обществом детских инфекционистов (ESPID) опубликовало руководство по тактике ведения детей с острым гастроэнтеритом на догоспитальном этапе, в котором указывается на целесообразность активной терапии пробиотиками совместно с оральной дегидратацией. При этом штамм L. rhamnosus GG имеет самую высокую степень рекомендаций (уровень доказательности – I, А) с оптимальной дозой >1×1010 КОЕ/сут. в течение 5–7 дней [34].
Штамм L. rhamnosus был выделен из кишечника здорового человека в 1985 г., и с этого времени собрано значительное количество доказательных подтверждений его положительного влияния на здоровье. С 1990 г. его активно используют в производстве продуктов функционального питания. Научный комитет EFSA присвоил L. rhamnosus GG статус QPS (Qualified Presumption of Safety – Квалифицированная презумпция безопасности). Управление по контролю продуктов питания и лекарственных средств США (FDA) признает L. rhamnosus одним из самых безопасных штаммов, используемых в питании детей раннего возраста. Клинические испытания показали, что благодаря исключительному профилю безопасности L. rhamnosus превышение дозы пробиотика не угрожает здоровью ребенка [34].
Технологические возможности фарминдустрии обеспечили возможность фиксированно комбинировать пробиотический штамм L. rhamnosus GG и олигофруктозу, что особенно важно в клинической практике. Последняя служит олигомером, подвергается микробной ферментативной обработке в верхних отделах толстой кишки, представляя собой специальный фактор для избирательного роста и функционирования сахаролитической кишечной флоры у детей [35, 36]. L. rhamnosus GG и олигофруктоза – взаимоусиливающие биологические факторы.
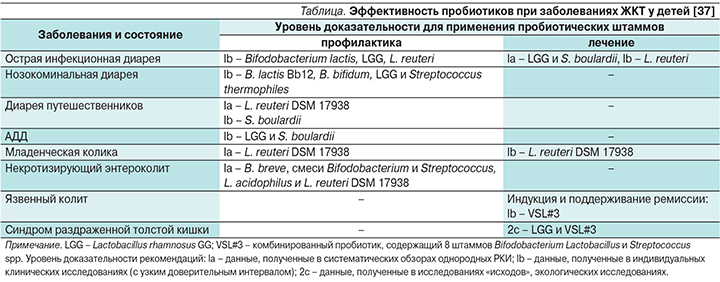
В отношении применения штамма L. rhamnosus GG, который имеет оригинальное происхождение, рабочей группой Йельского и Гарвадского университетов составлены обновленные рекомендации, отражающие прежде всего его функциональную активность в контексте адекватного управления основными компонентами ключевой микробиоты при различных заболеваниях [37] (см. таблицу). В крупных исследовательских центрах России проводятся клинические исследования с целью получения собственного опыта по использованию штамма L. rhamnosus GG в курации пациентов с разнообразной нозологией во время острого периода болезни и при выздоровлении. Обобщенными данными отечественных исследователей подтверждена достоверная эффективность штамма L. rhamnosus GG в коррекции дисбиотических изменений кишечника у детей всех возрастных групп, у больных с аллергическими, инфекционно-воспалительными заболеваниями и вторичными иммунодефицитными состояниями [38–43].
За последнее время опубликовано более 70 обзоров и мета-анализов, позволяющих провести обобщенный и детальный анализ терапевтической активности пробиотиков в лечении больных СРК [44, 45]. В мета-анализе 19 рандомизированных клинических исследований, включивших 1628 пациентов с СРК, подтверждена высокая эффективность этих препаратов. Степень рекомендаций 2а в отношении облегчения симптомов СРК определена для следующих пробиотических микроорганизмов: L. rhamnosus GG, Lactobacillus reuteri, Lactobacillus plantarum, Lactobacillus acidophilus, Bifidobacterium infantis, Bifidobacterium lactis, Streptococcus thermophilus, при этом обращается внимание на принадлежность их к разным таксономическим группам с штаммоспецифичными функциональными возможностями, которые необходимо учитывать при использовании [46].



