2010 г., по данным Российского Государственного регистра сахарного диабета (СД), число пациентов с СД 2 типа (СД2) превысило 3 млн. Благодаря результатам исследования UKPDS и последующего 10-летнего наблюдения необходимость раннего достижения и поддержания оптимального гликемического контроля у больных СД2 с целью профилактики развития и прогрессирования невропатии, микро- и макроваскулярных осложнений СД не вызывает сомнений [1, 2]. Однако подавляющее большинство больных диабетом в Российской Федерации, как показывают результаты программы “Диаконтроль” (И.И. Дедов, М.В. Шеста кова, Ю.И. Сунцов), находятся в состоянии хронической декомпенсации углеводного обмена (гликированный гемоглобин [HbA1c] > 7 %). Поэтому одной из приоритетных задач диабетологии является внедрение новых эффективных подходов к ведению пациентов с СД2, в частности раннее начало инсулинотерапии при неэффективности терапии пероральными сахароснижающими препаратами (ПССП), а также своевременная ее интенсификация [3].
Инсулин гларгин (Лантус) – аналог инсулина длительного действия, однократное введение которого обеспечивает базальный контроль гликемии в течение 24 часов. Беспиковый профиль действия инсулина гларгин позволяет максимально имитировать физиологическую базальную секрецию инсулина, что значительно снижает риск гипогликемии и вариабельность концентрации глюкозы в течение суток по сравнению с НПХ-инсулином. Кроме того, 24-часовая длительность действия инсулина гларгин позволяет вводить его 1 раз в сутки. Препарат вошел в мировую клиническую практику в 2000 г. Эффективность и безопасность применения инсулина гларгин у пациентов с СД2 были неоднократно подтверждены в контролируемых клинических исследованиях [4–10]. Однако результаты таких исследований вследствие жесткости их протоколов не могут быть экстраполированы на повседневную клиническую практику. Бóльшую ценность в плане получения информации о применении препаратов имеют наблюдательные программы, изучающие крупные когорты пациентов, получающих терапию этими медикаментами в повседневной жизни [11]. Это и послужило причиной проведения наблюдательной программы по применению инсулина гларгин в реальной клинической практике у больных СД2, не достигших компенсации в результате монотерапии метформином или производными сульфонилмочевины (ПСМ).
Основной целью этой наблюдательной программы была оценка эффективности и безопасности комбинированной терапии СД2 инсулином гларгин и метформином/ПСМ в повседневной клинической практике.
Материал и методы исследования
Дизайн программы
Открытая нерандомизированная многоцентровая наблюдательная программа, изучавшая эффективность и безопасность комбинированной терапии инсулином гларгин и ПССП (метформин/ПСМ) у пациентов с СД2; проводилась в стационарах и поликлиниках Российской Федерации при участии 370 врачей-эндокринологов. Длительность наблюдения составила 3 месяца, в течение которых было проведено 2 визита: исходный – включение в программу, и заключительный – через 3 месяца после начала терапии инсулином гларгин.
Критерии включения
В программу включали пациентов с СД2, соответствовавших следующим критериям:
• мужчины и женщины в возрасте старше 18 лет;
• монотерапия метформином или ПСМ;
• уровень HbA1c > 7 %;
• необходимость добавления инсулина гларгин к проводимой сахароснижающей терапии, по мнению лечащего врача;
• подписание информированного согласия.
После включения в программу к монотерапии метформином или ПСМ был добавлен инсулин гларгин в начальной дозе 10 МЕ. Поскольку программа была наблюдательной, врачи могли рекомендовать пациентам один из двух принятых алгоритмов титрации, описанных ниже [12]. Первый из них представлен в табл. 1.

Алгоритм 2. Начальная доза инсулина гларгин составляла 10 МЕ. Увеличение дозы инсулина гларгин на 2 МЕ производилось каждые 3 дня, если среднее значение гликемии натощак за эти дни превышало 5,5 ммоль/л.
В обоих алгоритмах дозу инсулина не увеличивали, если в течение предыдущей недели регистрировали снижение уровня гликемии натощак менее 4,0 ммоль/л. При развитии тяжелой гипогликемии или снижении уровня гликемии менее 3,1 ммоль/л в течение предыдущей недели доза инсулина уменьшалась на 2–4 MЕ/сут.
Статистический анализ
Для описания количественных переменных были использованы следующие статистические характеристики: среднее арифметическое значение, стандартное отклонение, медиана. Для описания качественных переменных были использованы частоты и проценты. В зависимости от характера распределения внутригрупповые изменения оценивались при помощи парного t-теста или критерия Вилкоксона. Сравнение групп по качественным признакам осуществлялось путем анализа таблиц сопряженности с использованием двустороннего точного критерия Фишера или критерия хи-квадрат. Статистически значимыми считали различия при р < 0,05.
Результаты
В программу были включены 2500 пациентов в СД2. Через 3 месяца данные 1855 больных были доступными для анализа эффективности, а данные 1856 пациентов – для анализа безопасности терапии (табл. 2). Остальные пациенты не были включены в окончательный анализ вследствие отсутствия или недостоверности данных, полученных на заключительном визите.
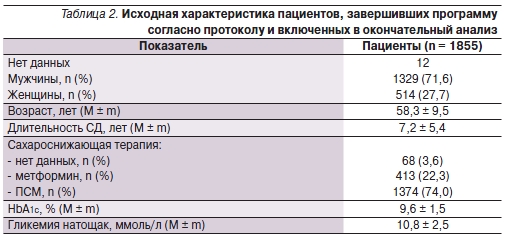
Анализ эффективности
При включении в программу средний уровень HbA1с составлял 9,6 ± 1,5 %, через 3 месяца после добавления к терапии ПССП инсулина гларгин отмечено статистически значимое снижение его уровня – до 7,5 ± 1,2 % (р < 0,001). Исходный уровень гликемии натощак составлял 10,8 ± 2,5 ммоль/л, через 3 месяца после начала терапии инсулином гларгин отмечено статистически значимое снижение ее уровня до 6,4 ± 1,2 ммоль/л (р < 0,001).
Вместе с тем клиническое значение имеет не только снижение уровней гликемии натощак само по себе, но и достижение целевых значений этих параметров. Через 3 месяца после добавления к терапии ПССП инсулина гларгин целевой уровень HbA1c < 7 % был достигнут практически у трети –
32,5 % (603 из 1855) пациентов, целевой уровень гликемии натощак < 5,6 ммоль/л – у 20,1 % (372 из 1855), целевые значения обоих параметров – у 10,5 % (194 из 1855).
При включении в программу стартовая доза инсулина гларгин составляла 10,0 МЕ. Через 3 месяца с момента включения в программу доза инсулина статистически значимо выросла – до 22,6 ± 9,0 МЕ (медиана 20,0 МЕ; р < 0,001). При этом не было найдено статистически значимых различий между
дозами инсулина гларгин у пациентов, достигших и не достигших целевых значений гликемии натощак и/или HbA1c.
Анализ безопасности
В течение 12 недель программы об испытанных гипогликемических эпизодах сообщили 17 % (1539/1855) пациентов. Бессимптомные гипогликемии были зарегистрированы у 6,3 % пациентов, о гипогликемических эпизодах, сопровождавшихся симптомами, сообщили 13,2 %, ночные гипогликемии испытали 1,4 % пациентов. При этом необходимо отметить, что большинство пациентов в течение 12 недель программы испытали лишь 1–2 эпизода легкой гипогликемии (рис. 1).
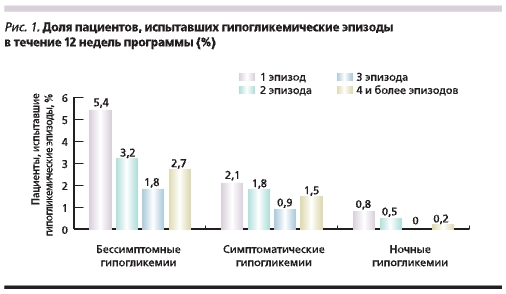
В течение 12 недель исследования был зарегистрирован 1 эпизод тяжелой гипогликемии.
Необходимо отметить, что доля пациентов, сообщивших об испытанных гипогликемиях, была одинаковой как в группе пациентов, достигших целевых уровней HbA1c и/или гликемии натощак, так и среди тех, кто не достиг компенсации углеводного обмена.
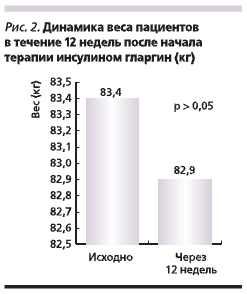
Вес пациентов в течение 12 недель после начала терапии инсулином гларгин не изменился (рис. 2).
Обсуждение результатов
В программе приняли участие 370 врачей-эндокринологов, работавших в обычных поликлиниках и стационарах Российской Федерации, которые в наблюдение включили в общей сложности 2500 пациентов, т. е. на 1 врача приходилось в среднем 6–7 больных СД2. Достаточный объем выборки
дает возможность экстраполировать полученные результаты на популяцию пациентов с СД2, у которых не удалось достичь компенсации углеводного обмена в результате монотерапии наиболее широко применяемыми ПССП – метформином и ПСМ.
Согласно Консенсусу ADA/EASD (2008), при неэффективности первого этапа лечения СД2 – модификации образа жизни и терапии метформином, что проявляется сохранением в течение 2–3 месяцев уровня HbA1c ≥ 7 %, рекомендован переход к следующему этапу: интенсификации сахароснижающей терапии. На втором этапе к метформину можно добавить базальный инсулин или ПСМ, охарактеризованные экспертами ADA/EASD как “хорошо подтвержденная базовая терапия” [3]. При этом выбор определяется уровнем HbA1c: если он превышает 8,5 %, целесообразно использовать инсулин как наиболее эффективный сахароснижающий препарат. Это объясняется тем, что чем выше уровень НbA1c, тем больший вклад в его значение вносит тощаковая гликемия, обусловленная повышением продукции глюкозы печенью [13]. Поэтому инициация инсулинотерапии путем добавления к ПССП именно базального инсулина несомненно оправданна с точки зрения патогенеза СД2: инсулин является самым мощным ингибитором глюконеогенеза в печени, и поэтому экзогенное введение базального инсулина в адекватной дозе способствует поддержанию нормогликемии натощак (концепция FIX FASTING FIRST). Это в свою очередь способствует снижению общего уровня постпрандиальной и постабсорбтивной гликемии в течение дня. Национальные алгоритмы оказания специализированной помощи (2009) также допускают назначение базального инсулина как второго этапа терапии при неэффективности монотерапии метформином или ПСМ [16]. Принимая во внимание, что у включенных в программу пациентов средний уровень НbA1c исходно составил 9,6 %, добавление к терапии именно базального инсулина было абсолютно оправданным.
В наблюдательной программе была подтверждена ранее продемонстрированная в контролируемых клинических исследованиях эффективность инсулина гларгин с точки зрения улучшения состояния углеводного обмена у пациентов с СД2, не достигших хорошего гликемического контроля
на фоне терапии ПССП, в сочетании с хорошим профилем безопасности. Доля пациентов, достигших целевого уровня HbA1c, в нашей программе была ниже – 32,8 %, чем в хорошо известных исследованиях Treat-To-Target, LANMET, AT LANTUS и др. [8, 10, 12]. Однако длительность нашего исследования составила 3 месяца, в то время как вышеупомянутые исследования продолжались 6–12 месяцев. Более того, среднее снижение уровня HbA1c за 3 месяца составило 2 %, гликемии натощак – 4,4 ммоль/л, т. е. улучшение гликемического контроля происходило достаточно быстрыми темпами, что не всегда оправданно, как показывают результаты исследования ACCORD [14, 15].
Средняя доза инсулина гларгин при завершении программы также была значительно ниже (22,6 ± 9,0 МЕ, медиана – 20,0 МЕ), чем в уже упомянутых исследованиях Treat-To-Target (средняя доза в конце исследования – 47 МЕ), LANMET (средняя доза в конце исследования – 68 МЕ), AT LANTUS (средняя доза при титрации врачами – 41 МЕ, при титрации пациентами – 45 МЕ). Это свидетельствует о необходимости продолжения адекватной титрации инсулина гларгин до достижения оптимального гликемического контроля, особенно с учетом низкой частоты возникновения гипогликемических эпизодов – одного из основных факторов, лимитирующих как инициацию, так и интенсификацию инсулинотерапии – во время исследования. Тем более что в нашей программе достижение целевых параметров гликемического контроля не привело к увеличению доли пациентов, испытавших гипогликемию.
Другим фактором, который лимитирует адекватную титрацию дозы инсулина, является страх врачей/пациентов перед увеличением веса, наиболее выраженным сразу после инициации инсулинотерапии. Надо отметить, что в нашей программе добавление инсулина гларгин к терапии метформином/ПСМ в течение 12 недель не привело к увеличению массы тела (82,9 против 83,4 кг исходно).
Выводы
1. Добавление инсулина гларгин к монотерапии метформином/ПСМ привело к улучшению гликемического контроля у пациентов с СД2.
2. Гипогликемические эпизоды в течение 3 месяцев после инициации терапии инсулином гларгин были зарегистрированы у 17 % пациентов, при этом большинство из них испытали лишь 1–2 эпизода.
3. В течение 3 месяцев после начала терапии инсулином гларгин масса тела не увеличивалась.



