Введение
Дисплазия соединительной ткани (ДСТ) – наследственные нарушения мультифакториальной природы, объединенные в синдромы и фенотипы на основе общности внешних и/или висцеральных признаков и характеризующиеся многообразием клинических проявлений: от доброкачественных субклинических форм до развития полиорганной и полисистемной патологии с прогредиентным течением. Диспластические изменения могут быть обусловленными и воздействием экзогенных факторов: неблагоприятной экологической обстановки, неадекватного питания и стрессов. В формировании ДСТ доказанной считается роль нарушений магниевого обмена в организме [1].
Частота пролапса митрального клапана (ПМК) как варианта ДСТ варьируется в популяции в пределах от 1,8 до 38 % в зависимости от метода обследования, используемых критериев диагностики и обследуемого контингента [2, 3]. Среди пациентов с ПМК преобладают женщины, особенно в возрасте 20–29 лет, у мужчин ПМК чаще отмечается в 30–39 лет.
Вопрос о развитии разнообразных серьезных осложнений среди больных ПМК крайне актуален, т. к. это лица молодого и трудоспособного возраста. Самым грозным осложнением является внезапная смерть, частота которой составляет 1,9 : 10000 [4]. Этот показатель намного меньше смертности от других сердечно-сосудистых заболеваний, но с учетом высокой распространенности ПМК в популяции данная проблема является чрезвычайно важной [5]. В большинстве случаев внезапная смерть связана с предшествующей желудочковой тахикардией или с острой левожелудочковой недостаточностью вследствие разрыва хорд [6]. К факторам риска внезапной смерти при ПМК относят женский пол, гемодинамически значимую митральную регургитацию III–IV степеней, удлинение интервала QT, нарушения реполяризации, ЭхоКГ-критерии миксоматозной дегенерации створок митрального клапана, наличие в анамнезе синкопе, а также случаи внезапной смерти среди родственников [7].
Следующее место по степени тяжести занимают различные неврологические осложнения, особенно такие опасные, как преходящие нарушения мозгового кровообращения и ишемические инсульты. Установлено, что при ПМК частота ишемического инсульта составляет 2–5 %, а транзиторные ишемические атаки выявляют среди 20 % больных [8]. С другой стороны, у больных с ишемическим инсультом ПМК был обнаружен в 8,4–38,0 % случаев [9].
Считается, что причиной неврологических осложнений ПМК является тромбоэмболия миксоматозно измененных створок митрального клапана, которая служит основой формирования микро- и макротромбов и/или изменения системы гемостаза [10].
У 3,6–6,0 % пациентов с ПМК развивается инфекционный эндокардит, вероятно связанный с миксоматозной дегенерацией пролабирующих створок митрального клапана [11].
Установлено, что выраженность клинической симптоматики у пациентов с ПМК помимо дисфункции вегетативной нервной системы (ВНС) зависит и от дефицита магния [12]. Отмечено, что дефицитом магния при ПМК обусловлены такие симптомы, как сердцебиение, боль в левой половине грудной клетки, парестезии и липотимия, выраженность которых существенно уменьшалась после лечения препаратами магния [13]. При ПМК гипомагниемия играет важную этиопатогенетическую роль в развитии аритмий сердца [14], особенно желудочковых экстрасистолий, и удлинении интервала QT [15], нейропсихических нарушений, утомляемости, депрессии [16], низкой толерантности к физической и эмоциональной нагрузке [14], тромбоэмболических осложнений [17]. В литературе имеются сведения о том, что дефицит магния способствует повышению уровня катехоламинов плазмы крови [18].
В настоящее время содержание магния определяют в биологических жидкостях (крови, моче), биопсийном материале (скелетной мускулатуре), волосах [19].
Термин “гипомагниемия” отражает уменьшение концентрации магния в плазме крови менее 0,7 ммоль/л [20]. Показано, что гипомагниемия у больных ПМК ассоциируется с повышенной экспрессией антигена Bw35 системы HLA, носители которого характеризуются патологическим ответом на вирус гриппа с низкой цитотоксичностью [21]. Отмечается обратно пропорциональная связь повышенного титра антител с концентрацией магния в эритроцитах. Доказано, что при ПМК на фоне дефицита магния повышена частота инфекционных заболеваний, возбудителем которых является Candida albicans [22]. Установлено, что наблюдаемый при ПМК дефицит магния приводит к повышению уровня гистамина в крови, обладающего иммуносупрессивным действием [23].
Материал и методы
В исследовании принял участие 31 пациент с ПМК, в т. ч. 18 мужчин (средний возраст – 39,4 ± 0,9 года) и 13 женщин (средний возраст – 38,9 ± 1,1 года), у которых выявлены выраженные фенотипические проявления ДСТ и которые в течение 15 лет регулярно принимали МагнеротR. Больные обследованы в начале исследования и через 15 лет наблюдения. Они предъявляли различные жалобы, при этом у них имелись симптомы, составляющие хотя бы 2 из 4 анализируемых синдромов (синдром вегетативной дистонии, сосудистые, геморрагические и психопатологические расстройства), и не менее 5 фенотипических маркеров ДСТ (повышенная растяжимость кожи, сколиоз, астенический тип конституции, воронкообразная деформация грудной клетки, признак большого пальца, синдром гипермобильности суставов, продольное и поперечное плоскостопие, признак запястья, миопия).
Критериями включения служили ранее диагностированный ПМК, понимание пациентом сути предстоящего исследования, наличие нарушений ритма, наличие артериальной гипертензии I стадии, I и II степеней, добровольное информированное согласие на участие в исследовании.
У всех пациентов после клиникоинструментального обследования исключены органические заболевания внутренних органов, такие как ишемическая болезнь сердца, некоронарогенные заболевания сердца (миокардиты, миокардиодистрофии, кардиомиопатии), заболевания щитовидной железы.
Всем пациентам проведено комплексное клинико-инструментальное обследование, включившее определение фенотипических особенностей с использованием модифицированной фенотипической карты M.J. Glesby, клиническое обследование с использование оригинальной клинической карты; выполнены ЭхоКГ в одно- и двухмерном режимах c cинхронной записью ЭКГ, ЭКГ покоя в 12 стандартных отведениях с оценкой по стандартным критериям, суточное мониторирование ЭКГ, суточное мониторирование артериального давления (АД), исследование вариабельности ритма сердца, оценка качества жизни методом самооценки обследуемых по шкалам VAS (Visual Analog Scale – Шкала визуальных аналогий) и DISS (Disability Scale – Шкала недееспособности). Эффективность фармакотерапии каждого пациента оценивали как клинически значимую при уменьшении степени тяжести анализируемых параметров (в баллах) на 50 % и более от исходного уровня.
Исследование проведено в ГКБ № 40 (главный врач – д.м.н., профессор – А.Я. Самохин), являющейся клинической базой кафедры госпитальной терапии № 1 лечебного факультета МГМСУ.
Пациенты получали МагнеротR (магния оротат) в таблетках по 500 мг (32,8 мг элементарного Mg) 3 раза в день (97,4 мг элементарного Mg) в течение всего периода наблюдения 2 раза в год (продолжительность курса – 3 месяца). Другой постоянной кардиальной и метаболической терапии не проводилось.
Статистическую обработку полученных результатов осуществляли после создания компьютерных баз данных с помощью программы “Microsoft Office Exele 2007”. Для проведения статистического анализа данных использован пакет программ “Biostat 4.0” и “Microsoft Office Exele 2007”. Для проверки гипотезы о нормальном распределении применены показатели медианы, моды, асимметрии и эксцесса.
Результаты
Длительное наблюдение за пациентами продемонстрировало четкую положительную динамику, проявленную как улучшением общего состояния и самочувствия, так и изменениями конкретных симптомов и синдромов, подтвержденных различными субъективными и объективными показателями.
Одной из частых жалоб, причиняющих много неудобств и вызывающих серьезную озабоченность пациентов, являются кардиалгии, которые имеют самые разнообразные формы и продолжительность. После терапии число больных с кардиалгиями уменьшилось более чем в 3 раза – с 96,8 до 32,2 %, в т. ч. с колющими болями в левой половине грудной клетки с 58,1 до 22,6 %. Установлено достоверное уменьшение числа лиц с частыми кардиалгиями. Было также отмечено достоверное уменьшение частоты всех клинических симптомов СВД, в т. ч. Вегетативных кризов, в 2,5 раза – с 64,5 до 25,8 %. До лечения кардиалгии более одного раза в неделю наблюдались среди 32,2 % пациентов, от одного раза в неделю до одного раза в месяц – у 54,8 % и от одного раза в месяц до одного раза в полгода – у 13,0 %. После терапии боли в левой половине грудной клетки у всех больных возникали не чаще одного раза в месяц.
Частота болей в грудном и поясничном отделах позвоночника на фоне применения МагнеротаR достоверно уменьшилась более чем в 2 раза. Кроме того, отмечено положительное влияние МагнеротаR на расстройства со стороны желудочно-кишечного тракта, психогенную дизурию, нарушения терморегуляции.
Достоверно снизились и частота, а также степень тяжести всех сосудистых нарушений: утренней головной боли – с 48,4 до 12,9 %, липотимии – с 64,5 до 29,0 %, мигрени и головной боли напряжения – с 25,8 до 0 % и с 71,0 до 32,2 % соответственно, сосудистых нарушений в конечностях – с 83,9 до 45,2 % и головокружений – с 77,4 до 45,2 %. Клинически значимое ослабление выраженности синдрома сосудистых нарушений отмечено среди 67,7 % больных с ПМК. При этом в 3 раза увеличилось число лиц с легкой степенью тяжести синдрома, а тяжелая его степень не выявлена.
Синкопальные состояния были представлены обмороками с нейрогенным и ортостатическим механизмом, причем последние встречались в 1,5 раза реже. К концу наблюдения ортостатические и нейрогенные синкопе выявлены с той же частотой, что и до лечения.
У пациентов с ПМК имелись выраженные проявления геморрагического синдрома: носовые кровотечения, склонность к возникновению кожных геморрагий, кровоточивость десен, длительные и/или обильные менструации. После лечения установлено достоверное уменьшение тяжести этого синдрома.
При оценке клинической картины в целом следует отметить достоверное снижение степени ее тяжести после лечения. Число лиц с низкой степенью тяжести состояния увеличилось в 7 раз, а тяжелая степень не была выявлена ни у одного пациента. Таким образом, оценивая влияние терапии препаратом магния на симптоматику и степень тяжести клинических проявлений у больных ПМК с выраженными фенотипическими признаками, необходимо подчеркнуть достоверное улучшение общего состояния пациентов, уменьшение частоты и степени тяжести всех клинических синдромов и симптомов заболевания. Клинически значимая эффективность применения МагнеротаR зарегистрирована среди 67,7 % пациентов.
При проведении исходной ЭхоКГ у 80,7 % пациентов была обнаружена 1-я, у 19,3 % – 2-я степени пролабирования митрального клапана (табл. 1). После терапии МагнеротомR отмечено достоверное уменьшение глубины пролабирования и степени митральной регургитации. Число лиц с миксоматозной дегенерацией, регургитацией I и II степеней сократилось, также отмечено уменьшение размеров левого предсердия.
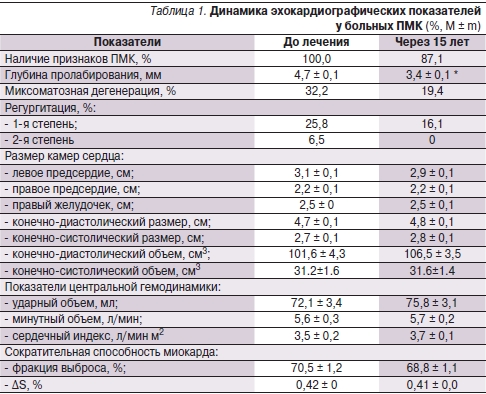
* р < 0,05.
После терапии у пациентов отмечено достоверное уменьшение средней и максимальной частоты сердечных сокращений (ЧСС), количества эпизодов тахикардии, приступов наджелудочковой экстрасистолии (НЖЭ), желудочковой экстрасистолии (ЖЭ) в течение суток, а также частоты приступов пароксизмальной наджелудочковой тахикардии (ПНЖТ) и синдрома ранней реполяризации желудочков (СРРЖ) (табл. 2).
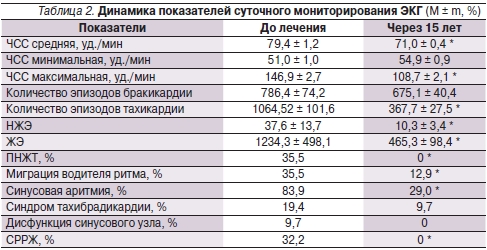
* р < 0,05
Среди больных ПМК после лечения отмечено также достоверное уменьшение максимального систолического и диастолического АД, нагрузки АД и повышенной вариабельности систолического и диастолического АД за сутки (табл. 3). После регулярного приема МагнеротаR выявлено отсутствие больных с артериальной гипертензией и нарушениями суточного профиля АД.
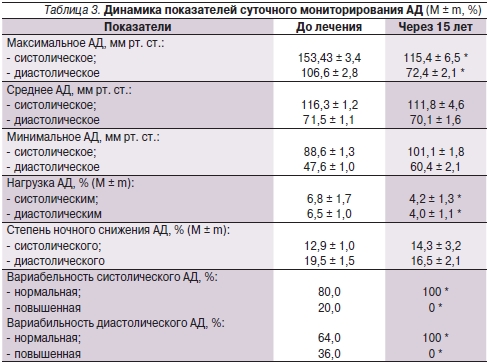
* p < 0,05.
На фоне регулярного приема МагнеротаR среди пациентов с ПМК отмечено достоверное увеличение тонуса парасимпатического (Δ % HF) и уменьшение тонуса симпатического (LF/HF) отделов ВНС. В ходе лечения число лиц с преобладанием симпатического отдела ВНС уменьшилось в 6 раз, парасимпатического – увеличилось в 2 раза, а количество пациентов с равным тонусом обоих отделов увеличилось в 4 раза. При длительном приеме МагнеротаR у всех пациентов выявлен равный тонус обоих отделов ВНС.
С целью изучения качества жизни больных проведено его исследование с помощью самооценки методом визуальных аналогий (VAS) в группе пациентов с ПМК и в контрольной группе здоровых лиц. В контрольной группе качество жизни составляло 80,0 ± 6,6 мм по шкале VAS. Среди пациентов с ПМК исходно определялось статистически значимо более низкое качество жизни – 59,6 ± 2,6 мм по шкале VAS. После регулярного длительного приема МагнеротаR самооценка больными качества жизни достоверно повысилась. Клинически значимое улучшение самочувствия не менее чем на 50 % от исходного уровня отмечено у 29,0 % пациентов, а на 25–50 % – еще у 35,5 % больных.
Кроме того, качество жизни всех пациентов изучалось по шкалам DISS. По шкале DISS/работа до лечения нарушения отсутствовали в 6,5 % случаев, минимальные нарушения (1–3 балла) отмечены у 51,6 % пациентов, умеренные (4–6 баллов) – у 32,2 % и тяжелые (7–10 баллов) – у 9,7 %, причем минимальные и тяжелые нарушения чаще определялись у женщин. В результате проведенной терапии наблюдалась достоверная положительная динамика: нарушения не выявлены у 25,8 % пациентов, их легкая степень установлена у 64,5 % больных, средняя – у 9,7 %, а тяжелая степень не выявлена вообще.
По шкале DISS/социальная жизнь исходно нарушений не отмечено в 12,9 % случаев, легкие нарушения имелись у 48,4 % больных, средней тяжести – у 35,5 % и тяжелые – у 3,2 %. После лечения число благополучных пациентов по этой шкале увеличилось до 29,0 %, минимальные изменения отмечены у 54,8 % пациентов, средней тяжести – у 16,2 %, тяжелые нарушения обнаружены не были.
Нарушения по шкале DISS/личная жизнь до лечения не отсутствовали у 16,1 % пациентов, легкие, средние и тяжелые нарушения отмечены у 35,5, 32,2 и 16,1 % больных соответственно. На фоне терапии число пациентов без нарушений и минимальными нарушениями возросло до 25,8 и 67,7 % соответственно, с нарушениями средней тяжести уменьшилось до 6,5 %, тяжелые нарушения не выявлены.
Достоверно по всем шкалам DISS снизилось и среднее количество баллов, причем максимальное снижение наблюдалось по шкале DISS/работа.
В целом полное или почти полное исчезновение симптомов заболевания в результате лечения МагнеротомR выявлено в 51,6 % случаев, частичное – в 35,5 % и незначительное улучшение – в 12,9 %. Побочные явления при применении МагнеротаR отсутствовали.
Заключение
Результаты проведенного исследования позволяют сделать вывод о высокой эффективности длительного и регулярного применения препарата МагнеротR в отношении большинства клинических проявлений у пациентов с ПМК. Клинически значимая эффективность МагнеротаR зарегистрирована среди 67,7 % больных.
Кроме того, у пациентов, лечившихся МагнеротомR, продемонстрировано достоверное изменение ЭхоКГ-параметров, свидетельствующее о положительном влиянии Mg на проявления ДСТ: уменьшение глубины пролабирования митрального клапана, степени митральной регургитации, размера левого предсердия и частоты миксоматозной дегенерации створок клапана. Увеличилось число пациентов с эукинетическим типом центральной гемодинамики, уменьшилось – с гипокинетическим и гиперкинетическим типами.
При изучении показателей мониторирования ЭКГ показано, что длительный прием МагнеротаR приводил к достоверному уменьшению средней и максимальной ЧСС, количества эпизодов тахикардии, частоты развития ПНЖТ, НЖЭ и ЖЭ. Зарегистрировано достоверное снижение максимального систолического и диастолического АД, нагрузки АД и повышенной вариабельности АД. Данные ретроспективного анализа показали абсолютную нормализацию АД у всех обследованных пациентов.
Существенное значение имеет тот факт, что регулярное применение МагнеротаR способствовало достоверному повышению качества жизни больных ПМК по параметрам работы, социальной и личной жизни.



