Введение
С момента появления в арсенале практических врачей первого представителя класса макролидных антибиотиков эритромицина (1952) макролиды заняли одно из ведущих мест в терапии инфекций дыхательных путей (ИДП) [1]. «Популярность» данного класса антимикробных препаратов объясняется высокой активностью в отношении большинства потенциальных возбудителей респираторных инфекций, включая «атипичные» микроорганизмы Mycoplasma spp., Chlamydophila spp. и Legionella spp., привлекательными фармакокинетическими/фармакодинамическими характеристиками, высоким профилем безопасности и рядом неантибактериальных свойств (противовоспалительный, иммуномодулирущий эффекты), изучение которых приоткрывает новые возможности применения данных антибиотиков в клинической практике.
Стоит отметить, что родоначальник макролидов – эритромицин, на протяжении десятилетий оставался единственным представителем данного класса, однако со временем ряд несоответствий современным потребностям (низкая биодоступность, высокая частота гастроинтестинальных нежелательных реакций, быстрая элиминация, требующая частого повторного приема препарата, высокая частота клинически значимых лекарственных взаимодействий [2, 3]) потребовали создания новых препаратов с улучшенными фармакологическими характеристиками (см. рисунок). В настоящее время в клинической практике применяется более 20 макролидных антибиотиков и их производных. По происхождению макролиды подразделяются на природные, полусинтетические и пролекарства [4, 5]. Основу всех макролидов составляет макроциклическое лактонное кольцо, связанное с одним или несколькими углеводными остатками. В зависимости от числа атомов углерода макролидные антибиотики подразделяются на 14-членные (природные – эритромицин, олеандомицин; полусинтетические – рокситромицин, кларитромицин, диритромицин), 15-членные полусинтетические ([азалиды] – азитромицин) и 16-членные (природные – спирамицин, джозамицин, мидекамицин; полусинтетические – рокитамицин, мидекамицина ацетат) [5].
Возвращаясь к историческим вехам, можно отметить, что изначально наиболее активные усилия фармацевтических компаний были направлены на создание производных эритромицина А, итогом которых стала разработка компанией Roussel Uclaf (Франция) первого полусинтетического 14-членного макролида рокситромицина.
С 1987 г. этот препарат применяется в лечении различных инфекций [6, 7]. Благодаря своей химической структуре рокситромицин (эритромицин-9-О-2-метокси-этокси-метил оксим) обладает рядом принципиальных отличий от эритромицина в виде высокой кислотоустойчивости, улучшенных фармакокинетических/фармакодинамических показателей, лучшей переносимости.
Механизм действия и фармакодинамика
Механизм действия всех макролидных антибиотиков связан с нарушением синтеза белка на этапе трансляции в клетках чувствительных микроорганизмов. Антибиотики обратимо связываются с каталитическим пептидилтрансферазным центром 50S субъединицы бактериальной рибосомы, в результате ингибируются реакции транслокации и транспептидации, что ведет к остановке процесса формирования и наращивания пептидной цепи [5]. 14- и 16-членные макролиды отличаются по особенностям связывания с различными доменами пептидилтрансферазного центра. Установлено, что аффинитет к участку связывания у рокситромицина меньше, чем у эритромицина, однако этот «недостаток» компенсируется более высокими концентрациями препарата в тканях и жидкостях организма, которые достигаются благодаря улучшенным параметрам его абсорбции и распределения [8]. Характер антимикробного действия макролидов в большинстве случаев бактериостатический, однако в высоких концентрациях (в 2–4 раза превышающих минимальную подавляющую концентрацию [МПК]) макролиды могут оказывать бактерицидное действие на Streptococcus pneumoniae, S. pyogenes и ряд других микроорганизмов.
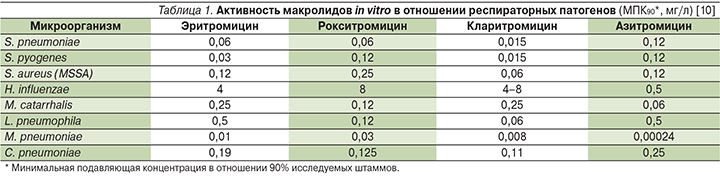
Рокситромицин активен в отношении S. pneumoniae, S. pyogenes (табл. 1), Moraxella catarrhalis. В отношении Haemophilus influenzae активность ниже, чем у других макролидов. Рокситромицин высокоактивен в отношении внутриклеточных патогенов – M. pneumoniae, C. pneumoniae и Legionella spp. Равно, как и другие представители данного класса, рокситромицин не активен в отношении грамотрицательных микроорганизмов – Enterobacteriaceae, Pseudomonas spp. и Acinetobacter spp. [9].
Рокситромицин обладает постантибиотическим1 эффектом в отношении таких возбудителей, как S. pneumoniae, S. aureus и S. pyogenes [11], однако его длительность сопоставима с таковой у эритромицина и меньше, чем у 16-членных макролидов (джозамицин, спирамицин) [12]. Рокситромицину присущ также постантибиотический суб-МПК-эффект2, благодаря которому антибиотик способен снижать степень вирулентности ряда микроорганизмов [13]. В частности, известно, что в условиях влияния субингибирующих концентраций рокситромицина тормозится выработка коагулазы, лецитиназы, дезоксирибонуклеазы и β-гемолизина S. aureus и S. pneumoniae, ингибируется образование биопленок P. aeruginosa [14–16].
Фармакокинетика
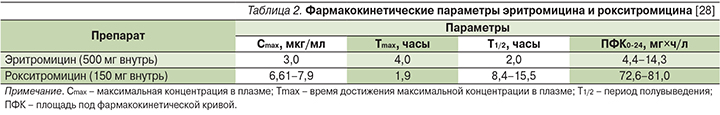
Рокситромицин более устойчив, чем эритромицин, к действию соляной кислоты, лучше и быстрее всасывается в желудочно-кишечном тракте, тем самым обусловливая высокие показатели биодоступности препарата при приеме внутрь. Пища, как правило, не влияет на полноту абсорбции, но может замедлять ее скорость [17]. Важнейшим отличием рокситромицина от других макролидов является тот факт, что препарат способен создавать высокие и стабильные концентрации не только в тканях и жидкостях организма, но и в сыворотке крови [18–20]. Так, при пероральном приеме 150 мг рокситромицина максимальная концентрация в плазме (Cmax) достигается через 2 часа, составляя в среднем 6,6–7,9 мг/л. Степень связывания с белками плазмы высокая – порядка 96%. Также высокие концентрации, сопоставимые с уровнем в плазме и превышающие МПК90 для чувствительных микроорганизмов, создаются в слюне, миндалинах, легких, придаточных пазухах носа, слезной жидкости, предстательной железе, миометрии, эндометрии, синовиальной жидкости, коже [21]. Рокситромицин способен аккумулироваться в нейтрофилах [22, 23], при этом соотношение концентраций антибиотика в цитоплазме клеток и внеклеточной жидкости составляет 21,9 (тогда как у эритромицина – 6,6). Накопление рокситромицина отмечается также и в альвеолярных макрофагах [24]. Фармакокинетические параметры рокситромицина представлены в табл. 2.
В организме рокситромицин почти не подвергается биотрансформации; более половины активного вещества выделяется через желудочно-кишечный тракт, 10–12% – с мочой, до 15% препарата элиминируется через легкие [25]. В метаболизированном виде выводится не более 5% введенной дозы. Период полувыведения у взрослых в среднем составляет 8–10 часов и может увеличиваться до 15 часов при выраженной почечной недостаточности (клиренс креатинина <10 мл/мин), но коррекции дозы в этом случае не требуется, как и пациентам, находящимся на диализе [26]. Напротив, у больных циррозом печени период полувыведения увеличивается, что требует снижения дозы препарата [27]. Длительный период полувыведения, позволяющий принимать рокситромицин 1 раз в сутки, безусловно удобен для пациента, что сопровождается высокой комплаентностью терапии.
Неантимикробное действие
Равно как и другие макролиды, рокситромицин оказывает влияние на нейтрофилы, усиливая фагоцитоз и киллинг микроорганизмов, ингибирует окислительный «взрыв» (макролиды снижают образование высокоактивных соединений кислорода – окись азота, способных повреждать клетки и ткани) [29–33]. Противовоспалительный эффект связан с антиоксидантными свойствами рокситромицина и его способностью ингибировать синтез ряда прововоспалительных цитокинов (интерлейкин-1, -6, -8, фактор некроза опухоли – TNF-α), простагландинов и, напротив, усиливать секрецию противовоспалительных цитокинов (интерлейкины -2, -4, -10) [34–36], при этом в экспериментальных исследованиях установлено, что по выраженности противовоспалительного эффекта он превосходит кларитромицин и азитромицин [37].
Нежелательные лекарственные реакции
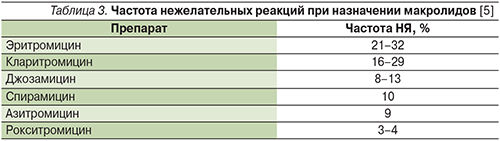
В настоящее время макролидные антибиотики являются одними из наиболее безопасных антибактериальных средств. При этом внутри группы рокситромицин отличается наилучшей переносимостью (табл. 3). Нежелательные реакции развиваются лишь у 3–4% пациентов, причем в 75–80% случаев они связаны с незначительными явлениями со стороны желудочно-кишечного тракта (боли в эпигастральной области, тошнота, диарея) [20]. Хорошая переносимость рокситромицина, вероятнее всего, связана с меньшим по сравнению с эритромицином стимулирующим влиянием на моторику желудка и кишечника [38, 39]. Кроме того, отмечено, что рокситромицин оказывает менее выраженное, чем эритромицин, влияние на кишечную флору [40].
К редким нежелательным реакциям относятся головные боли, головокружения, лимфопения, эозинофилия, обратимые изменения со стороны печеночных трансаминаз и глюкозы сыворотки крови; аллергических реакций практически не наблюдается [41]. Также описаны редкие случаи холестатического и острого гепатита [42, 43].
Рокситромицин в меньшей степени, чем эритромицин, угнетает цитохромР450, поэтому его взаимодействие с препаратами, метаболизирующимися в печени при участии микросомальных ферментов, менее вероятно. В частности, не выявлено клинически значимого взаимодействия данного антибиотика с карбамазепином, варфарином, дизопирамидом, оральными контрацептивами. В отношении таких препаратов, как циклоспорин, теофиллин, мидазолам, триазолам, известно, что рокситромицин может увеличивать их концентрацию в крови [5].
Резистентность к макролидам возбудителей инфекций дыхательных путей
Наиболее распространенным механизмом устойчивости к макролидам является модификация мишени действия антибиотиков. В процессе реализации этого механизма резистентности в микробной клетке под действием метилазы (аденозин-N-метилтрансферазы) происходит диметилирование пептидил-трансферазы 23S-субъединицы рРНК, обеспечивающей посттрансляционные информационные изменения в 50S-субъединице рибосомы. В свою очередь модификация локуса связывания макролидов приводит к снижению сродства к антибиотикам [44]. У таких микроорганизмов, как S. pneumoniae, H. pylory, B. Pertussis, Mycobacterium spp., Propionobacterium spp., ответственными за модификацию мишени действия являются точечные мутации в генах, кодирующих синтез рибосомальных белков. Этот механизм обусловливает формирование разнообразных комбинаций устойчивости (MLSв, ML-фенотип и др.) [45].
Еще одним механизмом формирования резистентности к макролидам является активное выведение (эффлюкс) антибиотика из микробной клетки. Данный механизм определяется способностью большинства грамположительных бактерий синтезировать белок, присоединяющийся к макролидам и способствующий их выведению из бактериальной клетки (М-фенотип резистентности). Следует отметить, что выведенными из микробной клетки могут быть лишь 14- и 15-членные макролиды, соответственно, чувствительность к 16-членным макролидам, линкозамидам и стрептограмину В сохраняется. Данный тип резистентности нередко преодолевается высокими концентрациями антибиотиков.
Наименьшее клиническое значение имеет ферментативная инактивация макролидов (эстеразы и фосфотрансферазы, способные расщеплять лактонное кольцо антибиотиков, могут вырабатывать некоторые энтеробактерии, S. aureus). В настоящее время наиболее актуальна проблема распространения резистентности к макролидам среди пневмококков. Частота выделения S. pneumoniae, устойчивых к макролидам, в ряде стран достигает 80% [46]. По российским данным, в 2015 г. резистентные к азитромицину и кларитромицину штаммы S. pneumoniae встречались в 23,3 и 22,8% соответственно [47]. В отношении М. catarrhalis, M. pneumoniae, C. pneumoniae и L. pneumophila значимого уровня резистентности к макролидам не зарегистрировано.
Эффективность рокситромицина в лечении ИДП
Результаты контролируемых клинических исследований свидетельствуют о высокой эффективности рокситромицина в лечении ИДП.
В частности, терапия рокситромицином vs. амоксициллином/клавуланатом острого бактериального синусита была эффективной для 93,1 и 88,8% больных соответственно [49]. При этом в группе, получавшей рокситромицин, побочные реакции со стороны желудочно-кишечного тракта наблюдались в 3,4% случаев, в то время как у пациентов, получавших амоксициллин/клавуланат, нежелательные явления зарегистрированы у каждого четвертого (25,9%) больного. Эффективность рокситромицина (300 мг 1 раз в сутки) по сравнению с амоксициллином/клавуланатом (1,0 г 2 раза в сутки) изучалась в исследовании Mira и соавт., 2001, у пациентов с острым средним отитом (85%), тонзиллофарингитом (31%) и бактериальным риносинуситом (11%). Оказалось, что суммарная эффективность лечения рокситромицином составила 82%, а амоксициллином/клавуланатом – 78% [50]. Опять-таки сравнимая с амоксициллином/клавуланатом эффективность рокситромицина (96 и 95% соответственно) была продемонстрирована и в многоцентровом исследовании пациентов (n=96) с инфекциями верхних и нижних дыхательных путей [51]. Переносимость терапии в группе рокситромицина была достоверно лучше.
В другом исследовании эффективность рокситромицина в терапии острого среднего отита, тонзиллофарингита и риносинусита превосходила таковую кларитромицина, при этом в группе рокситромицина наблюдалось меньшее число нежелательных реакций [52]. Согласно данным еще одного исследования, рокситромицин по эффективности не отличается от амоксициллина/клавуланата при респираторных инфекциях различной локализации, но, как правило, лучше переносится [53]. В терапии инфекций нижних дыхательных путей рокситромицин (150 мг 2 раза в день) продемонстрировал сравнимую эффективность с эритромицином (500 мг 2 раза в день), при этом его применение характеризовалось меньшим числом НЯ [54].

В другом сравнительном исследовании (n=60; рокситромицин [300 мг 1 раз в день] против кларитромицина [500 мг 2 раза в день]) у больных инфекциями нижних дыхательных путей оба режима терапии показали сравнимую эффективность, однако терапия рокситромицином сопровождалась достоверно лучшей переносимостью и комплаентностью [55].
В крупном международном многоцентровом исследовании, включившем 40 тыс. пациентов с инфекциями верхних и нижних дыхательных путей, эффективность рокситромицина в лечении пневмонии и обострений хронического бронхита составила 94 и 95% соответственно. Терапия рокситромицином острого синусита была эффективной в 97% случаев, фарингита – в 96% и острого среднего отита – также в 96%, при этом обращает на себя внимание, что НЯ были зарегистрированы лишь у 4% больных, причем в большинстве случаев речь шла о нетяжелых реакциях со стороны желудочно-кишечного тракта [56].
Эффективность и хорошая переносимость рокситромицина больными внебольничной пневмонией были показаны и в сравнительном исследовании с цефиксимом [57]. Клиническая эффективность рокситромицина в лечении «атипичной» внебольничной пневмонии сопоставима с таковой при использовании азитромицина и кларитромицина [58–60]. Несмотря на невысокую активность рокситромицина в отношении H. influenzae, его клиническая эффективность для пациентов с респираторными инфекциями, вызванными данным микроорганизмом, составляет, по данным мета-анализа, порядка 80% [61]. Так, согласно результатам исследований, известно, что эффективность рокситромицина при лечении пациентов с обострением хронического бронхита составляет от 83 до 95%, не уступая другим применяемым при данном заболевании антибиотикам (амоксициллин, амоксициллин/клавуланат, цефаклор, доксициклин, эритромицн, азитромицин, моксифлоксацин) [62, 63].
Интересными представляются данные о фармакоэкономической привлекательности рокситромицина по сравнению с амоксициллином/клавуланатом в терапии инфекций нижних дыхательных путей [64]. В другом фармакоэкономическом исследовании применение рокситромицина при инфекциях нижних дыхательных путей характеризовалось лучшим показателем «затраты–эффективность» по сравнению с цефаклором [65].
Перспективным направлением является изучение противовоспалительных и иммуномодулирующих свойств рокситромицина и их практическое приложение в клинической практике. Так, в настоящее время имеются многочисленные доказательства этиопатогенетической взаимосвязи между бронхиальной астмой и хронической C. pneumoniae-инфекцией [66], при этом достоверно известно, что порядка 5–30% всех обострений бронхиальной астмы связано с инфекцией, вызванной C. pneumoniae и M. pneumoniae. Применение рокситромицина при бронхиальной астме основывается на результатах ряда исследований.
В двойном слепом плацебо-контролируемом исследовании больных астмой, имевших серологически подтвержденную инфекцию C. pneumoniae, выявлен хороший клинический эффект рокситромицина, применяемого по 150 мг 2 раза в день в течение 6 недель [67], в других исследованиях подобный эффект рокситромицина также был подтвержден [68–71]. Определенные перспективы связаны с применением макролидов при таких заболеваниях, как саркоидоз, в связи с наличием данных, согласно которым у больных с острыми проявлениями заболевания (артрит, иридоциклит, кожные поражения), высоким титром антител к C. pneumoniae и неэффективностью глюкокортикоидов при назначении макролидов отмечено значительное клиническое улучшение [72]. Таким образом, дальнейшие перспективы применения макролидных антибиотиков связаны в первую очередь с изучением роли внутриклеточных возбудителей в патогенезе ряда заболеваний и клиническим приложением их неантибактериальных эффектов.
Клиническое применение рокситромицина в пульмонологической практике
Внебольничная пневмония
Наряду с другими «новыми» макролидами (азитромицин, кларитромицин) рокситромицин может использоваться при лечении амбулаторных пациентов с внебольничной пневмонией в случае непереносимости бета-лактамных антибиотиков (табл. 4) [73]. Также при подозрении на «атипичную» этиологию заболевания (M. pneumoniae, C. pneumoniae) макролидам отдается предпочтение.
Стоит заметить, что частота выделения M. pneumoniae, C. pneumoniae при нетяжелой ВП достаточно высока – 8–30%. M. pneumoniae является частым возбудителем ВП в группе пациентов с лёгким течением заболевания, нередко выделяется у лиц в возрасте до 40 лет (наиболее часто в возрасте до 20 лет), кроме того, данный возбудитель значится ведущим агентом ВП у детей от 5 до 15 лет. Micoplasma pneumoniae является одним из наиболее частых «атипичных» возбудителей ВП, передающихся воздушно-капельным путем при непосредственном контакте с инфицированными лицами, особенно внутри изолированных коллективов (военнослужащие, студенты, школьники, семья). Клинические проявления микоплазменной ВП включают лихорадку (для начальной стадии заболевания обычно характерен субфебрилитет), признаки интоксикации (головная боль, миалгия, общая слабость) и наиболее частым симптомом является сухой кашель, зачастую приступообразный, навязчивый, мучительный для пациента. C. pneumoniae является весьма распространенным внутриклеточным бактериальным патогеном, тропным прежде всего к воздухоносным путям и легочной ткани. По результатам исследований с возрастом наблюдается рост числа лиц, инфицированных C. pneumoniae, при этом серопозитивными чаще оказываются мужчины (55–76%), нежели женщины (40–68%) [74]. Для ВП, вызванной C. pneumoniae, характерны подострое начало, симптомы фарингита (гиперемия зева, боль при глотании), часто сопровождающиеся осиплостью голоса (ларингит – отличительный признак C. pneumoniae-инфекции); длительный, малопродуктивный кашель. Также C. pneumoniae-инфекция может проявляться в дебюте свистящим дыхнием на фоне бронхообструктивного синдрома. Рентгенологическая картина характеризуется мелкоочаговой, нередко многофокусной инфильтрацией, без образования плеврального выпота или полостей в легком. Воспалительные изменения в периферической крови часто отсутствуют [74].
Таким образом, необходимо отметить, что, хотя на основании данных анамнеза (вспышка пневмонии в семье, закрытом коллективе) и клинико-лабораторных данных точная этиологическая диагностика внебольничной пневмонии сомнительна, определенные клинические признаки все же характерны для заболевания, вызванного хламидиями или микоплазмой.
К ним относятся постепенное (в течение 3–7 дней) начало, дебют заболевания с симптоматикой поражения верхних дыхательных путей, непродуктивный кашель, внелегочная симптоматика – миалгии, артралгии, головная боль, диарея. Антибиотиками, активными в отношении микоплазменной и хламидийной инфекции, являются макролиды и «респираторные» фторхинолоны. Продолжительность терапии в случае указания на «атипичную» этиологию ВП должна составлять 14 дней.
Пациентам, получавшим в последние 3 месяца антибактериальные препараты и/или при наличии сопутствующих заболеваний (хроническая обструктивная болезнь легких, сахарный диабет, застойная сердечная недостаточность, заболевания печени, злоупотребление алкоголем, наркомания, дефицит массы тела), рекомендуется проведение комбинированной терапии – «защищенный» аминопенициллин±макролид (азитромицин, кларитромицин, рокситромицин, джозамицин, спирамицин) либо монотерапия «респираторным» фторхинолоном.
Госпитализированным в отделение общего профиля пациентам с внебольничной пневмонией рекомендуется парентеральное применение β-лактамов (ампициллин, амоксициллин/клавуланат, цефотаксим, цефтриаксон) в комбинации с макролидом для приема внутрь. Доказано, что наличие в стартовом режиме терапии препарата, активного в отношении «атипичных» микроорганизмов, улучшает прогноз и сокращает продолжительность пребывания пациентов в стационаре. Для лечения тяжелых форм ВП в условиях отделения реанимации и интенсивной терапии необходимо назначать цефалоспорины III поколения или «ингибиторозащищенные» пенициллины внутривенно в обязательной комбинации с макролидом для внутривенного применения (азитромицин, кларитромицин, эритромицин).
Острый бронхит, вызванный Bordetella pertussis (коклюш)
В этиологии острого бронхита преимущественное значение (>90%) занимает вирусная инфекция – вирусы гриппа А и В, парагриппа, респираторно-синтициальный вирус, метапневмовирус и пр. Однако в ряде случаев у пациентов с остро возникшем и длительно сохраняющимся лающим кашлем заболевание обусловлено B. pertussis, что является единственной клинической ситуацией, при которой оправданно назначение антибиотиков [75]. Препаратами выбора являются макролиды (рокситромицин, азитромицин, кларитромицин).
Проблема комплаентности пациентов
Важной особенностью рокситромицина является возможность его однократного приема в течение суток, что обеспечивает высокую комплаентность пациентов [76]. Известно, в т.ч. на примере лечения ИДП, что наибольший комплаенс наблюдается при однократном приеме антибиотика, напротив, более частый режим дозирования ведет к нередким отклонениям от врачебных предписаний [77–78]. Безусловно, низкая частота нежелательных реакций также сопровождается высоким комплаенсом терапии [79].



