Введение
Холин (витамин В4) является биологически активным веществом, аминоспиртом. Химическое название холина – 2-гидроксиэтилтриметил аммоний, аминоспирт триметиламиноэтанол. Холин проникает через гематоэнцефалический барьер посредством специфических транспортеров и хранится в структуре мембранных фосфолипидов головного мозга – данные особенности фармакокинетики холина делают его нейротропным метаболитом [1]. Именно холин относится к нутриентам, последствия недостаточности которых пролонгируются на всю жизнь [2].
Биологическая роль
С точки зрения биохимических процессов холин и его метаболиты имеют три физиологические точки приложения (см. таблицу):
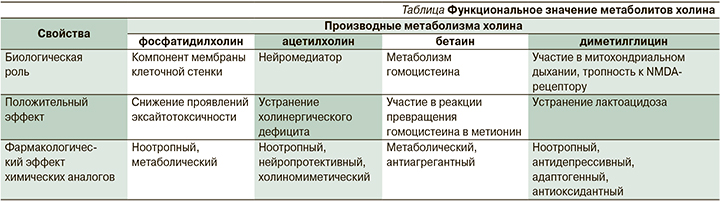
- поддержание структурной стабильности и эластичности мембран за счет образования фосфатидилхолина в процессе метаболизма;
- синтез ацетилхолина и холинергическая нейротрансмиссия;
- участие в метилировании ДНК и метаболизме гомоцистеина через синтез триметилглицина – бетаина, на основе которого синтезируется S-аденозилметионин, являющийся донором метильных групп.
Фосфатидилхолин
Этот фосфолипид является фундаментальной основой клеточной мембраны, основным компонентом лецитина и объектом воздействия для фосфолипаз, которые регулируют множество биологических процессов: воспаление, контроль транспорта внутриклеточной мембраны, миграцию и пролиферацию клеток.
Молекулы фосфолипидов являются важной составляющей клеточных мембран у всех млекопитающих, поэтому профилактика и лечение, направленные на защиту и восстановление фосфолипидов, являются одними из наиболее многообещающих. Некоторые ноотропные препараты, механизм действия которых направлен на нивелирование эксайтотоксичности со следующим за ней окислительным и нитрозативным стрессом, нейровоспалением, являются предшественниками холина. В экспериментах на животных показано, что препараты на основе холина предупреждают индуцированный холинергический дефицит, предотвращают развитие деменции, облегчают процессы обучения и запоминания за счет увеличения синтеза и высвобождения ацетилхолина в мозговых структурах [3].
Имеются данные, согласно которым достаточное количество холина обеспечивает физиологическое соотношения между нейтральными и кислыми классами фосфолипидов, что в совокупности с другими эффектами может обеспечивать изменение соотношения между про- и антиагрегантным равновесием в пользу последнего. Однако данные наблюдения могут быть следствием системных плейотропных эффектов, связанных с ролью фосфолипидов в процессах гемокоагуляции [4].
Ацетилхолин и другие нейро-тропные метаболиты холина: бетаин и диметилглицин
Ацетилхолин является одним из основных нейротрансмиттеров, который регулирует активность базальной холинергической системы.
В синаптической щели ацетилхолин взаимодействует с рецепторами, экспрессирующимися на постсинаптической мембране: с мускариновыми (М-холинорецепторами) и с никотиновыми (Н-холинорецепторами – НХР) [5]. М1-рецепторы локализуются в области коры головного мозга и гиппокампальной извилины, являются основными постсинаптическими холинорецепторами, регулирующими когнитивные функции. С учетом широких биологических связей между нейромедиаторными системами холин стимулирует активность тирозингидроксилазы, увеличивает уровни норадреналина (в коре и гипоталамусе), дофамина (в полосатом теле), серотонина (в коре, полосатом теле и гиппокампе). При этом дофаминергическая передача необходима в обеспечении познавательной деятельности и процессе переключения когнитивных процессов с одного на другой. Также ацетилхолин, высвобождаемый в сосудистой стенке, контролирует функциональное состояние макрофагов, несущих на своей поверхности никотиновые ацетилхолиновые рецепторы и способных блокировать выделение провоспалительных цитокинов.
Несмотря на то что холинергическая иннервация коры мозга возникает несколько позже, чем моноаминергическая, холинергические афференты играют ключевую роль в дифференцировке коры мозга [6, 7]. При значительном сокращении холинергической иннервации происходит задержка клеточной дифференцировки коры мозга [8]. Эти изменения могут коррелировать с когнитивным и поведенческим дефицитом в постнатальном периоде [9].
Следует отметить, что холин является селективным агонистом H-ХР α7-типа, имеющих отношение к обеспечению когнитивных процессов [10, 11]. При болезни Альцгеймера откладывающийся β-амилоид связывается именно с α7-типом Н-ХР и нарушает его функции. Продемонстрирована возможность нейропротективного эффекта различных агонистов, включая холин Н-ХРα7-типа, опосредованного модуляцией внутриклеточной передачей сигнала в нейронах и микроглии [12, 13].
Химические вещества и экологические токсиканты, проявляющие холинотропные свойства через изменение активности холинергической системы, приводят к нарушению развития центральной нервной системы (ЦНС) [14, 15]. Например, тератогенное действие фенобарбитала в период беременности также связано с нарушением холинергической синаптической передачи [16].
Экспериментальные и клинические эффекты бетаина, исследованные при дозах от 500 до 9000 мг/день, демонстрируют, что пищевые добавки с бетаином могут способствовать уменьшению ожирения и/или увеличению мышечной массы. Имеются данные о положительном применении бетаина в спортивной медицине. Диметилглицин, являющийся следующим продуктом метаболизма бетаина, в нескольких исследованиях демонстрирует ноотропные, психомиметические и антидепрессантные свойства за счет агонистической активности в отношении глицинового сайта NMDA-рецептора. Также продемонстрированы метаболические эффекты, заключающиеся в участии в митохондриальном дыхании и устранении лактоацидоза. Добавки с диметилглицином используются в спортивном питании [17–19].
Синергизм холина с фолатами: донация метильных групп и метаболизм гомоцистеина
В период внутриутробного развития холин и его метаболит бетаин принимают участие в регуляции процессов метилирования ДНК эмбриона и плода, усиливая эффекты фолатов, цинка и витаминов В6 и В12 [20].
Фолаты транспортируются в клетки трофобласта через переносчик восстановленного фолата. Метионинсинтаза (MTR) катализирует перенос метильной группы фолиевой кислоты (ФК) для реметилирования гомоцистеина в метионин, который затем используется для образования S-аденозилметионина. ДНК-метилтрансферазы (DNMT) катализируют перенос метильных групп от S-аденозилметионина к ДНК, обеспечивая естественный эпигенетический ландшафт метилирования ДНК и физиологический профиль экспрессии генов, включая факторы роста и матриксные металлопротеиназы, участвующие в процессах инвазии трофобласта. Наличие холина обеспечивает альтернативную донацию метильных групп в материнской печени даже при дефиците ФК, что обеспечивает дополнительный пул S-аденозилметионина и метионина для доставки в плаценту (см. рисунок) [21].
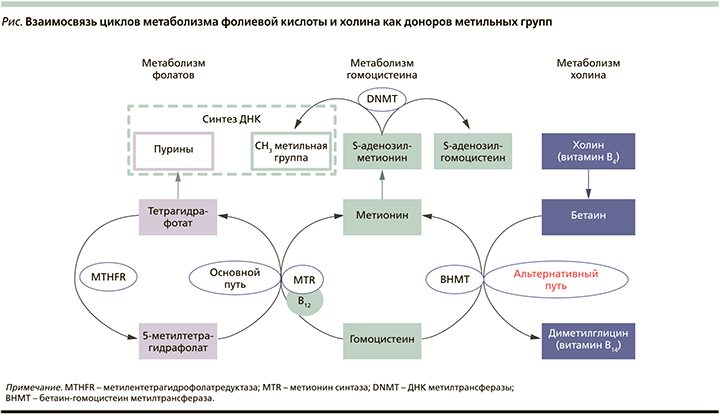
Экспериментальные исследования на беременных животных демонстрируют, что дефицит этих нутриентов в период беременности приводит к гипометилированию ДНК плода и новорожденного. Потомство, рожденное самками с недостаточным по содержанию доноров метильных групп питанием в период беременности, имели низкую массу тела, склонность к раннему ожирению и снижению продолжительности жизни по сравнению с группой мышей, чей рацион был специально обогащен нутриентами, влияющими на метилирование ДНК [22, 23].
Обеспеченность холином
Холин может синтезироваться в печени, однако эндогенного холина может быть недостаточно для удовлетворения физиологических потребностей. Поэтому дополнительное количество холина необходимо получать из пищевых продуктов.
В современном рационе холин присутствует в очень многих продуктах животного происхождения, включая яйца, мясо и молочные продукты. Считается, что минимальное потребление холина составляет 425 мг в сутки для небеременных женщин [24].
Диеты, бедные холином, вызывают жировую дистрофию печени, поражение почек, поджелудочной железы, нарушают процессы памяти. Также выделены группы высокого риска по дефициту холина: беременные и кормящие женщины, дети, особенно в критические периоды роста, спорт-смены, вегетарианцы и группа людей на ограничительных диетах. Следует отметить и сложности в объективном контроле за количеством суточного поступления холина с пищей.
Физиологическая потребность в холине увеличивается во время беременности ввиду его необходимости для развития плода, особенно для правильного формирования структур головного мозга [25].
Следует отметить, что транспортная активность холина более чем в 100 раз выше в бластоцисте по сравнению с двуклеточным концептусом, что обеспечивает его максимальное поступление в развивающийся эмбрион в период закладки нервной трубки. Данное обстоятельство демонстрирует важность поступления холина в преконцепции [26]. В целом в весь внутриутробный период потребность развивающегося плода в холине значительно больше, чем в постнатальном периоде. Доказательством служат следующие данные: холин присутствует в пуповинной крови в концентрации, в 3–5 раз выше, чем в крови матери при рождении [27].
Применение холина во время беременности и в период грудного вскармливания
Беременность и грудное вскармливание – это периоды, когда потребность в холине особенно высока и поступление холина в организм критически необходимо. Рекомендуемое адекватное потребление составляет 450 мг/сут. для беременных женщин и 550 мг/сут. для кормящих женщин. Большое количество холина доставляется плоду через плаценту, а концентрация холина в амниотической жидкости в 10 раз выше, чем в материнской крови. Концентрация холина в плазме или сыворотке крови у беременных женщин бывает значительно выше, чем у небеременных (10,7 мкМ свободного холина и 2780 мкМ связанного холина у небеременных женщин по сравнению с 16,5 и 3520 мкМ у женщин на сроке беременности от 36 до 40 недель), а у плода и новорожденного она бывает в 6–7 раз выше, чем у взрослых. У человека в результате транспорта холина от материнского организма к плоду происходит истощение содержания холина в плазме материнского организма.
Таким образом, несмотря на повышенную способность синтезировать холин во время беременности, потребность в этом веществе превышает его поступление в организм и его запасы могут истощаться. Поскольку грудное молоко богато холином, грудное вскармливание еще более увеличивает потребность материнского организма в нем, что приводит к длительному истощению его запасов в тканях [41].
Недостаточная сапплементация холином в периоде беременности и грудного вскармливания может приводить к нарушению когнитивной функции, т.к. перинатальный период является критическим временем для холинергической организации функции мозга [26]. По данным национального обследования состояния здоровья и питания в США за 2009–2014 гг. и беременных женщин за 2005–2014 гг., установлено, что в общей популяции только 8,03±0,56% взрослых и 8,51±2,89% беременных женщин потребляют пищу, содержащую достаточное количество холина [28].
В 2017 г. American Medical Association в своей резолюции, принятой делегатами на ежегодном собрании (Чикаго), объявила, что пренатальные витаминные добавки должны содержать холин [29], а FDA поддержало эту инициативу, рекомендовав референсную суточную дозу в 550 мг.
Роль холина в эмбриогенезе
После оплодотворения яйцеклетки полученная зигота подвергается клеточным делениям с образованием бластоцисты, которая дифференцируется в наружный слой трофэктодермы, в дальнейшем формирующий плаценту, и внутреннюю клеточную массу, трансформирующуюся в ткани плода. Фолаты и холин имеют решающее значение для раннего эмбрио-нального развития, являясь основным донором метильных групп для синтеза нуклеотидов, необходимых для репликации ДНК и деления клеток [30]. Однако важность данных соединений в раннем развитии бластоцисты выходит за рамки синтеза нуклеотидов. Эксперименты с использованием преимплантационных бластоцист мышей продемонстрировали, что холин, как и ФК, вносят значимый вклад в процессы метилирования ДНК раннего эмбриогенеза [31]. Временное выключение бетаин-гомоцистеин метилтрансферазы (BHMT) приводило как к значительному снижению синтеза ДНК, так и к нарушению процессов метилирования цитозина. Это свидетельствует о том, что внутренняя клеточная масса стремительно развивающегося плода использует не только ФК, но и холин для образования S-аденозилметионина. При этом дозозависимые эффекты изменения метилирования ДНК бластоцисты и профиля экспрессии генов были продемонстрированы как для фолатов, так и для холина [32].
Дефекты нервной трубки
В формировании дефектов нервной трубки (ДНТ) участвует несколько факторов питания. Главным среди них является фактор потребления ФК в период до и после зачатия. Аналогично ФК, холин участвует в метилировании гомоцистеина до метионина. Некоторые исследования показывают, что потребление холина и метионина также может являться фактором снижения риска формирования ДНТ независимо от потребления ФК с пищей и пищевыми добавками. Ингибирование усвоения и метаболизма холина приводило к формированию ДНТ у эмбрионов мышей.
Shaw G.M. et al. обнаружили, что у женщин, находившихся в самом низком квартиле по потреблению холина с пищей, риск рождения ребенка с ДНТ был в 4 раза выше по сравнению с женщинами, находившимися в самом высоком квартиле по потреблению холина. Снижение риска развития беременностей с ДНТ у плода было отмечено при потреблении большего объема холина до и после зачатия в отношении как всех ДНТ, так и расщелины позвоночника и анэнцефалии по отдельности.
Связь с потреблением холина оставалась сильной после поправки на массу тела матери до беременности, рост, образование, расовую/этническую принадлежность, употребление витаминов в период до и после зачатия, потребление фолиевой кислоты с пищей, потребление метионина с пищей и общую калорийность потребляемой пищи. Так как метаболизм холина и ФК пересекается на пути передачи метильных групп, разумно будет предположить, что реакции метилирования являются общим для них механизмом, влияющим на закрытие нервной трубки.
Пренатальное потребление холина и когнитивные функции потомства
Доклинические исследования установили, что добавление в питание беременных крыс холина улучшало память у потомства [33], в то время как дефицит материнского холина у лабораторных животных (мышей) снижал нейрогенез и ангиогенез в гиппокампе потомства [34].
В одном исследовании В.Т. Wu et al. обнаружено, что концентрация холина и бетаина в материнской плазме (n=154), собранной в период от 16 до 36 недель беременности, положительно коррелирует с когнитивными функциями младенцев, оцененными в возрасте 18 месяцев с использованием шкал развития младенцев Бейли-III [35].
В систематическом обзоре показано, что питание матери во время беременности имеет положительную корреляцию с развитием нервной системы и когнитивных функций ребенка [36]. Caudil Met al. провели сравнительное исследование на двух группах беременных женщин. Одна группа потребляла 480 мг холина в сутки, вторая – 930 мг в сутки в течение III триместра беременности [37]. Для того чтобы достичь этих заданных уровней общего потребления холина все женщины придерживались одной и той же исследовательской диеты, которая обеспечивала 380 мг холина в день плюс дополнительная добавка холина в количестве 100 или 550 мг в день. Первые результаты данного исследования опубликованы в 2018 г.
Авторами отмечено, что уже в возрасте 1 года когнитивные способности детей выше в группе с высоким потреблением холина. Через несколько лет проведена повторная оценка интеллекта у детей в возрасте 7 лет [38]. Полученные данные продемонстрировали, что дети, матери которых употребляли большие дозы холина в течение III триместра беременности, имели более высокие показатели внимания, лучшие когнитивные функции, которые заключались в высокой скорости решения поставленных задач. Поскольку женщины в США во время беременности не употребляют даже рекомендуемое количество холина, полученные результаты весьма актуальны.
Холин и функция плаценты
Плацента является важнейшим органом беременности, обеспечивающим поступление нутриентов и кислорода к развивающемуся плоду. Правильное функционирование плаценты зависит от развития сосудистой системы, обеспечивающей достаточный приток крови к развивающемуся плоду. Недостаточная васкуляризация плаценты может приводить к различного рода нарушениям во время беременности, которые характеризуются ухудшением роста плода, таким как задержка внутриутробного развития и преэклампсия. Появляющиеся данные из растущего числа исследований свидетельствуют, что нутрицевтическая поддержка на основе холина может благотворно влиять на функциональные процессы в плаценте, включая ангиогенез, воспаление и транспорт макронутриентов.
Исходя из данных исследований на грызунах, использование холина в пренатальном периоде также может оказаться эффективным подходом с точки зрения организации питания для минимизации плацентарной недостаточности [42].
Современные витаминно-минеральные комплексы
Подобно ФК, холин также важен для профилактики пороков нервной трубки плода и нормального развития центральной нервной системы [39], однако в отличие от ФК отсутствует стратегия фортификации холином продуктов питания и часто холин не является стандартным компонентом пренатальных витаминно-минеральных комплексов.
Свежий анализ данных NHANES показывает, что у большинства населения показатель потребления холина намного ниже действующих рекомендаций. Повышение осведомленности о повсеместном распространении субоптимального потребления холина должно стать центром усилий общественного здравоохранения для обеспечения оптимального здоровья населения.
В достижении этой цели может помочь распространение информации о пищевых продуктах, являющихся самыми богатыми источниками холина [41].
Препарат Фемибион® I нового состава содержит холин (130 мг), который выступает в качестве дополнения к фолатам, и оба вещества, являясь донорами метильных групп, обеспечивают нормальный метаболизм гомоцистеина, способствуют гармоничному развитию нейрональных тканей [40]. По этой причине холин нельзя заменить, например, витамином B9 (фолиевая кислота) даже с учетом того, что эти витамины обладают синергизмом и взаимодополняющим действием.
Дополнительная информация
Публикация статьи осуществляется в рамках диссертационнойработы: «Оценка эффективности терапии ранних репродуктивных потерьжировыми эмульсиями».



