Введение
Функциональные расстройства желудочно-кишечного тракта (ФРЖКТ) занимают лидирующее положение в структуре заболеваний органов пищеварения у людей разных возрастов. По данным различных исследований, распространенность названной патологии в развитых странах мира составляет от 7 до 21% среди взрослого населения [1] и от 14 до 24% среди детей в возрасте от 4 до 18 лет [2].
Известно, что одним из наиболее значимых факторов, способствующих развитию ФРЖКТ, являются острые кишечные инфекции (ОКИ). В Российской Федерации отмечается явное доминирование вирусных возбудителей диарейных заболеваний [3]. Только два наиболее распространенных вирусных инфекционных агента (норовирусы и ротавирусы) ответственны за 30–72% случаев ОКИ у детей в возрасте от 1 до 5 лет. Именно в этом возрасте, по данным ряда исследователей, формируются патофизиологические предпосылки развития ФРЖКТ [4].
Особую роль в формировании функциональной патологии (ФП) органов пищеварения играет нарушение микробиоценоза кишечника. Ротавирусы и норовирусы обладают доказанной способностью приводить к значимым нарушениям микробиоценоза кишечника, напрямую и опосредованно повышая вероятность развития ФРЖКТ [5, 6].
На сегодняшний день существует ряд работ, отражающих частое развитие ФРЖКТ у пациентов, перенесших вирусные гастроэнтериты [6]. Так, например, установлена высокая частота (13,4%) развития синдрома раздраженного кишечника у взрослых и детей в течение 6–12 месяцев после перенесенного острого норовирусного и ротавирусного гастроэнтерита [7, 8].
Тем не менее причины развития функциональной патологии органов пищеварения после вирусных кишечных инфекций изучены недостаточно.
Целью работы стало выявление особенностей функциональных нарушений пищеварительной системы и изменений микробиоты кишечника у детей вследствие перенесенных ОКИ, вызванных ротавирусами и норовирусами.
Материал и методы
Характеристика пациентов и дизайн исследования. В исследование были включены 120 детей, проходивших лечение с сентября 2014 по декабрь 2015 г. в отделении кишечных инфекций НИИ детских инфекций с диагнозом: ротавирусный (группа 1, РВИ – ротавирусная инфекция – 60 детей) и норовирусный (группа 2, НВИ – норовирусная инфекция – 60 детей) гастроэнтерит, подтвержденный генетическим исследованием проб фекалий с помощью полимеразной цепной реакции (ПЦР) с обратной транскрипцией.

Критериями включения были:
- возраст пациента от 1 года до 7 лет,
- поступление не позднее 72 часов с момента начала заболевания;
- отсутствие сопутствующей гастроэнтерологической патологии;
- подписание законными представителями ребенка информированного согласия.
Исследуемый контингент детей состоял из 83 (51,8%) мальчиков и 77 (48,2%, p>0,05) девочек, средний возраст составил 2,8±1,7 года. Подробное распределение групп по полу и возрасту представлено в табл. 1.
Исключение сопутствующей гастроэнтерологической патологии проведено на основании беседы с родственниками пациента, анкетирования родителей, осмотра пациента, анализа амбулаторных карт пациента, а также данных лабораторных и инструментальных исследований. Дети с диагностированными заболеваниями желудочно-кишечного тракта (ЖКТ) до госпитализации в исследование не включались.
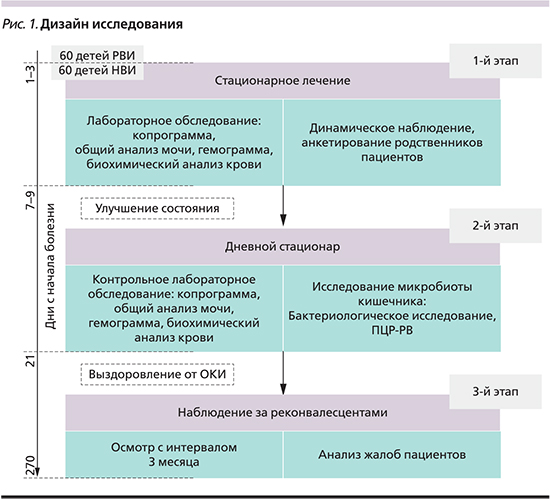
Общая длительность наблюдения каждого пациента составила 9 месяцев (270 дней). Все пациенты, включенные в наблюдаемые группы, завершили исследование к 270-му дню с момента начала болезни. Наблюдение за пациентами, вошедшими в исследование, подразделялось на 3 этапа (рис. 1).

На первом этапе пациенты проходили круглосуточное стационарное лечение и обследование. Все дети получали стандартную терапию, включившую регидратационную терапию, ферментные препараты, пробиотики, сорбенты, симптоматические средства (нормокинетики, антипириетики, противорвотные средства). В ряде случаев (13,3%) до получения результатов верификации возбудителя при невозможности исключения бактериальной кишечной инфекции пациенты получали антибактериальные препараты.
На втором этапе после выписки из круглосуточного стационара за пациентами продолжали наблюдение и лечение в дневном стационаре. Выписка из дневного стационара осуществлялась после проведения контрольного лабораторного обследования. Всем пациентам проведено исследование состава микрофлоры толстого кишечника методом бактериального посева фекалий и ПЦР в режиме реального времени.
Далее (3-й этап) осуществлено катамнестическое наблюдение реконвалесцентов сроком не менее 9 месяцев. Для реализации цели исследования оценивали появление жалоб на боли в животе, диспепсические явления со стороны верхнего (отрыжка, тошнота, рвота) и нижнего отделов (метеоризм, флатуленция, запоры, признаки «малой» диареи: периодический жидкий стул, дефекация более 3 раз в сутки) ЖКТ, изменения аппетита, общего самочувствия. Для объективной оценки состояния пациента детей осматривал врач в динамике с интервалом 90 дней, а также при появлении симптомов поражения органов ЖКТ. Интерпретация результатов осуществлена на основании Римских критериев III пересмотра, предложенных Комитетом по изучению функциональных расстройств у детей и Международной рабочей группой по разработке критериев функциональных расстройств в 2006 г. [9]. На основании результатов катамнестического наблюдения пациенты подразделялись на подгруппы: реконвалесценты, перенесшие РВИ с благоприятным течением постинфекционного периода (РВИ ФП-) с ФРЖКТ (РВИ ФП+) и НВИ (НВИ ФП- и РВИ ФП+)
Выявление возбудителя ОКИ. Вери-фикация этиологического диагноза осуществлена методом ПЦР с обратной транскрипцией в стуле с использованием реагентов «АмплиСенс® ОКИ скрин-FL» («Интерлабсервис», Россия) для выявления и дифференциации ДНК (РНК) микроорганизмов родов Shigella и Salmonella, энтероинвазивных Escherichia coli, термофильных кампилобактерий, аденовирусов группы F, ротавирусов группы А, норовирусов 2-го генотипа и астровирусов.
Оценка состава микробиоты ЖКТ. Для оценки состава кишечной микробиоты в образцах фекалий определено содержание маркерных микроорганизмов, выявленных при дисбиозах, двумя независимыми методами – культуральным (бактериологическим) и с помощью ПЦР в режиме реального времени (ПЦР-РВ). Бактериологическое исследование проведено в соответствии с Отраслевым стандартом 2003 г. [10].
Выделение ДНК из фекалий осуществлено с помощью набора ДНК-ЭКСПРЕСС (ООО «Литех», Россия). Количество ДНК стандартизировали на спектрофотометре и провели ПЦР-РВ с использованием набора «Колонофлор-16» (ООО «АльфаЛаб», Россия). Набор рассчитан на выявление информационно значимых бактерий, принадлежащих к различным видам бактерий: Firmicutes (Lactobacillus spp., Enterococcus spp., Faecalibacterium prausnitzii, Clostridium difficile/perfringes, Staphylococcus aureus, Bacteroudetes (Bacteroides fragilis/thetaiotaomicron), Actinobacteria (Bifidobacterium spp.), Proteobacteria (E. coli с нормальной ферментативной активностью и энтеропатогенные, Proteus mirabilis/vulgaris, Klebsiella pneumoniae/oxytoca).
Статистический анализ результатов исследования осуществлен с помощью χ2-критерия, t-теста, однофазного дисперсионного анализа с использованием статистического пакета Statistica. 10 (Разработчик: StatSoft, Inc.). Достоверными считали результаты при р<0,05.
Результаты исследования и их обсуждение
Анализ клинико-лабораторных особенностей ОКИ. РВИ чаще протекала с выраженными симптомами интоксикации и диарейным синдромом: жидкий стул при поступлении у детей группы 1 отмечался значимо чаще, сохранялся более продолжительное время (4,2±1,2 и 2,2±0,8 дня соответственно; p=0,012). В то же время в клинической картине НВИ чаще отмечалось наличие жалоб на рвоту (табл. 2). Длительность госпитализации при РВИ была значимо больше, чем при НВИ. Описанные особенности клинического течения кишечных инфекций согласуются с описаниями инфекционного процесса, предлагаемыми большинством авторов, и объясняются отличиями в патогенетических механизмах действия двух различных вирусных возбудителей [11]. Однако установить наличие связи между тяжестью клинических проявлений ОКИ и вероятностью развития ФРЖКТ не удалось.
Характеристика ФРЖКТ (3-й этап исследования). Функциональная патология ЖКТ была диагностирована у 22 (18,3%) детей. Статистически значимых отличий по полу и возрасту между детьми с ФРЖКТ и благоприятным течением постинфекционного периода выявлено не было.
Несколько чаще ФРЖКТ выявлялись у пациентов, перенесших РВИ (14 человек, 23,3%), чем у детей, перенесших НВИ (8 человек, 13,3%). Учитывались клинические симптомы, регулярно отмечаемые у пациента в течение не менее 6 месяцев. Частота выявления персистирующего абдоминального болевого синдрома через 9 месяцев наблюдения составила 13,3 и 8,3% в группах 1 и 2 соответственно (p=0,37). Признаки «малой» диареи (периодический жидкий стул, дефекация более 3 раз в сутки) в катамнезе были выявлены у 9 (6,3%) детей: у 5 (8,3%) из группы 1 и у 4 (6,7%) из группы 2 (p=0,76). Уменьшение частоты дефекаций (2 и менее в неделю), изменение консистенции стула (1–2-й типы по бристольской шкале); затруднения при дефекации отмечены у 5,0% детей группы 1 и 3,3% группы 2 (p=0,64). Частота выявления симптомов была максимальной в первые 3 месяца наблюдения, имела отчетливую тенденцией к уменьшению в динамике наблюдения за пациентами (рис. 2).
Результаты бактериологического исследование микробиоты кишечника. Состояние микробиоценоза кишечника детей оценивали, исследуя пробы фекалий на 21-й день болезни, – после исчезновения клинических симптомов ОКИ и нормализации лабораторных показателей. Как и в предыдущих исследованиях [12], оценку состояния микробиоты проводили бактериологическим и молекулярно-генетическим методами, что позволило выявить большое число представителей микробиоты и контролировать количество жизнеспособных маркерных микроорганизмов.
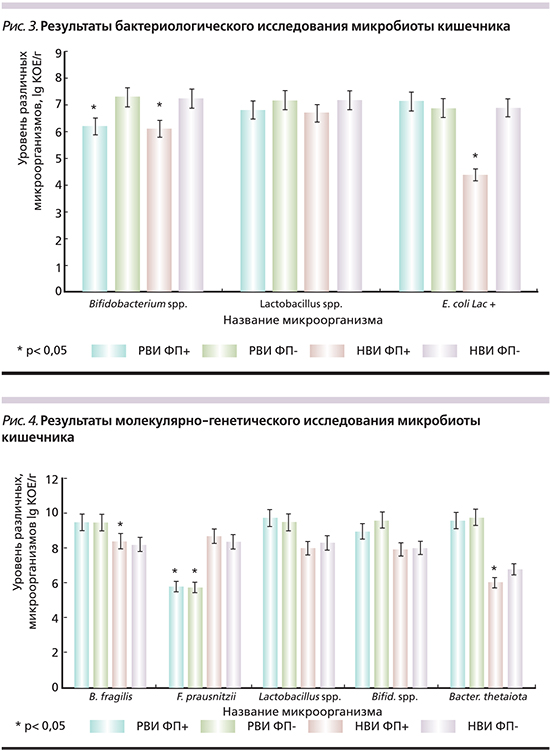
При исследовании культуральным методом в большинстве проб фекалий реконвалесцентов ОКИ (n=103, 85,8%) количество лактобацилл и бифидобактерий было меньше нормальных показателей на 1–3 lg КОЕ/г (рис. 3).
У детей с симптомами ФРЖКТ, перенесших норовирусную (НВИ ФП+) и ротавирусную инфекции (РВИ ФП+), количество бифидобактерий было снижено по сравнению с другими подгруппами без ФП (р=0,04 и 0,047 соответственно). В подгруппе НВИ ФП+ были обнаружены Klebsiella spp. (3% пациентов) в высоком титре (более 4 lgКОЕ/г). Нельзя исключить, что повышение количества клебсиелл связано у детей этой группы с более низким содержанием симбиотических лактозопозитивных эшерихий (потенциальных антагонистов рассматриваемых условно-патогенных грамотрицательных энтеробактерий) по сравнению с подгруппами РВИ ФП+ и HВИ ФП- (р=0,02 и p=0,007 соответственно).
Результаты молекулярно-генетического исследования микробиоты кишечника. Количество лактобацилл и бифидобактерий во всех подгруппах соответствовало нормальным показателям (рис. 4). Однако в случае пациентов, перенесших норовирусную инфекцию, количество бифидобактерий было достоверно ниже, чем в группах РВИ ФП+ и РВИ ФП- (р=0,047 и р=0,03 соответственно). Это подтверждают данные, полученные при бактериологическом исследовании, в отношении этой группы детей.
Благоприятным прогностическим фактором при оценке состояния микробиоты было увеличение содержания Bacteroides thetaiotaomicrion, способных, как показано ранее, ингибировать репродукцию ротавирусов [13]. Количество этих бактерий было значительно больше (р<0,05) в группах детей, перенесших РВИ ФП-. Нельзя исключить, что увеличение содержания этих бактерий способствовало элиминации ротавирусов при ОКИ.
В то же время в пробах фекалий детей подгруппы РВИ ФП+ было выявлено более низкое содержания симбионтных бактерий F. prausnitzii, чем в группах НВИ ФП+ и НВИ ФП- (р=0,01 и р=0,03 соответственно) на фоне увеличения условно-патогенных B. fragilis (р=0,04 и р=0,03 соответственно). Наличие подобных сдвигов, по данным других авторов, может приводить к развитию синдрома раздраженного кишечника [14]. Выявленные молекулярно-генетическим методом нарушения микробиоты наряду с уменьшением количества лактобацилл и бифидобактерий, обнаруженным бактериологическим методом, позволяет констатировать наличие признаков дисбиоза кишечника у детей при РВИ ФП+ и РВИ ФП-. Нельзя исключить, что это во многом объясняет более частое развитие ФП у детей, перенесших ротавирусную инфекцию.
Различная частота клинических проявлений ФРЖКТ у детей, перенесших кишечные инфекции, вызванные ротавирусами и норовирусами, связана не только с особенностями изменений состава микробиоты. Косвенным свидетельством данного факта являлась более высокая частота развития ФРЖКТ в группе пациентов с РВИ на фоне менее выраженных изменений микробиоты по сравнению с реконвалесцентами НВИ.
Одним из возможных объяснений особенностей ФП ротавирусной и норовирусной этиологии можно считать существенное различие в механизмах влияния Norovirus или Rotavirus на организм хозяина и его микробиоту, прямо и опосредованно действующих на рецепторы и биологически активные молекулы представителей микробиоты, а также клеток пищеварительной и иммунной систем [5, 15].
Выводы
1. Постинфекционная ФП ЖКТ реализуется у 18,3% реконвалесцентов вирусных гастроэнтеритов. Чаще проявления ФРЖКТ отмечаются после РВИ.
2. Изменения микробиоты при вирусных гастроэнтеритах различной этиологии имеют ряд специфических особенностей:
- снижение количественного содержания F. prausnitzii, повышение уровня B. thetaiotaomicrion при РВИ;
- выраженное угнетение роста Lactobacillus spp. и Bifidobacterium spp., чрезмерный рост условно-патогенных бактерий при НВИ.
3. Нарушения нормального состава микробиоты кишечника играют одну из ключевых ролей в формировании ФРЖКТ у детей, перенесших вирусные гастроэнтериты, однако не могут рассматриваться изолированно – без учета клинико-лабораторного течения ОКИ и особенностей иммунного реагирования.



