Функциональная патология органов пищеварения представляет большой интерес для медицинского сообщества. Одним из самых изученных заболеваний такого рода является синдром раздраженного кишечника (СРК) [11–14], при котором, согласно Римским критериям IV пересмотра (2016), наблюдается рецидивирующая абдоминальная боль как минимум 1 день в неделю на протяжении последних 3 месяцев, ассоциированная с 2 или более из числа следующих признаков: связана с дефекацией, ассоциирована с изменением частоты, а также формы стула. Данные симптомы должны наблюдаться не менее 6 месяцев назад [1].
Отличием определения СРК от Римских критериев-III является замена слов «уменьшается после дефекации» на «связано с дефекацией», т.к. далеко не все пациенты отмечают уменьшение боли после дефекации, многие отмечают ее усиление. Также из определения исключен термин «дискомфорт», поскольку не все языки мира содержат данное слово, что создает трудности в интерпретации своего состояния пациентом и жалоб пациента врачом, а это в свою очередь может приводить врача на ошибочный диагностический путь. В Римских критериях-IV уточнены временные рамки, в течение которых должны наблюдаться симптомы: теперь это не реже 1 раза в неделю вместо 3 дней в месяц, как было в критериях III. Таким образом, сегодня отличительной чертой СРК является именно боль в животе, а не «околоболевые» ощущения [2].

Следует подчеркнуть, что все функциональные заболевания желудочно-кишечного тракта (ЖКТ), и в частности СРК, существенно снижают качество жизни пациентов. Боль является, пожалуй, главным фактором в течении заболевания, остро переживаемая пациентом и тем самым оказывающая мощное влияние на его оценку своего состояния и качество жизни. В связи с этим купирование болевого синдрома является важнейшей и неотъемлемой частью качественного лечения больных СРК. Кроме абдоминальной боли в патогенезе СРК принимают участие расстройства моторной функции кишечника, висцеральная гиперчувствительность, нарушения состава кишечной микробиоты. Коррекция указанных нарушений, несомненно, вносит существенный вклад в успех лечения.
Однако, несмотря на непрекращающиеся научные изыскания на тему СРК, вопросы лечения данного расстройства остаются сложными и дискутабельными. Дело в том, что до сегодняшнего дня не было универсального средства, которое воздействовало бы на все звенья патогенеза СРК. Врач вынужден был назначать как минимум 2 препарата – спазмолитик и средство, влияющее на нарушения стула: слабительное или закрепляющее. Необходимость приема нескольких препаратов снижает приверженность пациентов лечению и как следствие – ведет к низкой эффективности последнего.
На отечественный фармакологический рынок не так давно вышел новый препарат российского производства, содержащий комплекс антител к трем компонентам – релиз-активные антитела к мозгоспецифическому белку S-100, фактору некроза опухоли α и гистамину (кАТ). Сочетание трех активных компонентов разрывает «порочные круги» патогенеза СРК и позволяет купировать клиническую симптоматику, в частности боль и нарушения стула, нормализует висцеральную гиперчувствительность и повышает качество жизни. Кроме того, за счет наличия релиз-активных антител к мозгоспецифическому белку S-100, обладающих анксиолитическим действием, кАТ нормализует эмоциональный фон пациентов, который часто бывает снижен.

Результаты проведенных ранее доклинических и клинических испытаний свидетельствуют в пользу эффективности и безопасности кАТ и его компонентов в лечении гастроинтестинальной патологии воспалительного и функционального характера, а также купирования при его применении соматоформных нарушений и психоневрологических расстройств на фоне соматических и неврологических заболеваний [3–6].
Эффективность кАТ была подтверждена в ходе двойного слепого плацебо-контролируемого рандомизированного исследования [7].
Также заслуживает внимания тримебутин – агонист опиатных рецепторов. Применение тримебутина на протяжении нескольких десятков лет для лечения различных функциональных расстройств ЖКТ подтверждает его эффективность и безопасность.
Тримебутин связывается с мю-, каппа- и дельта-опиатными рецепторами, при этом не обладая специфичностью к какому-то одному их виду. Являясь нормокинетиком, препарат оказывает двойной регулирующий эффект. Действуя на каппа-рецепторы, он угнетает моторику, действуя на мю- и дельта-рецепторы: стимулирует моторику ЖКТ. Таким образом, тримебутин оказывает спазмолитическое или прокинетическое действия в зависимости от исходного состояния моторики ЖКТ [8–10].
В связи с вышеизложенным нами было проведено исследование, целью которого стало изучение эффективности и безопасности применения кАТ по сравнению с тримебутином при лечении пациентов с СРК различных типов.
 Данное исследование проводилось в соответствии с Римскими критериями-III, согласно которым СРК является функциональным расстройством, при котором наблюдается боль или дискомфорт в животе не менее 3 дней в месяц с началом появления симптомов за 6 месяцев до постановки диагноза, уменьшающаяся после дефекации и связанная с изменением частоты и характера стула [11, 12].
Данное исследование проводилось в соответствии с Римскими критериями-III, согласно которым СРК является функциональным расстройством, при котором наблюдается боль или дискомфорт в животе не менее 3 дней в месяц с началом появления симптомов за 6 месяцев до постановки диагноза, уменьшающаяся после дефекации и связанная с изменением частоты и характера стула [11, 12].
Материал и методы
В исследовании были включены 149 пациентов обоего пола в возрасте от 18 до 60 лет, соответствующих стандартным для подобного исследования критериям включения/невключения (табл. 1) и подписавших информированное согласие на участие.
Для оценки клинической динамики симптомов СРК кроме объективного обследования использовались визуальная аналоговая шкала при СРК (ВАШ), Бристольская шкала формы стула, расчет суммарного индекса висцеральной чувствительности по шкале VSI (Visceral Sensitivity Index) и опросник для оценки качества жизни при СРК (IBS-QoL).
В течение исследования пациенты осуществляли 5 визитов к врачу: визит 1 (день 0), визит 2 (день 14±3), визит 3 (день 28±3), визит 4 (день 56±3) и визит 5 (день 84±3).
В ходе исследования оценивались динамика болевого синдрома, доли пациентов со снижением боли на 30% и более, на 90% и более, динамика характера стула у пациентов с СРК-З и СРК-Д, динамика индекса висцеральной гиперчувствительности, динамика качества жизни.
Боль при СРК – это основной симптом, купирование которого является главной целью патогенетического лечения [14]. Поэтому в качестве первичных (снижение выраженности боли/дискомфорта по ВАШ на 30% и более на визитах 3 и 5) и вторичных (снижение выраженности боли/дискомфорта по ВАШ на 90% и более на визитах 3 и 5) критериев эффективности лечения использовалась оценка влияния препаратов на болевой синдром. Именно на динамике болевого синдрома мы и остановимся подробнее в данной публикации.
Результаты исследования
После рандомизации пациенты распределились по группам следующим образом: 74 пациента составили группу кАТ, 75 – группу тримебутина. Возрастно-половая структура пациентов с СРК в целом и по группам представлена в табл. 2.
Согласно классификации СРК по типам в зависимости от преобладающих нарушений стула, пациенты в сравниваемых группах распределились таким образом, что было отмечено доминирование больных СРК-Д и СРК-З – 52,7 и 31,1% соответственно в группе кАТ и 44 и 38,7% в группе тримебутина.
В сравниваемых группах не было выявлено достоверных различий по основным исходным характеристикам, т.е. по возрастному, половому составу и клинической картине обе группы были сопоставимыми.
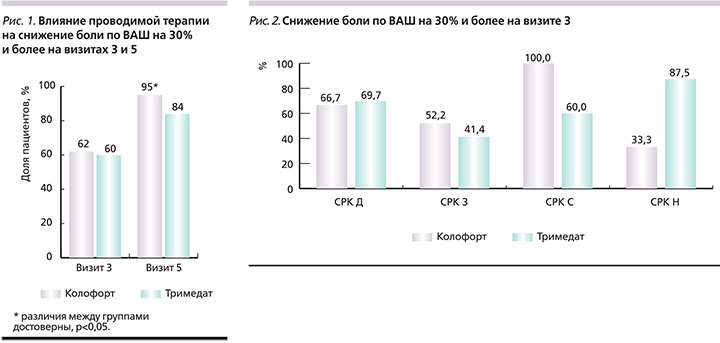
К визиту 3 доли пациентов со снижением боли по ВАШ на 30% и более в группах кАТ и тримебутина были сопоставимыми: 62 и 60% (χ2=0,07; p=0,7867; критерий Фаррингтона–Мэннинга [nonferiority test]: z=1,53; p=0,0633). Однако к визиту 5 продемонстрировано статистически значимое превосходство терапии кАТ по сравнению с тримебутином: 95 против 84% пациентов (χ2=4.4; p=0,0368; критерий Фаррингтона–Мэннинга: z=3.7; p=0,0001; рис. 1).
Для более детальной оценки эффективности кАТ и тримебутина в отношении боли дополнительно был проведен анализ динамики снижения боли на 30% и более с учетом типа СРК на визитах 3 и 5.
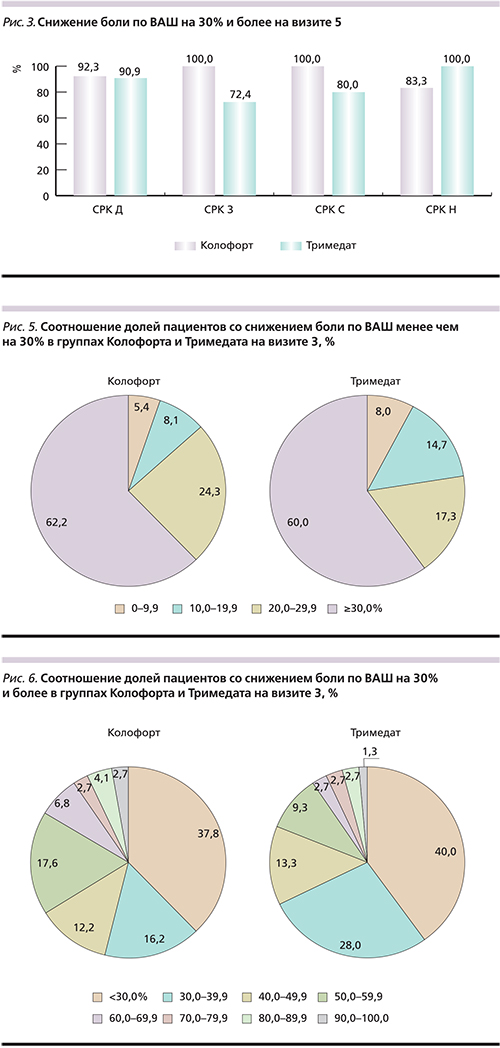
На визите 3 в группе СРК-Д кАТ и тримебутин продемонстрировали сопоставимую эффективность: на 30% и более боль снизилась у 66,7 и 69,7% больных соответственно (рис. 2). У пациентов с СРК-З наблюдалась тенденция в сторону большей эффективности кАТ. В группе СРК-С снижение боли по ВАШ на 30% и более наблюдалось у 100% больных группы кАТ и только у 60% – группы тримебутина. И наконец, в группе СРК-Н преимущество находилось на стороне тримебутина.
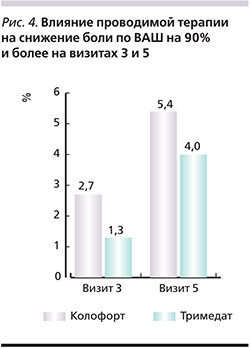
На визите 5 в группе СРК-Д снова проявилась сопоставимая эффективность обоих препаратов (рис. 3).
В группах СРК-З и СРК-С наблюдалась тенденция к большей эффективности кАТ, а в группе СРК-Н – большей эффективности тримебутина.
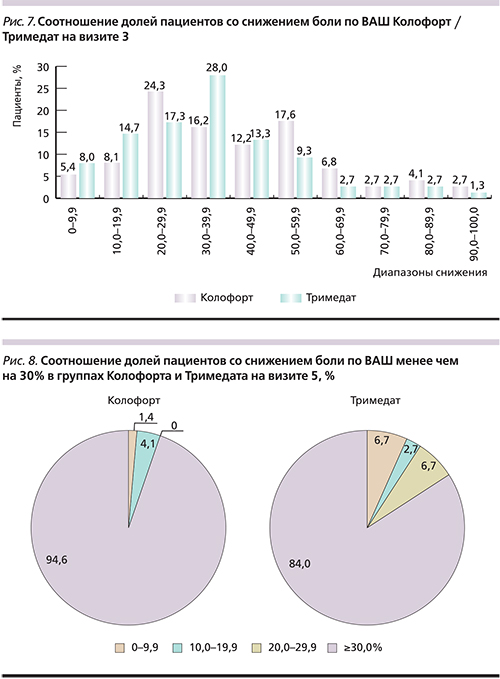
При оценке доли пациентов, у которых отмечено снижение выраженности боли/дискомфорта по ВАШ на 90% и более от исходного значения на визитах 3 и 5, получены сопоставимые данные в обеих группах с тенденцией к лучшим показателям в группе кАТ (рис. 4).
Уменьшение боли на 90% и более было достигнуто двоими пациентами с СРК-Д в группе кАТ (2,7%) уже к визиту 3, а к визиту 5 – еще двоими больными СРК-Н, т.е. всего четверым из группы этого препарата (5,4%; рис. 4). В группе тримебутина подобный результат был достигнут лишь 1 (1,3%) пациентом с СРК-Н к визиту 3 и еще 2 больным СРК-С к визиту 5, т.е. всего 3 (4,0%) пациентами в составе группы. Таким образом, кАТ продемонстрировал более выраженное влияние на болевой синдром вне зависимости от типа СРК по сравнению с тримебутином.
Далее при анализе соотношения пациентов со снижением боли менее чем на 30% и более чем на 30% были выявлены следующие особенности.
В группе кАТ на визите 3 у 62,2% пациентов боль снизилась на 30% и более. Следовательно, у 37,8% больных боль снизилась менее чем на 30%. Детализация группы пациентов, в которой боль снизилась менее чем на 30%, позволила выяснить, что среди больных преобладали те, у кого боль снизилась на величину в диапазоне 20,0–29,9% (24,3% от общего числа пациентов группы кАТ; рис. 5, 7).
При анализе выборки пациентов со снижением боли менее чем на 30% в группе тримебутина было выявлено, что у большинства (17,3% от общего числа пациентов в данной группе) больных снижение боли приходилось на диапазон 20,0–29,9% (рис. 5, 7). Таким образом, обнаружилась полная тождественность результатов применения кАТ и тримебутина в этом дополнительном исследовательском диапазоне, что еще более подчеркивает параллельную положительную динамику на фоне лечения указанными препаратами.
При анализе данных пациентов со снижением боли по ВАШ на 30% и более было установлено, что у большинства больных группы кАТ (16,2 и 17,6%) боль снизилась на величину в диапазонах 30,0–39,9 и 50,0–59,9% соответственно (рис. 6, 7).
При анализе данных пациентов группы тримебутина, у которых боль по ВАШ снизилась на 30% и более, было обнаружено, что у большинства (28,0%) пациентов снижение боли пришлось на диапазон 30,0–39,9% (рис. 6, 7).
Со статистической точки зрения более высокий интерес представляют наибольшие расхождения между группами: для 3-го визита – 30–39,9% и разница в 16,2/28,0% между препаратами (рис. 7). Однако при наличии массы сравниваемых значений (11 пар для каждого визита) для признания результата значимым необходимо получить р<0,0045, а не <0,05 в случае с одним сравнением и использовать поправку на множественность. Для вышеупомянутых самых сильных различий р=0,114, что не является значимым даже без поправки на множественность. Тем не менее, несмотря на статическую недостоверность, с описательной точки зрения такой подход достаточно информативен.
Таким образом, к визиту 3 оба препарата снизили абдоминальную боль, при том что доля пациентов со снижением боли на 30–39,9% в группе тримебутина оказалась более многочисленной (28,0 против 16,2%). В то же время доля пациентов со снижением боли 50,0–59,9% в группе кАТ была больше, чем в группе тримебутина (17,6 против 9,3%).
При анализе степени снижения боли по ВАШ на визите 5 были выявлены следующие особенности. Доля пациентов группы кАТ, у которых к этому визиту боль снизилась менее чем на 30%, составила 5,5%. В эту выборку вошли те индивиды, у кого боль снизилась на величины 0–9,9 и 10,0–19,9% (1,4 и 4,1% соответственно; рис. 8). При анализе данных пациентов группы тримебутина, у которых боль снизилась менее чем на 30% к визиту 5, было выяснено, что у 6,7% больных боль снизилась на величину в диапазоне 0–9,9%, у 2,7% – в диапазоне 10,0–19,9%, а у 6,7% снижение боли находилось в диапазоне 20,0–29,9% (рис. 8). Доли пациентов со снижением боли на 30% и более в группах кАТ и тримебутина достоверно различаются (р<0,05; рис. 1, 8).
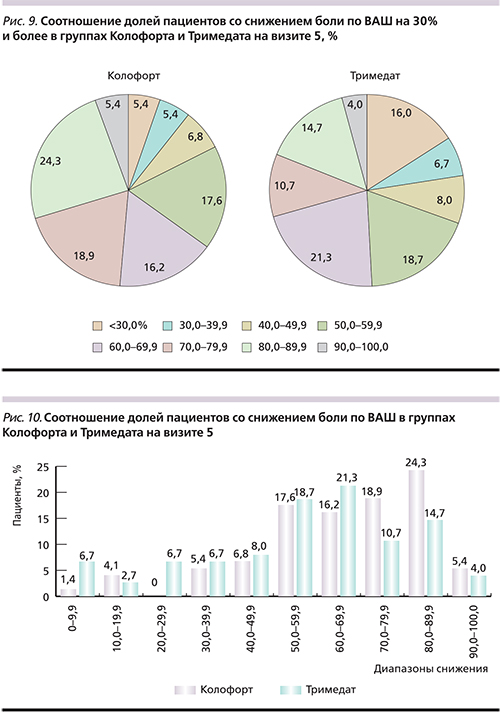
Среди пациентов группы кАТ, у которых боль снизилась на 30% и более к визиту 5, преобладают те, у кого снижение боли составляет величину в диапазоне 80,0–89,9% (24,3%; [рис. 1, 7]). Диапазоны значений степени снижения боли по ВАШ (50,0–59,9; 60,0–69,9; 70,0–79,9%) имеют примерно равные доли пациентов (17,6; 16,2; 18,9% соответственно), как и диапазоны 30,0–39,9, 40,0–49,9 и 90,0–100,0% (5,4; 6,8; 5,4% соответственно; рис. 9).
При анализе данных пациентов группы тримебутина, у которых боль снизилась на 30% и более к визиту 5, было отмечено, что у большинства (21,3%) больных снижение боли находилось в диапазоне 60,0–69,9%, у 18,7% – в диапазоне 50,0–59,9% (рис. 9).
На визите 5 также обнаружились максимальные различия: диапазон – 80,0–89,9% и разница между препаратами – 24,3/14,7% (рис. 10). В этой паре сравнения р превысило 0,0045, а для признания различия достоверным оно должно быть ниже этого значения.
Таким образом, кАТ оказался достоверно эффективнее тримебутина по первичному критерию эффективности (доля пациента со снижением боли по ВАШ на 30 % и более) через 12 недель терапии: кАТ и тримебутин продемонстрировали в целом сопоставимую эффективность в купировании болевого синдрома в зависимости от типа СРК. Так например, кАТ показал способность снижать болевой синдром на 70–89,9% в 43,2% случаев через 12 недель терапии; тримебутин в течение этого периода снижал болевой синдром на 50–69,9% в 40% случаев.
Представленные результаты, вероятно, можно объяснить постепенным нарастанием клинического эффекта кАТ на протяжении курса терапии, в то время как у тримебутина развивается более быстрый клинический эффект, который доходит до определенного уровня и далее не нарастает. В тот же период кАТ продолжает «набирать обороты», необходимые для купирования ведущих проявлений СРК, в т.ч. абдоминального болевого синдрома.
За время наблюдения нами не было зарегистрировано побочных эффектов и случаев непереносимости исследуемых препаратов, что говорит о благоприятном профиле безопасности последних.
Таким образом, кАТ может с успехом применяться пациентами с СРК различных типов с целью купирования абдоминального болевого синдрома.



