Введение
Функциональные заболевания кишечника (ФЗК) клинически проявляются нарушениями частоты и консистенции стула в сочетании (или без) с болью в животе, связанной с дефекацией [1]. Согласно Римскому консенсусу IV 2016 г., к ФЗК относятся синдром раздраженного кишечника (СРК), функциональная диарея, функциональный запор. Этиология их неизвестна, а патогенез объясняется нарушениями висцеральной чувствительности и моторики кишечника, которые вызываются дисфункцией центральной нервной системы, кишечной микрофлоры и иммунной системы [2]. Основанием для отнесения их к функциональной патологии служит отсутствие в кишечнике морфологических изменений, которыми можно было бы объяснить имеющиеся клинические симптомы.
С теоретических позиций чисто функциональной патологии не может быть в принципе, т.к. функция органа всегда служит отражением структурных изменений. Поэтому отсутствие морфологических изменений в кишечнике при перечисленных выше заболеваниях, по данным обычной световой микроскопии, еще не исключает их наличия на более высоком уровне. Он может приближаться к молекулярному, поэтому возможности их выявления определяются развитием соответствующих технологий. Кроме того, перечисленные клинические симптомы наблюдаются и при нарушениях кишечного пищеварения, обусловленных дефицитом мембранных ферментов в слизистой оболочке тонкой кишки (СОТК) [3].
Цель исследования: оценить активность дисахаридаз у больных клиническими симптомами ФЗК.
Методы
Обследовали 102 больных ФЗК. Критериями включения служили положения Римского консенсуса IV 2016 г. К критериям исключения отнесены пациенты с «тревожными симптомами» (ректальные кровотечения, похудение, анемия, лихорадка, ночная симптоматика, начало болезни в возрасте старше 50 лет) и врожденной непереносимостью дисахаридаз.
Возраст пациентов находился в пределах 18–50 лет. Мужчин было 41, женщин – 61. В зависимости от особенностей клинической картины у 35 из них диагноз соответствовал СРК с преобладанием диареи, у 16 – СРК с преобладанием запоров, у 14 – СРК смешанного типа, у 33 – функциональной диарее и у 4 – функциональному запору. Длительность болезни у 14 (13,7%) больных находилась в пределах от 6 месяцев до года, у 49 (48,0%) – от 1 года до 5 лет, у 19 (18,7%) – от 5 до 10 лет и у 20 (19,6%) – от 10 до 23 лет.
Появление первых симптомов у 23 (22,5%) больных связывали с перенесенной острой кишечной инфекцией (ОКИ), у 9 (8,8%) – с особенностями режима питания, у 6 (5,9%) – с приемом нестероидных противовоспалительных препаратов (НПВП) и у 14 (13,7%) – с терапией антибиотиками. Связь со стрессовыми ситуациями отметили 35 (34,4%) пациентов. Остальные 15 (14,7%) больных не смогли связать появление симптомов с какими-либо факторами.
При сборе анамнеза особое внимание уделяли переносимости пищевых продуктов, их влиянию на формирование желудочно-кишечных симптомов. Лабораторные и инструментальные исследования проведены в объеме стандартов и алгоритмов диагностики ФЗК. Инструментальные исследования помимо рентгеноскопии тонкой кишки, колоноскопии, ультразвукового исследования (УЗИ) органов брюшной полости включили эзофагогастродуоденоскопию с биопсией (3–5 фрагментов) СОТК, полученной из залуковичного отдела двенадцатиперстной кишки. Выполнены биохимическое исследование активности кишечных (мембранных) карбогидраз и гистологическая оценка слизистой оболочки двенадцатиперстной кишки. В гистологических препаратах оценивали высоту кишечных ворсин, глубину крипт и их соотношение. В препаратах, окрашенных PAS-реакцией, оценивали состояние щеточной каймы энтероцитов. Обращали внимание на присутствие в эпителии бокаловидных клеток и межэпителиальных лимфоцитов, а также панетовских клеток в глубине крипт.
Активность карбогидраз, расщепляющих лактозу, крахмал и солод, определяли по методу А. Далквиста [4]. Исследование проведено в два этапа, на первом осуществлен гидролиз субстрата. Освободившуюся глюкозу определили по методу Триндера с помощью спектрофотометра [5]. Об активности дисахаридаз судили по интенсивности окраски, которую измеряли на спектрофотометре с длиной волны 495 нм. Активность ферментов выражали в нанограммах освобожденной глюкозы на 1 мг ткани в минуту (нг/глюкозы/мг ткани×мин).
В контрольную группу включили 20 практически здоровых людей в возрасте 23–47 лет, обследованных в порядке углубленной диспансеризации. Условием включения в эту группу стало отсутствие у них симптомов непереносимости пищевых продуктов и заболеваний органов пищеварения. Результаты исследования карбогидраз у лиц контрольной группы представлены в табл. 1.

Активность лактазы в среднем составила 57,6±27,7 нг глюкозы/мг ткани×мин и изменялась в пределах от 17 до 148 нг, активность глюкоамилазы в среднем составила 618,5±315,7 нг/глюкозы/мг ткани×мин и изменялась в пределах от 100 до 1571 нг. Активность мальтазы находилась в пределах от 558 до 1323 нг/глюкозы/мг ткани×мин и в среднем составила 852,3±248,5 нг, сахаразы – от 91 до 348 нг/ глюкозы/мг ткани×мин и в среднем была равной 176,2±77,1 нг. Эти показатели были приняты нами за норму.
Статистическую обработку данных проводили с использованием компьютерной программы «STATISTICA 6.0». Для определения значимости различий между средними величинами при нормальном распределении совокупностей применяли t-критерий Стъюдента. Различия считали значимыми при уровне вероятности р<0,05. При оценке данных, не отвечавших нормальному распределению, использовали непараметрические методы с применением критерия Манна–Уитни, Краскела–Уоллиса и χ2.
Результаты иследования
При сборе анамнеза и жалоб установлено, что кишечные симптомы у большинства больных связаны с употреблением в пищу продуктов, содержащих углеводы. Наиболее часто метеоризм, диарея и боли в животе появлялись после употребления продуктов, содержащих молоко (47,0%) и картофельный крахмал (34,3%), реже – сахар (27,0%).
Рентгенологические и эндоскопические исследования подтвердили отсутствие патологических изменений кишечника и других органов пищеварения у больных, что соответствует критериям ФЗК.
Гистологическое исследование биоптатов СОТК проведено всем обследованным. У большинства из них соотношение высоты ворсин и глубины крипт превышало 3:1, а число межэпителиальных лимфоцитов не превышало 20 на 100 энтероцитов, т.е. было в пределах нормы. Контуры щеточной каймы были четкими, а в глубине крипт выявлено много панетовских клеток. Тем не менее покровный эпителий имел черты, позволившие предполагать дистрофию, у некоторых больных он был местами десквамирован. Собственная пластинка, как правило, была умеренно инфильтрирована лимфоцитами и плазмоцитами. Все это позволяло исключать патогистологические признаки болезней тонкой кишки, хотя и давало основание интерпретировать эти изменения как слабовыраженный дуоденит.
В табл. 2 показана активность ферментов у больных в зависимости от особенностей клинической картины. В 1-ю группу включены 68 пациентов с диареей (СРК+функциональная диарея), во 2-ю группу – 20 больных с запорами (СРК+функционалный запор), в 3-ю группу – 14 пациентов с СРК смешанного типа.

Активность ферментов у больных варьировалась в значительных пределах, но в среднем во всех группах оказалась значительно ниже нормы. В табл. 3 показана частота снижения дисахаридаз в группах больных. Нормальная активность карбогидраз установлена у 11 (10,8%) из 102 человек. У 58 (56,9%) отмечено снижение от 1 до 3 ферментов, у 33 (32,3%) – всех дисахаридаз. Особенно часто ферментативная активность снижалась у пациентов с диареей: из 68 у 21 (30,9%) обнаружено снижение всех, у остальных – 1–3 ферментов. Из 20 больных с запорами у 7 (35%) активность дисахаридаз была нормальной, у 9 (45,0%) отмечено снижение всех, у 4 (20,0%) – некоторых из них. У пациентов с СРК смешанного типа активность карбогидраз была нормальной у 4 (28,6%) из 14, у остальных оказалась сниженной, не достигнув статистически значимых показателей.
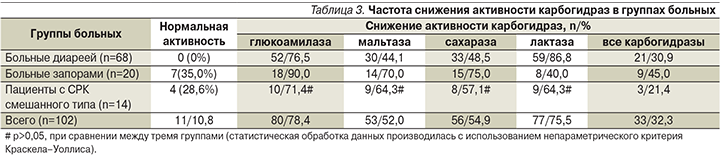
Таким образом, у 91 (89,2%) из 102 больных с клиническими симптомами ФЗК установлено нарушение мембранного пищеварения тонкой кишки в форме дисахаридазной недостаточности. На основании полученных данных у больных установлена энтеропатия с нарушением мембранного пищеварения (дисахаридазная недостаточность). На рис. 1 представлена схема патогенеза этого заболевания. Как можно видеть, ОКИ, лекарства и другие возможные факторы внешней среды повреждают эпителиоциты СОТК.

В результате снижается синтез ферментов, обеспечивающих окончательный гидролиз белков, углеводов, жиров, и в полости тонкой кишки задерживаются короткоцепочечные углеводы, пептиды и липиды. Они вызывают повышение осмотического давления в полости кишки и служат питательной средой для кишечной микрофлоры [3]. Это способствует появлению избыточного бактериального роста (ИБР) и функциональных нарушений со стороны кишечника. При этом, как правило, отмечается связь с употреблением тех или иных пищевых продуктов.
На рис. 2 показана схема лечения пациентов с энтеропатией подобного типа. Основу лечения составляет диета с ограничением легкоусвояемых углеводов. В рационе ограничивали углеводы, для гидролиза которых требовались соответствующие дисахаридазы. При недостаточности сахаразы ограничивали сахар, больным с недостаточностью глюкоамилазы и мальтазы рекомендовали уменьшить употребление продуктов, содержащих крахмал, больным гиполактазией – молоко и кисломолочные продукты.
Медикаментозное лечение включало кишечные антисептики (метронидазол, эрсефурил, интетрикс или др.) с целью подавления ИБР. Их назначали на 7–10 дней, затем рекомендовали курсы терапии комбинированным пробиотиком, состоящим из Bifidobacterium longum 107 и Enterococcus faecium 107 в дозе 3 капсулы в сутки, в течение 14 дней и более. По нашим данным, применение их в составе комплексной терапии приводит к восстановлению эубиоза в тонкой кишке, нормализации метаболизма лактозы и купированию клинических проявлений лактазной недостаточности [7]. При диарее одновременно назначали вяжущие, антисептические, обволакивающие, адсорбирующие и нейтрализующие органические кислоты препараты (смекта, дерматол, белая глина и др.). Больным запорами назначали Дюфалак, Экспортал, Мукофальк и другие средства, стимулирующие дефекацию.
По согласованию с локальным этическим комитетом и Ученым советом МКНЦ им А.С. Логинова в настоящее время проводится пилотное исследование влияния ребамипида на пищеварительную функцию СОТК больных энтеропатией с дисахаридазной недостаточностью, ассоциированной с НПВП.
Ребамипид (Ребагит) назначали в дозе 100 мг 3 раза в день.
Результаты лечения оценивали в процессе динамического наблюдения через 2, 4, 8 и 12 недель. У всех больных отмечено постепенное улучшение. К концу 2-й недели у 74,3% больных частота стула составила 1 раз в 1–2 дня, боли в животе прекратились или значительно уменьшились у 33,8% больных, вздутия живота прекратились у 20,3% или уменьшились у 32,4% больных.
Четверо пациентов с исходно сниженной активностью дисахаридаз к настоящему времени закончили рекомендованный 3-месячный курс лечения ребамипидом и отметили уменьшение болей и вздутий живота, у них расширился диапазон продуктов питания, не вызывающих симптомов непереносимости; оба стали прибавлять в весе. На рис. 3 представлены результаты исследования активности дисахаридаз у двух из них. У больной Ш. 47 лет активность глюкоамилазы повысилась с 20 до 30, мальтазы – с 422 до 737, сахаразы – с 4 до 56, лактазы – с 2 до 6 нг/мг/мин. У больной Я. 25 лет эти показатели составили 16 и 132; 298 и 590; 32 и 64; 2 и 7 нг/мг/мин соответственно. Таким образом, у больной Ш. активность глюкоамилазы увеличилась на 50%, мальтаза – на 74%, сахаразы – на 1300%, лактазы – на 300%, а у больной Я. – на 725, 200, 200 и 350% соответственно.

Следовательно, длительное (3-месячное) применение ребамипида восстанавливает нарушенную функцию сахаразно-изомальтазного и глюкоамилазно-мальтазного комплексов, обеспечивающих мембранный гидролиз углеводов.
Обсуждение
Согласно современной теории пищеварения, созданной А.М. Уголевым в 1960-х гг., окончательный гидролиз олигосахаридов осуществляется лактазой, мальтазой, сахаразой, глюкоамилазой и трегалазой. Эти ферменты синтезируются эпителиоцитами СОТК, располагаются на мембране щеточной каймы и непосредственно связаны с переносчиками продуктов гидролиза – моносахаридов. Такой «пищеварительно-транспортный ансамбль» (по выражению А.М. Уголева) осуществляет заключительные стадии ассимиляции пищевых веществ в тонкой кишке. Снижение активности ферментов ведет к накоплению в просвете тонкой кишки олиго- и мономеров, которые, являясь питательной средой для микроорганизмов, способствуют ИБР в просвете тонкой кишке. Подавление ферментативной активности вызывают ОКИ, НПВП, антибиотики и другие агенты, повреждающие эпителиальный слой тонкой кишки, в котором синтезируются ферменты, обеспечивающие мембранный этап пищеварения.
У больных ФЗК структура СОТК по данным световой микроскопии не изменена или ограничивается умеренными воспалительно-дистрофическими повреждениями эпителиоцитов.
Работы, посвященные изучению кишечных ферментов при СРК, в основном касаются лактазной недостаточности. G. Farup et al. сообщили о высокой частоте дефицита лактазы в СОТК больных СРК и отметили положительный эффект от соблюдения элиминационных диет [6]. Ранее нами у больных СРК с гиполактазией обнаружена обратная корреляция между концентрацией водорода в выдыхаемом воздухе и степенью дефицита лактазы в биоптатах СОТК и восстановление ее активности под влиянием пробиотической терапии [7].
Недостаточность сахаразы изучали главным образом педиатры, отметившие ее связь как с наследственной предрасположенностью, так и с повреждением СОТК при различных заболеваниях, психологических стрессах, употреблении некоторых препаратов [8, 9].
T.J. Parker et al. [10] не заметили существенного улучшения у 27% больных СРК с лактазной недостаточностью, соблюдавших безлактозную диету.
С учетом проведенного нами настоящего исследования отсутствие терапевтического эффекта можно объяснить снижением активности и других карбогидраз, исследование которых не входило в задачу этой работы.
Положительный эффект лечебного питания при ФЗК недавно получил подтверждение благодаря предложенной диете с низким содержанием углеводов FODMAP (the low fermentable, oligosaccharides, disaccharides, monosaccharides and polyols diet) [11]. Уменьшение в рационе углеводов, состоящих из двух (дисахариды) и более (до 10) остатков моносахаридов, оказывает положительный лечебный эффект у больных СРК с диареей. Авторы объясняют его уменьшением бродильных процессов и газообразования [12, 13].
На основании имеющихся сведений пока невозможно сделать окончательный вывод о механизмах долговременной пользы низкоуглеводных диет. Для этого следует продолжить исследования, направленные на достижение соответствия пищевых компонентов гидролитическим возможностям мембранных ферментов тонкой кишки. Основанием служит настоящее исследование, позволившее связать причину кишечной симптоматики с уменьшением активности мембранных ферментов СОТК. Следует продолжить исследования, направленные на достижение соответствия пищевых компонентов гидролитическим возможностям мембранных ферментов тонкой кишки. Также перспективным представляется поиск агентов, улучшающих пищеварение и всасывание в тонкой кишке. Одним из таких направлений может быть исследование возможностей современных гастро- и энтеропротекторов, например ребамипида. Ребамипид относится к производным хинолинов. Химическое наименование – N-(4-хлорбензоил)-3-(2-оксо-1,2-дигидрохинолин-4-ил) аланин. Брутто-формула ребамипида – C19 H15 Cl N2 O4. Этот агент индуцирует синтез эндогенных простагландинов Е2 и GI2 и тем самым улучшает кровоток в слизистой оболочке желудка и кишечника. По данным мета-анализа ряда рандомизированных исследований, ребамипид оказался высокоэффективным в профилактике и лечении НПВП-индуцированных повреждений желудка и тонкой кишки [14, 15]. Как показали первые результаты нашего исследования, ребамипид при длительном применении стимулирует активность мембранных ферментов, обеспечивающих гидролиз дисахаридов и, следовательно, может найти применение в патогенетической терапии энтеропатий, сопровождающихся нарушением кишечного (мембранного) пищеварения.
Заключение
Для 91 (91,2%) из 102 больных с клинической картиной ФЗК причиной симптомов стала дисахаридазная недостаточность, развившаяся после ОКИ, антибиотикотерапии, НПВП или других повреждающих агентов. Следовательно, вместо синдромного диагноза у этих больных может быть установлена энтеропатия с нарушением мембранного пищеварения, ассоциированная с тем или иным повреждающим агентом.
Основу лечения энтеропатии, связанной с недостаточностью дисахаридаз, должны составлять: а) малоуглеводная диета, направленная на уменьшение нагрузки на ферментные системы тонкой кишки; б) пробиотики, повышающие активность лактазы, а возможно, и других мембранных ферментов; в) кишечные антисептики, подавляющие ИБР в тонкой кишке. Новым направлением терапии может быть длительное применение ребамипида, способного повышать активность мембранных ферментов вследствие протекторного действия на структуру СОТК.



