Дефиниция и классификация
Согласно Римскому консенсусу третьего пересмотра (Римские критерии-III, 2006), синдром раздраженного кишечника (СРК) – это функциональное расстройство кишечника, при котором боль или дискомфорт в животе ассоциированы с дефекацией, изменением частоты и консистенции стула или другими признаками нарушения опорожнения кишечника. Данные нарушения должны выявляться в течение не менее 3 дней в месяц на протяжении 3 месяцев за прошедший год [1].
Традиционно выделяют четыре клинических подтипа СРК в зависимости от доминирующего симптома:
- СРК с запорами (твердый или фрагментированный стул ≥ 25 %, жидкий или водянистый стул < 25 % всех актов дефекации);
- СРК с диареей (жидкий или водянистый стул ≥ 25 %, твердый или фрагментированный стул < 25 % всех актов дефекации);
- Смешанная форма СРК (твердый или фрагментированный стул ≥ 25 %,
- жидкий или водянистый стул ≥ 25 % всех актов дефекации);
- Неклассифицированный подтип СРК.
Эпидемиология
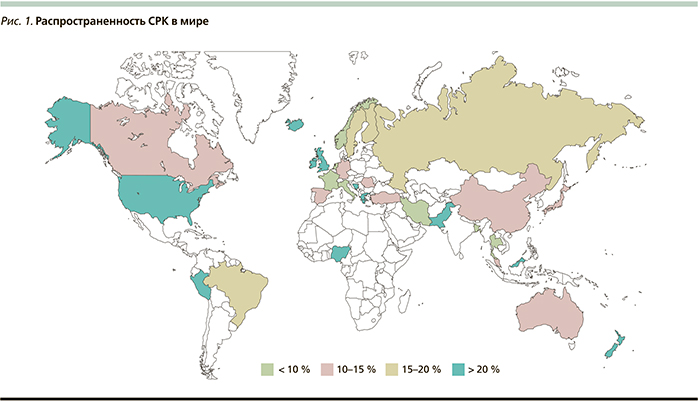
Согласно различным эпидемиологическим исследованиям, распространенность СРК в зависимости от региона мира варьируется от 5 до 25 % (рис. 1) [2, 3]. Согласно одному из последних мета-анализов, СРК страдают 11,2 % популяции мира [4]. Женщины в 1,5–3,0 раза чаще, чем мужчины, подвержены данной патологии [3]. До 50 % пациентов с СРК – это лица младше 35 лет [4, 5].
Этиология и патогенез
К настоящему времени этиология СРК остается неизвестной.
Предполагается, что в возникновении заболевания и его клинических проявлениях могут играть роль следующие факторы [2, 6]:
- генетическая предрасположенность;
- перенесенные кишечные инфекции;
- нарушения микробиоты кишечника;
- альтерация локальных иммунологических процессов кишечника;
- психосоциальные факторы (стрессовые ситуации, депрессивные и тревожные расстройства, эмоциональное/физическое/сексуальное насилие);
- диетические факторы (продукты из пшеницы, молочные продукты, цитрусовые, картофель, лук и шоколад).
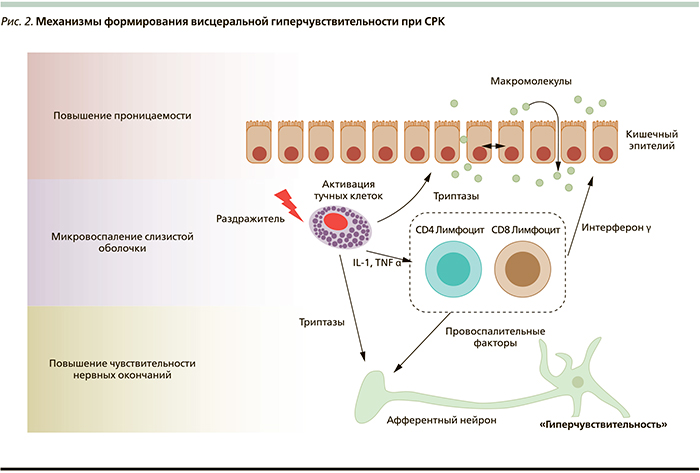
Различные механизмы гетерогенного характера вовлечены в патогенез СРК, среди которых выделяют нарушения моторной активности кишечника и формирование феномена висцеральной гиперчувствительности [2, 6–8]. Висцеральная гиперчувствительность рассматривается как ведущий патофизиологический компонент СРК, приводящий к нарушению двигательной активности кишечника и, соответственно, появлению клинических проявлений (боли/дискомфорта в животе, диспепсии) [6, 9]. Этот феномен выявляется среди 50–60 % пациентов c СРК [2, 10]. Причины формирования висцеральной гиперчувствительности у пациентов с СРК продолжают изучаться. По наиболее распространенной гипотезе данный патофизиологический механизм индуцируется цепочкой событий, связанных с повышением проницаемости слизистой оболочки кишечника и активацией ряда иммунокомпетентных клеток [11, 12]. Последние, вырабатывая ряд цитокинов, оказывают влияние на чувствительность нервных окончаний слизистой оболочки, тем самым индуцируя возникновение феномена висцеральной гиперчувствительности (рис. 2).
Немаловажное значение в последнее время придается так называемому постинфекционному СРК (ПСРК). Перенесенное воспаление слизистой оболочки кишки при кишечной инфекции изменяет висцеральную сенсорику и часто предшествует началу симптомов в группе пациентов с ПСРК. Даже легкий бессимптомный острый колит может вызывать длительную висцеральную гипералгезию при наличии дополнительных стимулов [2, 7, 8].
Клиническая картина
Клиническая картина СРК варьируется в зависимости от подтипа заболевания. Тем не менее достоверно установлено, что основным клиническим проявлением СРК независимо от его формы служит болевой абдоминальный синдром. Боль локализуется вокруг пупка или внизу живота и имеет различную интенсивность. Характерно уменьшение интенсивности или купирование боли после акта дефекации или флатуляции (отхождения газов) [13, 14].
Нарушение стула отмечается у каждого второго пациента с СРК и выражается в появлении диареи или запора. Для диареи наиболее характерно возникновение после еды, чаще в первой половине дня; частота дефекаций колеблется от 2 до 4 раз за короткий период времени [2, 8]. Достаточно характерными остаются императивные позывы к дефекации, существенно снижающие качество жизни пациентов, ограничивающие их социальную активность.
В случае СРК с преобладанием запоров возможны «овечий» кал, стул в виде карандаша, а также пробкообразный стул (выделение плотных оформленных каловых масс в начале дефекации, а затем кашицеобразный или в ряде случаев водянистый стул) [15]. Нередко пациенты испытывают чувство неполного опорожнения кишечника. К другим клиническим признакам СРК можно отнести массу слизи в стуле, а также метеоризм. У пациентов, страдающих СРК, метеоризм обычно усиливается к вечеру, нарастает перед дефекацией и уменьшается после нее [16]. Для СРК характерны также негастроэнтерологические симптомы: головная боль, ощущение внутренней дрожи, боли в спине, ощущение неполного вдоха.
Диагностика
При расспросе пациента важным считается установление триггерных факторов возникновения симптоматики заболевания (перенесенные кишечные инфекции, психосоциальные нарушения и диетические погрешности). СРК нередко протекает на фоне других функциональных расстройств желудочно-кишечного тракта, в частности функциональной диспепсии [17].
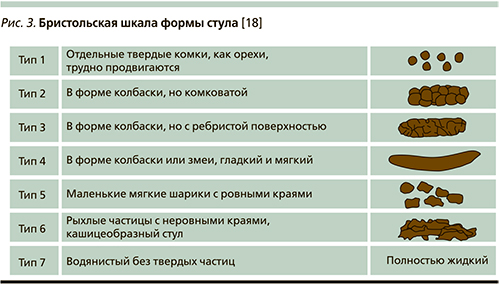
Согласно общепризнанным представлениям, при постановке диагноза и разделении больных на типы СРК исследователи и практические врачи должны руководствоваться Бристольской шкалой формы стула (рис. 3), использовать типы 1-й и 2-й форм стула для идентификации запора и типы 6-й и 7-й форм стула – для идентификации диареи [18].
В целом диагностический алгоритм при СРК базируется на установлении соответствия пациента диагностическим критериям (в соответствии с дефиницией Римского консенсуса-III) и исключения симптомов «тревоги» как ориентиров органической патологии [1, 8, 19]. СРК является диагнозом исключения, поэтому своевременное и полное обследование пациентов – необходимое условие его постановки.
При прицельном опросе у пациента должны исключаться симптомы «тревоги», делающие диагноз маловероятным, к которым относят:
- ректальные кровотечения, наличие макро- и микропримесей крови в кале;
- снижение массы тела пациента;
- хроническая диарея;
- анемия и другие изменения в анализах крови;
- лихорадка;
- начало болезни у лиц старше 50 лет;
- рак и воспалительные заболевания кишечника у родственников;
- ночная симптоматика.
Лечение
К основным целям терапии пациентов с СРК относятся достижение клинической ремиссии и восстановление социальной активности больного [15]. В рамках терапии СРК фундаментальная роль принадлежит установлению доверительных взаимоотношений врача с пациентом [20].
 Пациентам с невыраженной и перемежающейся симптоматикой, не влияющей на качество жизни, рекомендуется изменить стиль жизни и диету, не применяя фармакотерапию.
Пациентам с невыраженной и перемежающейся симптоматикой, не влияющей на качество жизни, рекомендуется изменить стиль жизни и диету, не применяя фармакотерапию.
Пациентам с СРК рекомендовано исключить продукты, усиливающие газообразование (например, бобовые, лук, сельдерей, морковь, изюм, бананы, абрикосы, чернослив, брюссельскую капусту, проростки пшеницы, крендельки и баранки), а также алкоголь и кофеин-содержащие напитки [21]. Повышенное газообразование через реализацию феномена висцеральной гиперчувствительности может индуцировать усиление симптоматики у пациентов с СРК [22].
Рекомендуется диета со сниженным содержанием ферментируемых олиго-, ди-, моно- и полисахаридов – FODMAP-(Fermentable, Oligo, Di, Mono аnd Polyol)-диета. Данные короткоцепочечные углеводы плохо всасываются и осмотически активны в просвете кишечника, где они быстро ферментируются, вызывая симптомы вздутия живота и боли [23]. FODMAP-диета подразумевает исключение продуктов с высоким содержанием FODMAP (например, продуктов, которые содержат фруктозу, включая мед, кукурузный сироп, содержащий множество фруктозы, яблок, персиков, манго, вишни или олигосахаридов, включая зерновые). Снижение выраженности симптоматики СРК при ограничении потребления FODMAP было доказано в ряде исследований [24, 25]. Кроме того, диета должна корригироваться также с учетом часто обнаруживаемой у пациентов с СРК, чаще ПСРК) лактазной недостаточностью разной степени (безлактозная диета, кислотомолочные продукты, фермент лактаза).
При коррекции образа жизни пациента с СРК следует рекомендовать повышение физической активности. Потенциальная польза данной рекомендации выражается в снижении симптоматики заболевания, а также в общей пользе для здоровья больного. В одном рандомизированном исследовании с участием 102 пациентов с СРК было продемонстрировано, что в группе повышенной физической активности через 12 недель отмечена более выраженная положительная динамика в нивелировании симптомов заболевания (43 по сравнению с 26 %, p = 0,07) [26].
Пациентам с СРК со стойкой симптоматикой, существенно снижающей качество жизни, рекомендуется фармакотерапия. При этом выбор последней должен носить дифференцированный характер в зависимости от превалирующей симптоматики СРК [2, 8, 13]. Важное место в терапии СРК у пациентов с выраженным болевым абдоминальным синдромом отводится селективным спазмолитикам: пинаверия бромид (100 мг 3 раза в сутки), мебеверин (200 мг 2 раза в сутки) [14, 27]. В случае СРК с преобладанием запоров помимо традиционных рекомендаций по модификации образа жизни и диеты эффективны осмотические слабительные: лактулоза (10–20 г 2 раза в сутки), а также псиллиум (3, 4 г во время еды 2 раза в сутки с последующей коррекцией дозы) [2, 8, 28, 29]. При СРК с преобладанием диареи рекомендован лоперамид (2–4 мг по требованию) [14].
Ввиду вариабельного паттерна клинического течения СРК до сих пор ведется поиск оптимального препарата, отвечающего принципам многоцелевой терапии. В этом плане интересен новый на нашем рынке препарат Иберогаст, который является лекарственной формой, состоящей из гидроэтаноловых экстрактов девяти трав, разработанной для лечения функциональных расстройств желудочно-кишечного тракта, таких как функциональная диспепсия и СРК. В крупном рандомизированном двойном слепом плацебо-контролируемом исследовании (208 пациентов с СРК) Иберогаст продемонстрировал статистически значимую эффективность в купировании основных симптомов СРК, включая болевой абдоминальный синдром, по окончании периода терапии (4 недели) по сравнению с плацебо [30]. Подобные результаты были продемонстрированы в масштабном неинтервенционном исследовании (2548 пациентов с СРК) [31]. Во всех работах отмечен хороший профиль безопасности препарата [30]. Эффективность Иберогаста в терапии СРК базируется на комплексном действии экстрактивных веществ, входящих в его состав [32, 33]. В экспериментальных исследованиях показано, что Иберогаст стимулирует выработку слизи в кишечнике за счет прямого действия на эпителиоциты и опосредованного действия посредством активации энтерических нейронов, что оказывает положительное влияние на висцеральную гиперчувствительность, за счет снижения афферентной сенситизации кишечника к механическим и химическим стимулам [35]. Просекреторный эффект связан с усилением тока хлоридов в эпителии через трансмембранные молекулы CFTR и CLCA, что улучшает физические свойства содержимого кишечника, облегчая его пассаж по кишке [34]. Препарат нормализует моторику кишечника, оказывая нормокинетическое действие – избирательный спазмолитический и прокинетический эффект, без влияния на участки ЖКТ с нормальной моторикой [36].
Таким образом, препарат Иберогаст может использоваться в комплексной терапии больных с СРК, независимо от его формы. Не исключено, что на ранних стадиях заболевания, наряду с диетой, Иберогаст может применяться и в качестве монотерапии, но это требует дальнейших исследований.



