Актуальность
Псориаз (Пс) – хроническое системное иммуновоспалительное заболевание, которое поражает не только кожу, но и опорно-двигательный аппарат. Пс характеризуется комплексным влиянием факторов внешней среды, генетической предрасположенности, аутоиммунных и аутовоспалительных механизмов, а также спектром клинических проявлений, вариантов течения и исходов [1–3]. Пс встречается в 1–2% случаев среди населения развитых стран [4]. Согласно результатам исследований, у каждого четвертого пациента с Пс развивается псориатический артрит (ПсА) [5]. Отмечается 11%-ный прирост его распространенности в популяции за 2011–2018 гг. [4]. ПсА – хроническое воспалительное заболевание суставов, позвоночника и энтезисов из группы спондилоартритов (СпА). ПсА характеризуется прогрессирующим течением, развитием деструкции и анкилозирования суставов, множественного внутрисуставного остеолиза, спондилита, часто сопровождается разнообразной коморбидной патологией [6]. В среднем ПсА развивается в течение 7 лет от дебюта Пс и со временем может приводить к инвалидизации [7]. Известно, что «поздняя» диагностика ПсА (более 6 месяцев с момента развития ПсА) ассоциируется с существенным ухудшением эффективности терапии [8]. Поэтому в ревматологии и дерматологии все чаще можно слышать о концепции «Окно возможности» (window of opportunity) [9, 10]. Кроме того, увеличение числа случаев тяжелого течения ПсА приводит к выраженному ухудшению качества жизни пациентов, потере трудоспособности и инвалидизации. Поэтому проблема ранней диагностики ПсА все еще весьма актуальна в настоящий момент. Выявление ранних предикторов ПсА врачами-дерматовенерологами и направление таких пациентов на ревматологическое обследование могут помочь решить данную проблему, начать терапию на ранних стадиях и предотвратить инвалидизацию пациентов с ПсА. В настоящей работе мы провели обзор литературы и выполнили мета-анализ, где изучали предикторы развития ПсА. За последние 10 лет отсутствуют мета-анализы и полноценные систематические обзоры на данную тему.
Цель настоящего систематического обзора и мета-анализа: определение способов раннего выявления ПсА, которые позволят в будущем предотвращать прогрессирование болезни и инвалидизацию, а также определение предикторов ПсА.
Методы
Поиск существующей литературы проводился в основных базах данных, таких как PubMed (MEDLINE), EMBASE и Google Scholar за 10 лет – до 20 февраля 2021 г. Поиск текущих зарегистрированных исследований проводился в реестрах клинических исследований США (Clinicaltrials.gov), Китайском регистре клинических исследований (Chinese Clinical Trial Registry), в Международной платформе регистрации клинических исследований ВОЗ (WHO International clinical trial registry platform – ICTRP) Для статей с preprint/pre-proof был произведен поиск в BioRxiv, MedRxiv и ChemRxiv.
Поиск по литературе включил использование ключевых слов согласно классификатору MeSH: «Predictors AND psoriatic AND arthritis», «Predictors AND psoriatic arthritis», «Predictors OR risk factors AND psoriatic arthritis», «enthesitis AND psoriatic arthritis», «nail AND psoriatic arthritis». Условия поиска использовались в различных комбинациях в зависимости от возможностей разных баз данных.
Статистический анализ подготовлен в соответствии с международными рекомендациями для систематических обзоров и мета-анализа (PRISMA). Статистический анализ данных проводили с помощью программы Statistic SPSS 26.0 (США). Для всех факторов в каждой группе рассчитывали абсолютные и относительные значения (процентная представленность). В случаях, когда уровень значимости был р>0,05, считали, что статистически значимых различий между группами не было. В альтернативном случае, когда р≤0,05, считали, что различия между группами статистически значимы.
Мета-анализ подготовлен с использованием программы RevMan-5. Выполнен согласно методическим рекомендациям по проведению метаанализа (ФГБУ «Центр экспертизы и контроля качества медицинской помощи» Минздрава РФ).
Результаты
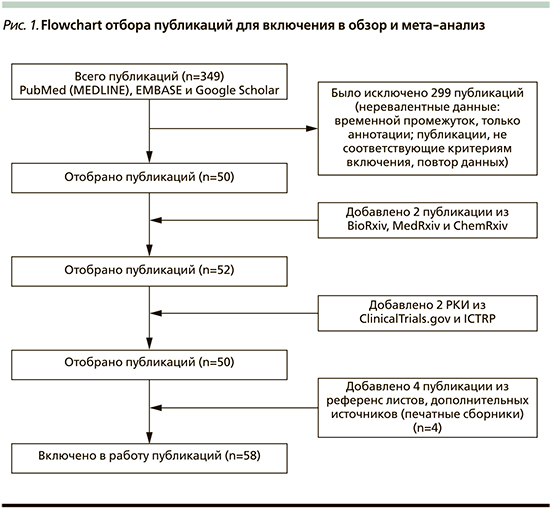
Нами идентифицировано 349 статьей, опубликованных до 20 февраля 2021 г. После дальнейшего анализа из исследования исключено 299 публикаций по причине нерелевантности данных (временной промежуток ранее 2010 г., только аннотации, тезисы, повтор данных, публикации, не соответствовавшие критериям включения). Далее добавлены две публикации на стадии «pre-print» из серверов BioRxiv, MedRxiv, ChemRxiv, а также два исследования с ClinicalTrials.gov и ICTRP. Кроме того, проведен поиск информации в референ-листах, дополнительных источниках (печатные сборники) и включены еще четыре публикации. Всего в обзор и анализ включено 58 статей. Отбор публикаций для включения в систематический обзор и метаанализ представлен на схеме Flowchart (рис. 1). Неоднородность данных в разных исследованиях может включать различия в дизайне исследований и популяциях пациентов, а также в продолжительности периода наблюдения. Также следует указать, что не во всех исследованиях четко проведено различие между факторами риска (ФР) и предикторами ПсА. В нашем анализе мы подразумеваем, что фактор риска – это признак/симптом, который обусловливает лишь большую вероятность развития заболевания, в то время как предиктор – это ранний признак уже точно имеющегося заболевания. К сожалению, во многих публикациях данные термины приравниваются.
Предикторы развития ПсА
Энтезиты
К предикторам возможного развития и(или) неблагоприятного течения ПсА можно отнести воспаление, затрагивающее энтезисы и называемое энтезитом. В настоящее время энтезиты выделяют как форму уже имеющегося ПсА [6]. Энтезисы – места соединения сухожилия, связки и сустава с костью. Данная анатомическая структура помогает сохранять устойчивость к компрессионным и растягивающим силам для сохранения гомеостаза тканей [11]. В энтезиальных участках у нормальных мышей наблюдается вдвойне отрицательная Т-клеточная экспрессия интерлейкина-23 (ИЛ-23R) (CD3+, CD4-, CD8IL23R+-клетки) [12].
Энтезит является ранней стадией воспалительных изменений, диагностируемых при ПсА, и может возникать раньше всех остальных проявлений ПсА.
Вовлечение ногтей
Предполагают, что псориаз ногтевых пластин служит прогностическим фактором к развитию ПсА [13]. Патологии ногтей, по всей видимости, возникают в результате близкой взаимосвязи ногтевой пластины и энтезиса дистального межфалангового сухожилия разгибателя – одного из основных энтезиальных участков, подверженных ПсА. Выделение суставно-энтезиально-ногтевого аппарата как взаимосвязанной структуры подчеркивает важность воспаления в энтезисах при ПсА и помогает понять, почему у пациентов с ПсА, у которых обычно выявляется и энтезит дистального межфалангового сустава, одновременно развиваются и воспалительные патологии ногтевых пластин [14]. Изменения ногтей наблюдаются приблизительно у 40% пациентов с Пс, и этот процент увеличивается примерно до 80% у пациентов с ПсА [15]. Однако, поскольку псориаз ногтей связан с более высокой тяжестью псориаза, их изменения могут не подходить в качестве раннего предиктора ПсА для пациентов с тяжелым Пс [16].
Поражения глаз
Существует ряд публикаций связи ПсА и поражений глаз. Увеит – офтальмологическое проявление нескольких серонегативных спондилоартропатий, таких как анкилозирующий спондилит, реактивный артрит и ПсА. Согласно недавнему мета-анализу, риск возникновения увеита был значительно выше среди пациентов с Пс, чем среди пациентов без Пс (относительный риск [ОР]=1,23, 95% доверительный интервал [ДИ:] 1,05–1,45) [17]. Существует несколько возможных объяснений повышенного риска развития увеита у пациентов с Пс. Во-первых, у них увеличивается общая воспалительная нагрузка вследствие имеющегося псориаза кожи, способная также быть причиной поражения глаз. В водянистой влаге при увеите были обнаружены цитокины, играющие ключевую роль при псориазе: фактор некроза опухоли-а (ФНО-а), ИЛ-2, -6 и -17 [18, 19]. Во-вторых, оба заболевания могут иметь некоторую генетическую предрасположенность, которая в конечном итоге может приводить к аутовоспалительным заболеваниям глаз и кожи. Одним из широко известных примеров является HLAB27, как известно, связанный как с ПсА, так и с увеитом [20, 21].
Аксиальные поражения
Аксиальные (осевые) поражения встречаются среди 25–70% пациентов с ПсА [22, 23]. Общие симптомы включают воспалительную боль в спине (боль в покое, которая улучшается после физической активности, усиливается утром). У пациентов с ПсА значительно снижается подвижность шейного отдела позвоночника и боковые сгибания в течение 5 лет в отсутствие лечения [24]. По некоторым исследованиям, аксиальные поражения при ПсА чаще возникают у молодых пациентов <40 лет [25]. Большинство пациентов с ПсА и аксиальными поражениями имеют предшествующий Пс кожи, однако есть исследования, где у небольшого процента пациентов (около 15%) с Пс кожи на момент диагностирования аксиальных поражения не было [26]. Около 20% пациентов с ПсА не отмечают выраженных симптомов аксиальных поражений [24, 27]. Клинические факторы риска аксиальных поражений: тяжелые формы Пс кожи, молодой возраст начала Пс, тяжелый периферический артрит [28]. Согласно исследованиям, эрозии периферических суставов чаще встречались среди пациентов с осевыми поражениями [29]. Значимым фактором риска аксиальных поражений при ПсА остается наличие HLA-B27 [29]. Пациенты с аксиальным поражением могут и не иметь данного генетического маркера. Однако распространенность осевых поражений у пациентов с HLA-B27 значительно выше, чем без HLA-B27 [30].
Биомаркеры
В настоящее время отсутствуют многочисленные исследования по определению биомаркеров. Ранняя диагностика ПсА предотвращает прогрессирование поражения суставов и приводит к лучшим результатам [31]. Классические маркеры воспаления, такие как С-реактивный белок (СРБ), не определяют клиническое начало или активность заболевания [32]. Выявление биомаркеров может способствовать выявлению пациентов с высоким риском возникновения ПсА. Существуют генетические маркеры, представленные в большей степени у пациентов с ПсА, чем без ПсА. Например, HLA-C, TNFRSF9 и LCE3A были сильнее связаны с Пс без ПсА, тогда как ИЛ-23R и ФНОAIP3 были сильнее связаны с ПсА [33]. При определении профиля экспрессии генов также идентифицировано несколько биомаркеров ПсА, в первую очередь NOTCH2NL, HAT1, CXCL10 и SETD2 [34, 35]. В недавнем проспективном исследовании пациентов с Пс, у которых изначально не было ПсА, также идентифицировали CXCL10 как возможный прогностический маркер ПсА [34]. Протеомные анализы синовиальной жидкости и биоптатов кожи идентифицировали панель белков, которые отличают ПсА от Пс без ПсА. CD5L, ITGβ5, M2BP, MPO, MMP-3, и CRP являются маркером ПсА, а комбинация ITGβ5, M2BP и CRP отличает ПсА от Пс без ПсА [36].
До недавнего времени не было описано аутоантител, характерных для ПсА. Однако последние исследования идентифицировали аутоантитела к LL37 и ADAMTSL5, с помощью которых можно дифференцировать пациентов с ПсА от пациентов без ПсА [37, 38]. Также были идентифицированы антитела против «пептида ПсА» TNRRGRGSPGAL [39].
Аффинноочищенные антитела против этого пептида распознают фибриллин, десмоколлин, кератин и N-RAP, белок, локализованный в области энтеза. Антитела к пептиду ПсА выявляются у 85% пациентов с ПсА и только у 3,3% пациентов с Пс без ПсА [40]. В нескольких исследованиях изучались биомаркеры повреждения суставов при ПсА. Возможные маркеры повреждения суставов включают продукты распада коллагена (Col2-3/4Clong mono, Col2-3/4Cshort или C-пропептид), DKK-1, M-CSF, RANKL, кальгранулин (S100A8 / S100A9), A-SAA и предшественники остеокластов [41, 42]. В другом исследовании протеомный анализ идентифицировал MPO, M2BP, DEFA1, H4, H2AFX, ORM1, CD5L, PFN1 и C4BP, а также MMP3, S100A9 и CRP как потенциальные маркеры ПсА [43]. Аналогичным образом в исследовании Cretu et al. протеомный анализ образцов кожи, взятых на биопсию, также выявил SRP14, ITGB5, POSTN, SRPX, FHL1, PPP2R4, CPN2 и GPS1 как потенциальные маркеры ПсА [44].
Мета анализ
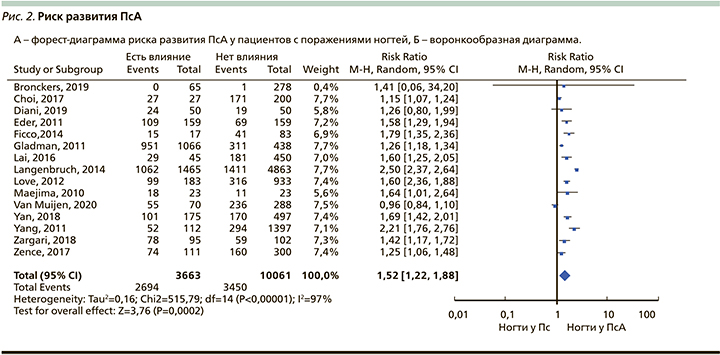
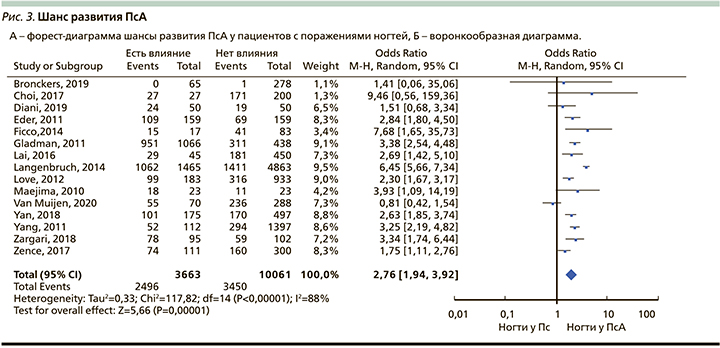
При проведении мета-анализа были взяты предикторы, которые сможет распознать на приеме врачдерматовенеролог, а именно поражение ногтевого аппарата. В наш метаанализ было включеныо 15 исследований за последние 10 лет (2010–2020) [16, 45–58]. Суммарно объем выборки составил 13 724 пациента. При этом отмечено статистически значимое возрастание рисков (ОР) развития ПсА (в 1,52 раза; 95% ДИ: 1,22–1,88) (рис. 2А). Отмечена высокая статистическая гетерогенность (I2=97). В этом случае метаанализ проводился на основе модели со случайным эффектом. Однако при построении воронкообразной диаграммы публикационного смещения не наблюдалось (диаграмма симметрична) (рис. 2Б). Кроме того, со статистической значимостью в 2,76 раза возрастали не только риски развития ПсА, но и шансы (ОШ) на развитие ПсА (95% ДИ: 1,94–3,92) (рис. 3А). В данном случае статистическая гетерогенность I2 составляла 80%, публикационного смещения не наблюдалось (рис. 3Б).
Заключение
Таким образом, Пс и ПсА являются многофакторными заболеваниями, при которых резко снижается качество жизни пациентов. В таком случае очень важно распознавать ПсА на ранней стадии и начинать лечение. На дерматологическом приеме в качестве предиктора ПсА можно рассматривать поражение ногтей, поэтому дерматологам очень важно оценивать не только гладкую кожу. Кроме того, раннее распознавание аксиальных поражений также поможет в диагностике ПсА, тем самым предупредив развитие тяжелых форм и инвалидизации. Дерматологическая оценка пациентов с Пс представляет собой возможность предотвращения серьезных функциональных расстройств, улучшая качество жизни пациента. Однако все еще мало информации и публикаций, изучающих важную роль предикторов ПсА. Необходимо проведение дальнейших исследований для более глубокого понимания данной проблемы.
Вклад авторов. Все авторы принимали участие в разработке концепции статьи и написании рукописи. Окончательная версия рукописи была одобрена всеми авторами.
Финансирование. Исследование не имело спонсорской поддержки.



