Введение
Интерес к реабилитации при болезни Паркинсона (БП) значительно увеличился за последние два десятилетия. Если посмотреть базу данных PubMed, то число статей, посвященных этой теме, прогрессивно увеличивается начиная с 2000-х гг. (146 статей по запросу «rehabilitation in Parkinson’s Disease»), особенно за последние несколько лет (в 2018 г. – 501 статья).
Такой интерес, вероятнее всего, обусловлен многими факторами, из которых, как нам представляется, наиболее важными являются увеличение продолжительности жизни людей, стремление повысить ее качество; а также привлечение все большего внимания к вопросам немедикаментозного лечения в связи с существующими ограничениями фармакотерапии БП. Кроме того, наблюдаемый технический прогресс связан с разработкой новых методов и оборудования для нейрореабилитации пациентов с БП.
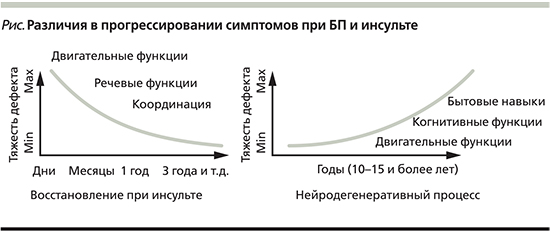
Медицинская реабилитация в настоящее время в РФ закреплена в качестве неотъемлемой составляющей медицинской помощи (Приказ МЗ РФ № 1705н от 29.12.2012). Она разделена на три важных этапа, первый из которых осуществляется в острый период заболевания или травмы, второй и третий этапы – в ранний и поздний восстановительные периоды, выделяется также период остаточных явлений заболевания [1]. Такой подход крайне важен для пациентов после инсульта или травмы, когда процесс реабилитации и восстановления начинается уже в первые часы и дни в условиях реанимации и направлен на восстановление нарушенных или компенсацию утраченных функций за счет нейрональной пластичности – т.н. восстановительная реабилитация [2–5]. Для пациентов с хроническими нейродегенеративными заболеваниями, в частности для больных БП, стратегия реабилитации будет отличаться, поскольку по мере прогрессирования заболевания происходит постепенная утрата двигательной активности, прогрессирует нарушение ходьбы, постуральная неустойчивость. Процесс реабилитации пациентов этой категории будет направлен не на скорейшее восстановление функций, а на поддержание еще сохранных функций, профилактику ограничения физической активности (см. рисунок), это т.н. профилактическая и поддерживающая реабилитация [6].
Необходимо отметить, что цели реабилитационной программы на разных стадиях БП также будут различаться. Так, на ранних стадиях (1–2-я по Hoehn-Yahr) основная цель профилактики – поддержание высокой двигательной активности; тогда как на развернутых стадиях (4–5-я по Hoehn-Yahr), когда появляются уже существенные ограничения физической активности, основной целью является улучшение позы, походки, улучшение баланса, профилактика падений. Что касается поздней стадии БП, то здесь играет роль профилактика падений, травм, пролежней, пневмонии и других нарушений [7–9].
Исследований, посвященных реабилитации пациентов на поздних стадиях, крайне мало, в последнее время все больше публикаций появляется о паллиативной помощи (ПП) пациентам с БП. Проблематично своевременное выявление пациентов с БП и их потребностей в ПП. Отсутствие конкретной отправной точки затрудняет определение потребностей в этой помощи в течение заболевания. Считается, что индикатораом необходимости ПП при БП может служить появление эпизодов аспирации, галлюцинаций, регулярных падений, деменции [10].
Между тем известно, что пациенты с БП испытывают значительный дискомфорт в конце жизни; бремя их симптомов сопоставимо с таковым у пациентов с онкологическими заболеваниями [11, 12]. В отличие от пациентов со злокачественными заболеваниями лишь немногие больные БП и члены их семей, обеспечивающие уход, получают ПП [13–15], а реабилитации при ПП не уделяется должного внимания.
Таким образом, если в настоящее время вопросы постинсультной реабилитации урегулированы и в ряде регионов страны проходят пилотные проекты благодаря деятельности Союза реабилитологов России, то реабилитация пациентов с нейродегенеративными заболеваниями, в частности с БП, все еще является прерогативой отдельных центров, занимающихся данной проблемой; при этом тарифы обязательного медицинского страхования (ОМС) не покрывают всех расходов на реабилитацию.
Исследования, посвященные вопросам реабилитации при БП
Тем не менее в последние годы ряд исследований продемонстрировал положительный эффект реабилитации в виде улучшения двигательной и повседневной активности и качества жизни как на ранних, так и на развернутых стадиях БП [16–19],
В последнем руководстве NICE от 2017 г. [20], посвященном ведению пациентов с БП, физическая (двигательная), оккупационная (эрготерапия), логопедическая коррекция, а также ряд других нефармакологических методов лечения были рекомендованы для использования пациентами с БП. За последние несколько лет были опубликованы и отдельные руководства по двигательной реабилитации [21], оккупационной терапии [22], а также логопедической коррекции [23]. В 2018 г. в РФ были утверждены клинические рекомендации по реабилитации при БП и синдроме паркинсонизма (https://rehabrus.ru/).
Интересные данные представлены в ряде научных статей по применению этих рекомендаций на практике в разных странах. Так, в Нидерландах была разработана уникальная инновационная модель оказания специализированной помощи пациентам с БП – ParkinsonNet [24, 25], включающая междисциплинарные команды специально обученных и подготовленных специалистов, участвующих в ведении пациентов по всей стране. В данной модели была оценена эффективность специализированной реабилитации на большой базе данных (2129 пациентов с БП) в течение 3 лет по сравнению с пациентами, посещающими общего физиотерапевта (2252 пациента). Было показано преимущество специализированной реабилитации: качество оказанной медицинской помощи было выше, число осложнений, связанных с БП, было более низким, а главное: стоимость такой реабилитации также оказалась ниже в реальной практике [25].
Еще одно крупное национальное исследование, проведенное в Южной Корее, показало, что число посещений физического терапевта пациентами БП возросло: начиная с 384 пациентов в 2004–2006 гг. до 1221 в 2013–2015 гг. [26]. Однако, несмотря на это, в течение 3-летнего периода более 60% больных БП не получили физиотерапию и 80% – оккупационную терапию. Коэффициент использования физиотерапии в течение 2013–2015 гг. в этом исследовании составил около 60% от показателя, зарегистрированного в Нидерландах за тот же период [25].
Отсутствие реабилитационных учреждений и опытных терапевтов в Южной Корее да и в других странах может быть одной из причин отсутствия изменений в степени использования реабилитационной терапии. Медицинские расходы на реабилитационные методы лечения, которые требуются для пациентов с БП, в Корее относительно невелики из-за национальной службы обязательного медицинского страхования (NHIS). Тем не менее в данной работе отмечено, что уровень использования реабилитационной терапии был значительно хуже у пациентов с низким доходом по сравнению с пациентами с более высоким доходом [26].
По данным разных исследований, опубликованных в последнее время в разных странах, показано, что только 28% больных БП получают физиотерапию в Чехии [27], 60% в Нидерландах [24]. В США только 14% пожилых пациентов с БП, имевших страховку Medicare, получали реабилитационную терапию в течение года [28]. Анализируя результаты данных работ, становится понятным, что применение реабилитационной терапии пациентов с БП может различаться на практике даже в развитых странах.
Кроме того, существуют заметные различия в образовательных программах послевузовского образования врачей по физиотерапии в России и Европе [29], что отмечено и в клинике. Только в последнее время начинает внедряться Международная классификация функционирования (МКФ), принятая в 2002 г. и рекомендованная к использованию Всемирной организацией здравоохранения, она является признанным инструментом научной оценки эффективности медицинской реабилитации. Не все методы физиотерапии, применяемые в наших лечебных учреждениях, доказано эффективные, особенно в отношении застываний и постуральной неустойчивости у пациентов с БП.
Однако эта ситуация наблюдается не только в РФ. В исследовании, проведенном в Чехии с 2013 по 2015 г., показано, что также не всегда использовались доказанные методы реабилитации [27].
Методы реабилитации при БП
Тем не менее сегодня понятно, что реабилитация пациентов с БП должна начинаться с самого начала постановки диагноза и продолжаться на протяжении всей жизни [9].
К основным доказанным методам реабилитации, применявшимся в отношении пациентов с БП, относятся:
- Физические упражнения в различных комбинациях [19, 30–33].
- Упражнения цигун [34], китайская гимнастика тай чи [35].
- Тренировки на беговой дорожке [36].
- Баланс-тренинги с помощью стабилометрических платформ [37–41].
- Данстерапия [42–45].
- Силовые упражнения [46–48].
- Аэробный тренинг [36, 49–53].
- Скандинавская ходьба, а также методы коррекции ходьбы с использованием слуховых и зрительных ориентиров [54–55].
- Технологии с биологической обратной связью и виртуальной реальностью [41, 56–60].
- Когнитивная реабилитация [61–63].
Оперативное лечение больных БП
Как уже было сказано выше, БП – это хроническое прогрессирующее заболевание, основными проявлениями которого являются как двигательные (гипокинезия, нарушения ходьбы, изменение осанки, постуральная неустойчивость), так и немоторные нарушения (тревога, депрессия, апатия, нарушения сна) [64], которые также вносят негативный вклад в качество жизни пациентов. На определенном этапе заболевания, когда возможности фармакотерапевтического лечения уменьшаются, у пациентов развиваются моторные флуктуации и лекарственные дискинезии, возникает необходимость в нейрохирургических методах лечения БП, в частности имплантации электродов в субталамическое ядро (STN), внутренний сегмент бледного шара (GPI), таламус (VIM) для хронической стимуляции подкорковых структур.
Нейростимуляция (НС) в настоящее время является высокоэффективным методом лечения БП. Разработка и внедрение в практику этого метода служат важным этапом в лечении БП и приравнивается к открытию леводопы в 1960-х гг., а период после операции часто называют вторым медовым месяцем в терапии БП. Сегодня в мире насчитываются более 140 тыс. пациентов с БП, живущих с имплантированной системой в подкорковые структуры [65].
Нейростимуляция STN позволяет уменьшать степень выраженности дискинезий на 54–76%, тяжесть периода выключения – на 48–71%, а также уменьшать дозу леводопы в 2 раза [66–68].
Показания к направлению пациента с БП на НС: осложнения длительной терапии леводопой, не поддающиеся адекватной медикаментозной коррекции (моторные флуктуации, лекарственные дискинезии); выраженные клинические проявления заболевания вне действия препаратов леводопы (в период «выключения»); тремор, резистентный к фармакотерапии [66–67]. При направлении таких пациентов на операцию необходимо помнить, что длительность заболевания должна быть не менее 5 лет, степень тяжести БП – 2,5 балла и более; также должен сохраняться хороший эффект на фоне применения препаратов леводопы, особенно это важно в отношении стимуляции STN.
В введении пациента БП с имплантируемой системой также важен мультидисциплинарный подход; включение в команду помимо невролога и нейрохирурга, нейропсихолога, реабилитолога и психотерапевта, что позволяет оказывать оптимальную помощь пациенту и его семье.
Отбор пациентов БП на операцию является достаточно сложным процессом и включает постановку неврологом диагноза, определение выраженности двигательных нарушений, степени тяжести заболевания, оптимизацию медикаментозной терапии, тестирование и оценку периода включения и выключения по шкале UPDRS (Unified Parkinson’s Disease Rating Scale), проведение магнитно-резонансной томографии (МРТ) головного мозга (для исключения структурной патологии), нейропсихологический скрининг для исключения когнитивного дефицита, нейрохирургическую оценку для определения показаний и противопоказаний к операции, а также психиатрическую оценку для выявления поведенческих нарушений, кроме того, оценку реалистичных и нереалистичных ожиданий пациентов. Окончательное решение принимается коллективом из вышеперечисленных специалистов [69–70].
К наиболее частым причинам отказа от операции относятся наличие когнитивных нарушений, неоптимизированная медикаментозная терапия, низкий ответ на препараты леводопы, атипичный паркинсонизм и нереалистичные ожидания пациентов. При направлении неврологами пациентов в специализированный центр 1/3 больных было отказано именно по вышеперечисленным причинам [70].
Послеоперационная реабилитация больных БП
Вопросы послеоперационного ведения включают много компонентов, прежде всего необходимость настройки программы стимуляции, подбора медикаментозной терапии, которые играют основную роль в первые месяцы после операции. Часто вопросам реабилитации на этом этапе не уделяется должного внимания. Научные исследования о специфической роли нейрореабилитации в ведении пациентов на фоне НС все еще очень ограничены [71–75].
Одно из таких обсервационных исследований проведено C. Tassorelli et al. [72], по результатам которого оказалось, что в применении реабилитационной программы после имплантации электродов нуждались 45,3% пациентов; это практически половина больных. Пациенты были разделены по группам в зависимости от потребности в реабилитационной программе: первая группа, которая нуждалась в реабилитации в течение первого месяца после операции, вторая группа – пациенты, которым потребовалась реабилитация в течение от месяца до года, и третья группа – пациенты, обратившиеся через год после операции. Протокол двигательной реабилитации включал различные последовательности упражнений, направленные на улучшение двигательных навыков, ходьбы, координации, коррекции постуральных нарушений. Каждый компонент реабилитационной программы был в максимально возможной степени подтвержден литературными данными.
Кроме того, использовались упражнения для тренировки ходьбы со зрительными и звуковыми сигналами.
В качестве зрительных стимулов были использованы полосы цветной ленты на полу, перпендикулярные направлению движения, расположенные на расстоянии 40 или 50 см друг от друга. Слуховые стимулы состояли из музыкальных ритмических пьес, которые звучали в плейере пациента. Сеансы реабилитации проводились пять дней в неделю в течение 4–8 недель [72].
Дизартрию и дисфонию лечили интенсивными тренировками, основанными на голосовой терапии Ли Сильвермана. Были получены положительные результаты от каждого пациента по сравнению с дооперационным уровнем, по данным шкалы UPDRS. В первой группе больных отмечалось значительное повышение функциональной независимости, тогда как в двух других группах такого значительного изменения не наблюдалось. Не было выявлено существенных различий между группами пациентов, получавших визуальные или слуховые сигналы. Никаких существенных улучшений не наблюдалось и в отношении постурального контроля во второй и третьей группах [72].
Трудности научной оценки ранней постоперационной реабилитационной программы заключаются в том, что на фоне положительного влияния нейростимуляции оценить эффект реабилитации достаточно сложно. Поэтому в данном протоколе у первой группы стимулятор был выключен и в период оценки не проводилось коррекции медикаментозной терапии. В данном исследовании было показано, что в раннем послеоперационном периоде реабилитация требуется лишь небольшому числу (17,6%) пациентов. Аналогичные данные встречаются и в других работах [71–72].
Еще в одном ретроспективном исследовании была проанализирована частота и необходимость дальнейших корректировок программы стимуляции и лекарственной терапии во время такой стационарной реабилитации; была показана польза реабилитации для пациентов [76–77].
Несомненно, в настоящее время существует необходимость в научном обосновании и проведении контролируемых исследований и разработке конкретных целей реабилитации в ближайшем будущем у прооперированных пациентов с БП для достижения наилучшего возможного результата. Возможно, реабилитационные мероприятия должны фокусироваться на симптомах, не реагирующих на нейростимуляцию и медикаментозную терапию.
Для пациентов с имплантированным стимулятором имеются следующие рекомендации и ограничения [78]:
- Следует избегать манипуляций на шее, таких как массаж, а также чрезмерных физических нагрузок на этот отдел и резких поворотов.
- Не поднимать более 3–4 кг в первый месяц после операции.
- Ограничения в использовании МРТ (не менее 1,5 Т).
- Проход через электромагнитные ограничители могут приводить к выключению стимулятора.
- Проведение диатермии (терапия короткими волнами, микроволнами) пациентам с имплантированным нейростимулятором противопоказано.
Психосоциальная адаптация больных БП
Еще один важный аспект реабилитации – это социальная и психологическая подготовка к операции и адаптация пациентов с БП к жизни с нейростимулятором. У части пациентов, несмотря на улучшение моторных симптомов, имела место плохая психосоциальная адаптация после операции НС STN [79–83].
Шесть исследований выявили такие проблемы [79–84], как ухудшение взаимодействия между супругами или другими членами семьи, осуществляющими уход за пациентом до операции, потерю жизненной цели борьбы с болезнью для пациентов, которые много лет идентифицировали эту цель как основную. Необходимость вернуться в послеоперационном периоде на работу или оказывать большую помощь по дому, когда на них вновь были возложены прежние «здоровые» ожидания, «снова жить нормально», для некоторых пациентов представляло определенные трудности. Операция для некоторых партнеров имела глубокие последствия для брака, с одной стороны, в борьбе за свою автономию часть пациентов отказались от своих супругов, с другой – мужья/жены пациентов рассматривали восстановление после операции как шанс разорвать свои отношения и освободиться от роли опекуна [84].
Несомненно, это не основные трудности, с которыми связан послеоперационный период для пациентов БП, однако данные таких исследований не стоит игнорировать. Необходимо понимать, что нейрохирургическое лечение – это стрессовое жизненное событие, поэтому, возможно, необходимо включать в реабилитационную программу и занятия с психологом по психологической и социальной подготовке и поддержке пациентов и членов их семей до и после операции [84].
Заключение
Таким образом, реабилитационные мероприятия играют значительную роль в ведении пациентов с БП как на ранних, так и на развернутых и поздних стадиях болезни. Включение в протокол послеоперационного ведения на фоне стимуляции подкорковых структур программ реабилитации для получения лучших результатов такого лечения играет важную роль. Несомненно, необходимо стремиться к применению более доказанных методов реабилитации и обучению специалистов полидисциплинарных команд – неврологов, нейрохирургов, реабилитологов, кинезиотерапевтов, психологов и других специалистов, принимающих участие в реабилитации, особенностям ведения пациентов с БП.



