Повреждения спинного мозга (СМ) крайне плохо поддаются восстановлению и, несмотря на достижения хирургии позвоночника, обеспечивают высокий процент инвалидизации. Причина в недостаточной способности к регенерации аксонов центральной нервной системы (ЦНС), составляющих проводящие пути СМ [1, 2]. В связи с невозможностью удовлетворительного восстановления неврологического дефицита при спинальных повреждениях особое значение приобретают реабилитационные методики, помогающие развить и улучшить функциональные возможности пациента [3, 4]. При этом процесс реабилитации длителен и трудоемок, состояние пациента на фоне восстановительного лечения может меняться в сторону улучшения, ухудшения или не демонстрировать динамики, что делает весьма актуальным вопрос о возможности предсказания течения восстановительного периода.
В отношении пациентов с повреждениями СМ традиционно применяются нейрофизиологические методы исследования: стимуляционная и игольчатая электронейромиография (ЭНМГ), транскраниальная магнитная стимуляция (ТКМС), соматосенсорные вызванные потенциалы мозга (ССВП) [4, 5]. Эти методики помогают уточнить топику и глубину спинального повреждения, а в ряде случаев (отсутствие кортикальных ответов на ССВП при стимуляции периферического нерва, отсутствие вызванных моторных ответов [ВМО] при кортикальной ТКМС) указывают на плохой прогноз восстановления [5, 6].
Известно, что эффективность реабилитационного лечения зависит от давности заболевания: в ранние сроки и при более раннем начале восстановительного лечения его эффективность выше. Таким образом, целью настоящего исследования стало сравнение нейрофизиологических параметров сегментарного (по данным ЭНМГ) и надсегментарного (по даннным ТКМС) моторного проведения пациенткам с различными сроками повреждений СМ.
Материал и методы
Обследованы 2 группы пациентов с повреждениями СМ: 1-я – с давностью заболевания <1 года, 2-я – с давностью заболевания 1–2 года. Первая группа включила 50 пациентов, 26 мужчин и 24 женщины (средний возраст – 42,6±17,8 года), из них 30 (60%) с позвоночно-спиномозговыми травмами, 20 (40%) с другими спинальными поражениями (4 – эпидуриты, 4 – спинальные инсульты, 6 – пациенты, оперированные по поводу вертеброгенной миелопатии, 6 – пациенты, оперированные по поводу опухолей СМ). Давность заболевания в 1-й группе составляла от 1 до 10 месяцев, в среднем – 6,4±2,5 месяца. Вторая группа включила 48 пациентов, 32 мужчины и 16 женщин (средний возраст – 40,2±14,6 года), из них 30 (62,5%) с позвоночно-спиномозговыми травмами, 18 (37,5%) с другими спинальными поражениями (4 – эпидуриты, 2 – спинальные инсульты, 2 – пациенты, оперированные по поводу вертеброгенной миелопатии, 10 – пациенты, оперированные по поводу опухолей СМ).
У всех включенных в исследование больных клинически выявлено поражение проводников СМ в виде нижнего спастического парапареза различной степени выраженности. Среди больных 1-й группы были 26 человек с миелопатией шейного и 24 – с миелопатией грудного уровня, среди больных 2-й группы – 14 и 34 соответственно.
Все пациенты поступили на курс восстановительного лечения в реабилитационный центр. Уровень и тяжесть поражения СМ оценивались по классу ASIA, функциональный дефицит – по шкале функциональной независимости, адаптированной для пациентов со спинальными повреждениями (VFM). Оценивалось наличие или отсутствие динамики по этим шкалам за период курса реабилитации (1–2 месяца). Сорок (40,8% от общего числа) больных поступили на повторный курс реабилитации и снова были подвергнуты нейрофизиологическому обследованию.
Нейрофизиологическое исследование проводилось при поступлении. Методом стимуляционной ЭНМГ оценивались параметры проведения по задним большеберцовым нервам (n. tibialis) – амплитуда и дистальные латентности (ДЛ) М-ответов, скорость распространения возбуждения (СРВ) по нерву, минимальная и максимальная латентности F-ответов, СРВ максимальная по F-волне, форма М- и F-ответов. Методом ТКМС оценивалось наличие ВМО в мышцах нижних конечностей – четырехглавой мышце бедра (m. quadricepsfemoris), передней большеберцовой мышце (m. tibialisanterior), мышце, приводящей большой палец стопы (m. abductorhallucis). При наличии ВМО оценивались параметры проведения – латентности и амплитуды ВМО, время центрального моторного проведения (ВЦМП) для m. аbductorhallucis и m. tibialisanterior.
Статистический анализ полученных данных проведен с помощью программ Microsoft Excel и Biostat. Данные в таблицах представлены в виде среднего арифметического и среднего квадратичного отклонения (M±σ), для отдельных параметров – в виде медианы и межквартильного интервала (Me [25%; 75%]). Использовались непараметрические критерии: межгрупповые различия оценивались по критерию Манна–Уитни; у пациентов, обследованных повторно, данные двух обследований сравнивались по критерию Вилкоксона. Различия считались статистически значимыми при p<0,05.
Результаты
При сравнении 1-й и 2-й групп по вышеуказанным нейрофизиологическим параметрам достоверных межгрупповых различий не выявлено.
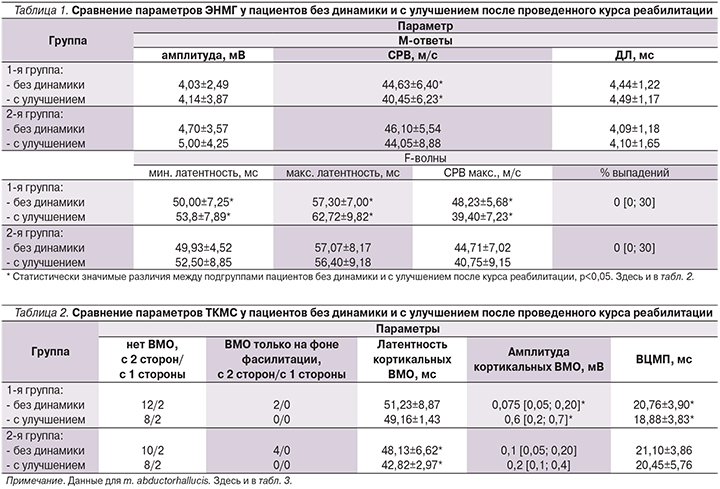
Интересные данные получены при сравнении внутри групп пациентов с динамикой и без динамики в результате проведенного курса реабилитации. В 1-й группе у 28 (56%) пациентов динамики в неврологическом и функциональном статусах на фоне курса реабилитации не отмечено, у 22 (44%) больных выявлено улучшение. У пациентов с улучшением и без динамики выявлены достоверные различия в скоростных параметрах ЭНМГ – СРВ по n. tibialis (p<0,05), минимальной и максимальной латентности F-волны (p<0,05); наиболее выраженные различия получены по параметру СРВ, максимальная – по F-волне (p=0,001). У пациентов с улучшением отмечено уменьшение СРВ и увеличение латентностей по сравнению с больными, не продемонстрировавшими динамики (табл. 1). Во 2-й группе у 26 (54,2%) пациентов динамики в результате проведенного курса восстановительного лечения не отмечено, у 22 (45,8%) выявлено улучшение. В этой группе тоже отмечена тенденция к удлинению латентностей F-волны и сокращению СРВ по М-ответам и F-волне (табл. 1), но достоверных межгрупповых различий не получено.
По данным ТКМС, различий в числе пациентов с наличием и отсутствием кортикальных ВМО с мышц нижних конечностей в зависимости от динамики на фоне восстановительного лечения не было (табл. 2). У пациентов с наличием кортикальных ВМО с мышц нижних конечностей и положительной динамикой на фоне реабилитации в 1-й группе выявлены достоверно большие амплитуды кортикальных ВМО и достоверно меньшее ВЦМП (p<0,03), чем у пациентов без динамики. Во 2-й группе у больных с большей давностью заболевания при наличии положительной динамики выявлена достоверно меньшая латентность кортикальных ВМО (p=0,04; табл. 2).
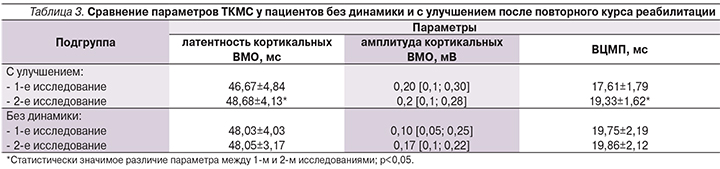
Часть (всего 40) пациентов поступили на повторный курс реабилитации и снова прошли нейрофизиологическое исследование, в 1-й группе в среднем через 2,7±1,4 месяца, во 2-й – через 9,2±5,2. При этом между курсами реабилитации положительная динамика выявлена у 22 (55%) обследованных больных, отсутствие динамики – у 18 (45%). У пациентов с наличием динамики в неврологическом и функциональном статусе выявлено статистически значимое увеличение латентности кортикальных ВМО (p=0,03) и ВЦМП (p<0,05; табл. 3), у пациентов без динамики – статистически значимое нарастание СРВ (43,13±5,28 и 45,32±5,82 м/с соответственно, p<0,05) и сокращение ДЛ (5,00±0,91 и 4,79±0,85 мс соответственно, p<0,05).
Обсуждение
Возможность предсказывать течение заболевания и воздействие на него реабилитационных мероприятий крайне важны с клинической и экономической точек зрения. В данной работе предпринята попытка использовать для этого данные нейрофизиологических методов обследования. При этом принято во внимание отсутствие корреляции между нейрофизиологическими показателями и неврологическим и функциональным статусом, фокус работы сосредоточен именно на динамике состояния в результате курсов реабилитации.
Для пациентов с повреждениями СМ наиболее важны показатели надсегментарного проведения по проводникам (аксонам) СМ. В данном исследовании моторное надсегментарное проведение по кортикоспинальным путям исследовалось методом ТКМС. Полученные данные ожидаемы: у пациентов с меньшим ВЦМП, меньшей латентностью и большей амплитудой кортикальных ВМО, т.е. лучшей функциональной сохранностью кортикоспинальных путей, чаще отмечается положительная динамика в результате реабилитации.
Также важны параметры сегментарного проведения. Функциональная активность мотонейронов переднего рога и двигательных единиц меняется на фоне снижения супрасегментарного контроля, что отражают показатели ЭНМГ [7]. У пациентов с миелопатиями часто снижаются амплитуда М-ответов и СРВ по периферическим нервам, изменяются параметры поздних моторных ответов – F-волн и Н-рефлексов, что служит нейрофизиологическим отражением спастического синдрома [7, 8]. В данном исследовании у пациентов с положительной динамикой на фоне реабилитации выявлено снижение СРВ по М-ответам и особенно выраженное по F-ответам, увеличение латентностей F-ответов. То, что подобное изменение ЭНМГ-параметров выявлнено в группе больных с анамнезом заболевания до 1 года, неудивительно: пациенты с меньшим «стажем» болезни более чувствительны к реабилитационным мероприятиям, обладают большей нейропластичностью. Интересно, что скоростные показатели ЭНМГ в группе пациентов с лучшим восстановлением изменяются именно в сторону снижения, что еще раз указывает на отсутствие прямой корреляции между нейрофизиологическими параметрами и клиническими данными.
Интересны и результаты динамического обследования. У пациентов с динамикой (положительной) в неврологическом и функциональном статусе нарастают латентности кортикальных ответов и ВЦМП, что было показано нами ранее [9, 10] и может отражать резорбцию остатков миелина в месте повреждения, тормозящих регенерацию аксонов [11–13]. У пациентов с динамикой в неврологическом и функциональном статусе также не отмечается нарастания СРВ по периферическим нервам, что было показано нами ранее [9, 10].
Заключение
Таким образом, в ходе проведенного исследования выявлены определенные нейрофизиологические предикторы динамики неврологического и функционального статуса у пациентов с миелопатиями на фоне реабилитационных мероприятий. У пациентов с положительной динамикой выявляется снижение скоростных параметров по данным ЭНМГ, особенно по параметрам F-волн и при относительно малой давности заболевания (до 1 года), изначально лучшие показатели кортикоспинального проведения по данным ТКМС. При динамическом обследовании у больных с наличием положительной динамики выявляются признаки резорбции тормозящих регенерацию аксонов в месте повреждения остатков миелина – нарастание латентностей кортикальных ВМО и ВЦМП. Для более точного определения прогностической ценности нейрофизиологического обследования для пациентов с миелопатиями необходимы дальнейшие исследования с более строгим формированием клинических групп и большим числом участников.



