При злокачественных опухолях нередко возникают нарушения минерального обмена и структуры костей. К наиболее тяжелым осложнениям опухолевого процесса относятся метастазы в кости, которыми страдают до 1,5 млн человек в мире, при этом погибают ежегодно до 500 тыс. Нередко возникают такие нарушения, как остеопороз и гиперкальциемия. Эти поражения утяжеляют течение болезни, создают угрозу жизни пациента, ухудшают ее качество и увеличивают стоимость лечения. Наиболее часто кости поражаются при таких опухолях, как рак молочной железы (РМЖ) и рак предстательной железы до 75 %, немелкоклеточный рак легкого 40 %, а также при раке щитовидной железы, мочевого пузыря, почки, неходжкинских лимфомах и множественной миеломе [1]. Продолжительность жизни больных костными метастазами определяется наличием других органных метастазов и чувствительностью опухоли к специфическому противоопухолевому лечению. Остеопороз может возникать на фоне противоопухолевой терапии. В этом случае используется термин CTIBL (cancer treatment induced bone loss – снижение костной массы, обусловленное противоопухолевым лечением).
Нормальное костеобразование или ремоделирование костей происходит на протяжении всей жизни человека: остеокласты резорбируют, а остеобласты формируют новую костную ткань.
Патофизиологический механизм костного метастазирования одинаков при всех злокачественных новообразованиях и связан с усилением остеокластогенеза и костной резорбции. Три белка, относящихся к семейству туморнекротического фактора: RANK, RANK-лиганд (RANKL) и OPG (остеопротегерин), образуют сигнальный путь и отвечают за остеокластогенез, костную резорбцию и нормальное ремоделирование костей [2]. Рецептор RANK экспрессируется остеокластами костного матрикса; RANKL и OPG – остеобластами. RANKL соединяется с рецептором RANK и активирует его, после чего через систему сигнальных путей TRAF рецепторы RANK активируют ряд ядерных факторов, в первую очередь транскрипционный фактор Каппа-В (NFkB), отвечающий за созревание, функционирование и выживание остеокластов. В результате запускается процесс костной резорбции.
В норме OPG связывает часть RANK-лигандов, играя роль «ловушки» для них. Тем самым регулируется активность остеокластов и процесс костной резорбции, происходит повышение плотности костей или репарация [3].
При метастазах в кости злокачественных опухолей существует теория «порочного круга». Опухолевые клетки, попадая в кость гематогенным путем, закрепляются в ней и начинают создавать благоприятное микроокружение, вырабатывая ряд ростовых факторов и биологически активных веществ [4]. Главный среди них – паратгормоноподобный пептид. Эти вещества усиливают экспрессию RANKL, происходит активация рецепторов RANK и ядерного фактора NFkB, что ведет к усилению костной резорбции. В результате выделяются биологически активные вещества, ростовые факторы и ионизированный кальций, которые усиливают пролиферацию опухолевых клеток и рост метастазов. Круг замыкается [5].
У больных с костными метастазами могут возникать различные осложнения – т. н. события, связанные со скелетом или костные осложнения (skeletal related event – SRE). К ним относятся: 1) патологические переломы, в т. ч. позвоночника с компрессией позвонков; 2) компрессия спинного мозга; 3) появление или усиление болевого синдрома; 4) необходимость проведения паллиативных оперативных вмешательств или лучевой терапии; 5) гиперкальциемия [6, 7].
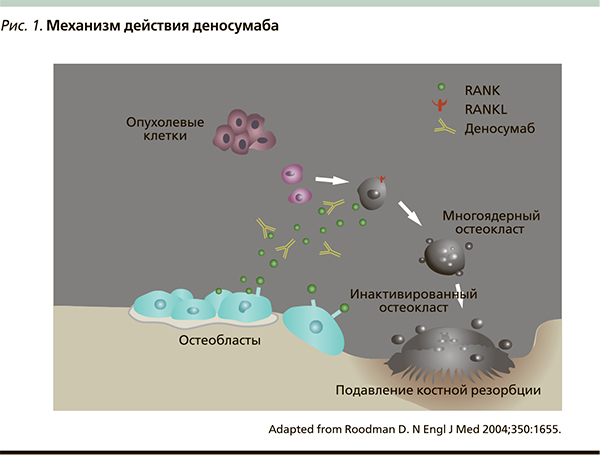
Для лечения костных метастазов используется мультидисциплинарный подход, который включает специфическое противоопухолевое лечение – химио- и/или гормональную, лучевую терапию, хирургические пособия, анальгетики и т. н. остеомодифицирующие агенты.
Препараты группы бисфосфонатов (БФ) – первые остеомодифицирующие агенты – применяются в лечении костных метастазов более 30 лет [8]. Они являются аналогами натурального пирофосфата костного матрикса и действуют на уровне остеокластов. Нарушают образование цитоскелета и препятствуют адгезии опухолевых клеток к костным балкам. Бисфосфонаты подавляют остеолитическую активность остеокластов и стимулируют их естественную гибель – апоптоз, тем самым нарушая «естественное» течение патологического процесса, предотвращая рост опухоли и дальнейшее разрушение костной ткани [9]. Группа азотсодержащих препаратов является более активной. Наиболее эффективна в указанной группе золедроновая кислота (ЗК), которая содержит два атома азота.
Исследования ЗК, проведенные за рубежом, установили ее способность достоверно снижать риск костных осложнений при РМЖ на 41 %, раке простаты на 36 %, раке легкого и других солидных опухолях на 31 % [10, 11].
В большинстве случаев лечение БФ начинают сразу после постановки диагноза. По мнению зарубежных онкологов, раннее начало реально снижает риск скелетных осложнений и улучшает качество жизни пациентов.
В ряде случаев можно отложить начало введения БФ до появления симптомов болезни, в частности, у больных РМЖ с поражением внутренних органов и минимальными костными метастазами. Вопрос длительности применения БФ пока не ясен. Существует мнение, что препараты этой группы следует назначать практически до конца жизни пациента, но часто используется такой стандарт, как 2 года. Ретроспективный анализ показал, что до 50 % больных раком молочной железы, имеющих достаточно высокую продолжительность жизни, получают БФ 5 лет и более. Этот вопрос решается индивидуально для каждого пациента.

В настоящее время БФ входят в стандарт лечения метастазов в кости любых злокачественных опухолей [12].
Благодаря развитию биотехнологий из клеток яичника китайского хомячка был получен деносумаб – первый остеомодифицирующий препарат с принципиально новым механизмом действия, способный прерывать «порочный круг» костного метастазирования. Это полностью человеческое моноклональное антитело, обладающее высокой аффинностью и специфичностью к человеческому RANKL [13]. Связываясь с RANKL, деносумаб предотвращает его взаимодействие с рецептором RANK на поверхности остеокластов и как следствие – активацию NFkB, что подавляет процесс созревания, функционирования и выживания остеокластов – единственного типа клеток, ответственных за костную резорбцию. В результате деносумаб уменьшает резорбцию и деструкцию костной ткани, действуя аналогично натуральному белку OPG. Механизм действия деносумаба представлен на рис. 1.
Клинические исследования деносумаба начались около 15 лет назад, и к настоящему времени действие препарата исследовано при различной патологии костей: метастазах в кости злокачественных опухолей, остеопорозе у лиц пожилого возраста, а также при раннем РМЖ на фоне адъювантной гормонотерапии ингибиторами ароматазы и у мужчин при гормонорезистентном РПЖ на фоне антиандрогенной терапии.
В клинических исследованиях оценивается уровень биохимических маркеров костной резорбции, в частности N-телопептида коллагена I типа – NTх, и ряда других. Эти маркеры, отражая взаимодействие опухоли и кости, имеют важное прогностическое значение, т. к. их повышенный уровень означает риск возникновения скелетных осложнений и смерти [14].
В рутинной клинической практике эти маркеры обычно не определяются.
При I фазе клинического изучения деносумаба у больных с костными метастазами различных злокачественных опухолей, которым препарат вводился с эскалацией дозы от 0,1 до 3,0 мг/кг подкожно (п/к), была установлена быстрая абсорбция всех доз и снижение уровня маркера костной резорбции uNTх в течение одного дня. Период полувыведения деносумаба составил 30–46 дней. Серьезных побочных реакций и гипокальциемии не наблюдалось. Нейтрализующие антитела к препарату не выявлены [15].
В 2007 г. Lipton и соавт. представили результаты рандомизированного клинического исследования II фазы с активным контролем больных с костными метастазами РМЖ [16]. Сравнивалось пять режимов п/к введения деносумаба со стандартным в/в введением ЗК. Оценивались фармакинетика и фармакодинамика деносумаба, уровень снижения uNTх (в пересчете на креатинин), частота SRE, а также безопасность лечения. Оптимальным признан режим введения деносумаба по 120 мг п/к 1 раз в 4 недели [17]. Снижение uNTх > 65 % от исходного уровня в группе деносумаба наблюдалось у 74 % пациентов, в группе ЗК – у 63 %. Скелетные осложнения в ходе исследования возникли в группе деносумаба у 9 %, в группе ЗК – у 16 % больных. При анализе нежелательных явлений нарушений биохимических показателей (креатинин, печеночные ферменты, электролиты) не наблюдалось ни в одной группе, так же как остеонекроза нижней челюсти. В целом по частоте побочных реакций группы не различались. Авторы делают вывод о сходной эффективности деносумаба по сравнению с ЗК в подавлении маркеров костной резорбции и снижении риска развития костных осложнений. В другом рандомизированном исследовании II фазы при метастазах в кости различных злокачественных опухолей у больных с повышенным уровнем uNTх, несмотря на предшествующее лечение БФ, деносумаб также сравнивался с ЗК [18]. Отмечено более выраженное снижение uNTх в группе пациентов, получавших деносумаб, – у 78 % больных по сравнению с 29 % в группе больных, получавших ЗК (р < 0,001). Кроме того, отмечено, что костные осложнения в группе деносумаба возникали позже.
Таким образом, исследования II фазы выявили преимущество исследуемого препарата по сравнению с ЗК в отсрочке костных осложнений и снижении уровня маркера костной резорбции uNTX, а также благоприятный профиль токсичности. Ранние клинические исследования не выявили образования нейтрализующих антител к деносумабу.
В 2010 г. на ESMO А.Lipton предоставил результаты интегрального анализа 3 рандомизированных клинических исследований III фазы, выполненных по единому дизайну [19]. Больные были рандомизированы в группу деносумаба (120 мг п/к 1 раз в 4 недели) или в группу ЗК (4 мг в/в 1 раз в 4 недели). Кроме того, все пациенты получали плацебо п/к или в/в, а также Са и витамин D ежедневно внутрь. Всего включены 5726 больных, имевших один или более метастазов в костях: РМЖ – 2049; рак предстательной железы – 1901; другие солидные опухоли и множественная миелома – 1776. Около 40 % из каждой группы уже имели костные осложнения до включения в исследование, некоторые из них ранее получали БФ. Оценивалось время до первого в ходе исследования SRE (тест равной эффективности); время до первого и последующих в ходе исследования SRE (тест на превосходство), а также ряд дополнительных параметров, включая безопасность лечения, влияние на болевой синдром и общую выживаемость. При проведении исследований допускалась любая противоопухолевая химио- или гормонотерапия.
Интегральный анализ подтвердил, что основная цель всех исследований достигнута. Деносумаб не уступает ЗК по задержке времени до первого скелетного осложнения на фоне лечения, снижая риск при всех типах опухолей на 17 % (р < 0,001). Показано преимущество деносумаба в снижении риска развития первого и последующих костных осложнений на 18 % (р < 0,001) при РМЖ и раке предстательной железы.
В период лечения деносумабом отмечено достоверно более значимое уменьшение болевого синдрома по сравнению с контролем (p < 0,01). По результатам интегрального анализа (n = 5726), время без прогрессирования и общая выживаемость в группах не различались.
При анализе нежелательных явлений в группе сравнения (ЗК) преобладали острые реакции в виде гриппоподобного синдрома и почечная токсичность: 20,2 против 8,7 % и 11,8 против 9,2 %. Остеонекроз нижней челюсти и серьезные нежелательные эффекты наблюдались одинаково часто в обеих группах: 1,3 против 1,8 % и 57,1 против 56,3 % соответственно. В группе деносумаба чаще встречалась гипокальциемия: 9,6 % по сравнению с ЗК – 5 %, что можно объяснить более выраженным антирезорбтивным действием деносумаба.
В одном из трех исследований, включенных в интегральный анализ, принимали участие пациенты с множественной миеломой и солидными опухолями, включая рак легкого (кроме РМЖ и рака простаты) [20]. При анализе всей группы была показана одинаковая эффективность ЗК и деносумаба, преимуществ последнего не выявлено. Особый интерес представляет более поздний детальный анализ результатов лечения в подгруппе больных раком легкого с костными и висцеральными метастазами. В таблице представлено распределение больных раком легкого по гистологическим типам.
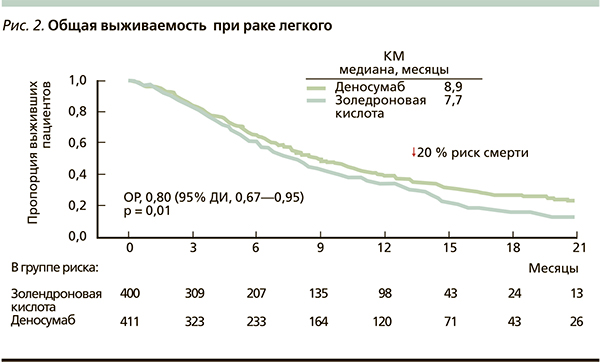
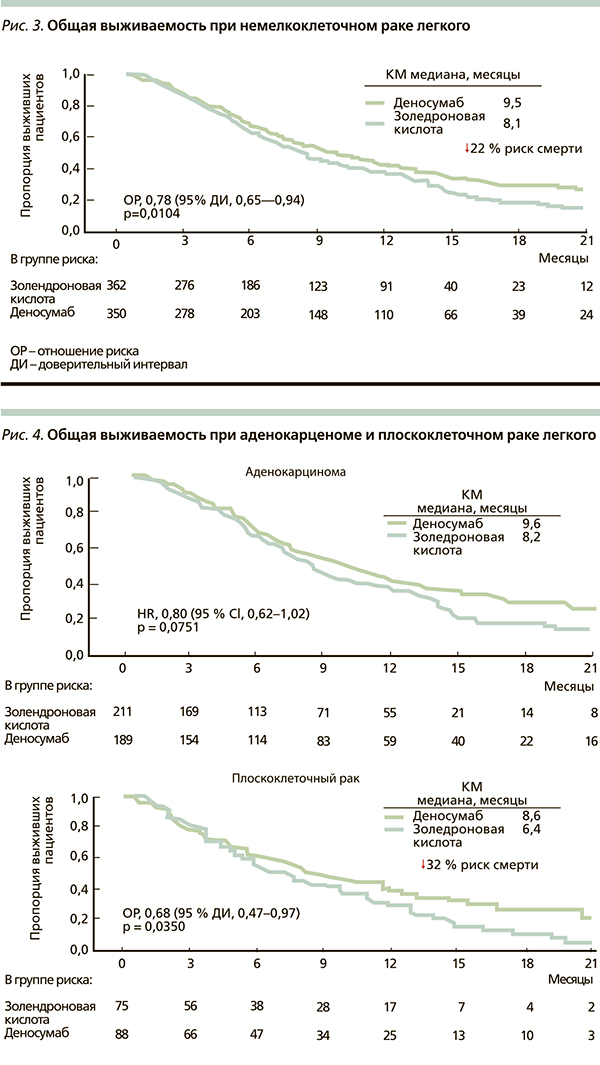
В результате анализа в группе деносумаба зарегистрировано достоверное увеличение медианы общей выживаемости на 1,2 месяца и снижение риска смерти на 20 % (р = 0,01) по сравнению с ЗК (рис. 2). В подгруппе немелкоклеточного рака разница в медиане общей выживаемости в пользу деносумаба составила 1,5 месяца, а снижение риска смерти – на 22 % (р = 0,01) (рис. 3). При этом различия достигнуты за счет больных с плоскоклеточной формой заболевания: увеличение медианы общей выживаемости на 2,2 месяца и снижение риска смерти на 32 % (р = 0,035) (рис. 4). При аденокарциноме легкого эти различия также присутствовали, но не достигли статистической значимости. При мелкоклеточном раке легкого улучшения этих показателей не отмечено.
Профиль безопасности лечения больных раком легкого не отличался от такового всей группы, включенных в интегральный анализ. Каких-либо необычных реакций не наблюдалось.
Таким образом, дополнительный анализ больных с костными и висцеральными метастазами рака легкого установил достоверное увеличение общей выживаемости в группе деносумаба по сравнению с ЗК. Эти данные подтверждают результаты ряда экспериментальных исследований, показавших in vitro и in vivo способность ингибиторов RANK-лиганда оказывать прямое воздействие на опухолевые клетки, в частности, рака легкого, подавляя миграцию/инвазию и усиливая их апоптоз [21]. Непрямое действие деносумаба обусловлено его ролью в подавлении остеокластогенеза через связывание RANKL и разрыв «порочного круга костного метастазирования».
Метастазами в кости осложняется течение многих злокачественных опухолей. Выбор оптимальной лечебной тактики при костных метастазах требует мультидисциплинарного подхода. Важную роль в такой тактике играет системная терапия с использованием остеомодифицирующих препаратов, подавляющих активность остеокластов. До недавнего времени с этой целью использовались БФ. В последние годы в клиническую практику вошел новый препарат деносумаб – полностью человеческое моноклональное антитело, которое связывает RANKL, тем самым ингибируя активность остеокластов и костную резорбцию. Ряд крупных исследований III фазы подтвердил не меньшую эффективность деносумаба при многих злокачественных опухолях, а также его преимущества по сравнению с ЗК в профилактике костных осложнений и улучшении качества жизни пациентов при РМЖ, раке предстательной железы и легкого.
Несмотря на достигнутые успехи, проблема системного лечения костных метастазов остается весьма актуальной. На решение ее направлены значительные усилия. Множество проводимых экспериментальных и клинических исследований служит этому убедительным подтверждением и вселяет надежду на успех.



