Биполярное аффективное расстройство (БАР) – хроническое фазно протекающее заболевание, встречающееся среди 1–4% населения [1]. Несмотря на то что симптомы мании и гипомании служат основным дифференциальным признаком БАР, эпизоды депрессии превалируют в течение заболевания как по частоте, так и по длительности [2–4]. Ущерб от биполярных депрессий (БД) превышает таковой от маний. По данным ВОЗ, БД вызывает потерю большего числа лет жизни, скорректированных по нетрудоспособности (Disability-adjusted life year – DALY), чем все формы рака или неврологические расстройства, включая эпилепсию и болезнь Альцгеймера [5]. Ухудшение качества жизни, связанное со здоровьем (HRQOL), коррелирует с количеством лет заболевания и числом депрессивных эпизодов [6, 7], а нарушение психосоциального функционирования – с числом эпизодов депрессии, включая субсиндромальные формы [8, 9]. Риск суицида на протяжении жизни больных БД – один из самых высоких среди всех психиатрических заболеваний и значительно превышает таковой среди пациентов с униполярной депрессией [3, 10]. По крайней мере одну суицидальную попытку в течение жизни совершают 25–50% больных БД [11, 12].
Таким образом, успешная терапия БД играет важную роль в улучшении отдаленных исходов и функциональной реабилитации пациентов с БАР [13]. Лечение БД существенно отличается от такового рекуррентной депрессии, поэтому крайне важна своевременная диагностика БАР. Неправильно установленный диагноз приводит к назначению неадекватной терапии и как следствие – к повышению риска развития обострений, индукции резистентности к лечению и ухудшению исходов заболевания [14, 15].
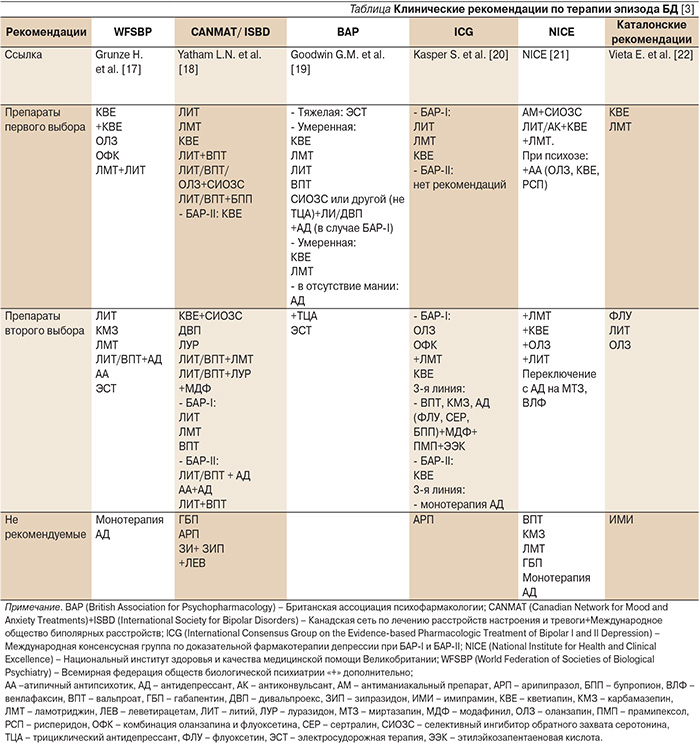
Основная цель лечения острого эпизода БД – достижение полной ремиссии, позволяющей снижать риск развития рецидива и функциональных нарушений, связанных с остаточными и субсиндромальными проявлениями депрессии [16]. Ко второй цели лечения относится предотвращение суицидальных попыток. Для ее достижения необходимо максимально быстрое купирование симптомов депрессии, однако оптимальная фармакотерапия БД продолжает оставаться предметом дискуссий и в отличие от лечения мании консенсус экспертов по данному вопросу отсутствует. В рекомендациях разных стран предпочтение отдается разным препаратам (см. таблицу). Отсутствие консенсуса объясняется недостатком доказательных данных [1].
Особенно противоречиво отношение экспертов к применению АД, которые в реальной медицинской практике остаются самыми широко применяемыми препаратами для лечения БД [23–25].
Антидепрессанты
Результаты рандомизированных контролируемых исследований (РКИ) АД при БД крайне противоречивы [3]. Число клинических исследований препаратов последних поколений на больных БД ограничено, т.к. за последние 20 лет эти пациенты исключались из участия в них в связи с ранее полученными данными о повышенном риске инверсии фазы и развития быстрой цикличности при лечении трициклическими антидепрессантами (ТЦА) [17, 26]. В мета-анализе Gijsman et al., включившем 12 РКИ (1088 пациентов), был сделан вывод об эффективности кратковременного лечения АД БД и повышении риска инверсии фазы только при применении ТЦА, но не АД других групп [27]. Напротив, в мета-анализе М. Sidor и G. Macqueen (2011) (15 РКИ, 2373 пациента) АД по эффективности не превосходили плацебо, но и не повышали риска инверсии фазы [28]. Результаты ограниченного числа исследований СИОЗС и других препаратов новых поколений позволяют предположить, что риск инверсии фазы при применении СИОЗС и БПП значительно ниже, чем при применении ТЦА, и возможно, не превышает таковой при естественном течении заболевания или при применении нормотимиков [26, 29].
Противоречивость сведений об эффективности АД при БД, по-видимому, в значительной степени обусловлена тем, что в связи с недостатком данных она преимущественно оценивалась для группы АД в целом, а не отдельных препаратов, эффективность которых может существенно различаться [26, 30, 31]. Так, эффективность монотерапии ФЛУ при БД и низкий риск инверсии фазы при его применении были подтверждены результатами систематического обзора 7 исследований (4 РКИ, 3 открытых проспективных исследования и 1 ретроспективное) [32]. Напротив, по результатам двойного слепого РКИ, эффективность монотерапии больных БД низкой дозой пароксетина (20 мг) не отличалась от таковой в группе плацебо [33]. Есть данные об эффективности монтотерапии ВЛФ эпизода депрессии у больных БАР-II без существенного повышения риска инверсии фазы, в т.ч. у пациентов с быстрой цикличностью [34, 35]. В то же время в другом исследовании показано, что применение ингибиторов обратного захвата серотонина и норадреналина, к которым относится ВЛФ, ассоциируется с наиболее высоким риском развития смешанного эпизода для больных БАР [36].
Еще одна проблема, ограничивающая применение монотерапии АД, – это повышенный риск суицида в первые два месяца терапии, особенно для лиц молодого возраста. Однако в недавно опубликованном систематическом обзоре натуралистических исследований показано, что АД, так же как и нормотимики, снижают риск завершенного суицида и суицидальных попыток на 80% и что суицидальное поведение обусловлено преимущественно недостаточной эффективностью АД, а не индуцирующим влиянием этих препаратов на риск самоубийства [37]. Таким образом, вопрос о соотношении эффективности и безопасности монотерапии СИОЗС и другими АД при БД требует дальнейшего изучения. В настоящее время она не рекомендуется, по крайней мере в качестве лечения первого выбора, ни в каких международных рекомендациях (см. таблицу). В некоторых из них (например, WFSBP и NICE) рекомендуется избегать применения монотерапии любыми АД, в то время как в других (Каталонские рекомендации) – только ТЦА. Комбинации АД с нормотимиками и атипичными антипсихотиками включены практически во все рекомендации в качестве терапии первой или второй линии. Однако данные об их соотношении польза/риск также неоднозначны. Наиболее высокий уровень доказательств существует для комбинации ФЛУ с ОЛЗ [17].
В отдельных РКИ показано, что добавление пароксетина или циталопрама к нормотимику улучшает исходы терапии без значительного повышения риска инверсии фазы [38, 39]. Однако в нескольких исследованиях добавление АД к нормотимику не приводило ни к повышению эффективности терапии острого эпизода БД, ни к снижению частоты инверсии фазы [40–42].
Отношение к применению АД в составе моно- и комбинированной терапии при БД также неоднозначно и в различных руководствах. В руководстве Британской ассоциации психофармакологии монотерапию АД рассматривают в качестве лечения первой линии больных без явного эпизода мании в анамнезе, но доля таких пациентов очень незначительна [19]. В руководстве NICE применение комбинации АД с нормотимиками рекомендуется при умеренной и тяжелой депрессии [21], однако эта рекомендация не имеет достаточной доказательной базы, поскольку тяжесть депрессии не оценивалась систематическим образом в большинстве исследований [26]. В рекомендациях CANMAT/ISBD в качестве терапии первой линии рассматривается комбинация СИОЗС и ОЛЗ, в рекомендациях WFSBP – комбинация ФЛУ и ОЛЗ [17, 18]. Последняя комбинация также является терапией первой линии в руководстве Американской психиатрической ассоциации [43], однако это руководство не пересматривалось с 2002 г. и считается устаревшим [26]. В Каталонских рекомендациях ФЛУ рассматривается в качестве терапии третьего выбора при БД [22]. В последнем Канадском руководстве подчеркивается, что монотерапия АД не должна применяться для лечения острого эпизода БД у больных БАР-I, но в отношении больных БАР-II допускается использование ФЛУ в качестве препарата третьей линии [18]. В ряде европейских руководств и в Руководстве Всемирной федерации обществ биологической психиатрии (WFSBP) указывается, что АД могут играть определенную роль в терапии острого эпизода БД, однако для определения их точного места в лечении этих больных, а также оптимального препарата и режима фармакотерапии необходимы дальнейшие исследования [17, 19, 44, 45]. В большинстве руководств не уточняется, какие группы пациентов могут получать наибольшую пользу от применения АД, хотя тип БАР (I или II) и наличие быстрой цикличности в анамнезе считаются клинически важными факторами при решении вопроса о назначении АД [26]. Применение комбинации АД, предпочтительнее СИОЗС, с антипсихотиками в качестве терапии первой линии рекомендуется в руководствах BAP, CANMAT/ISBD и NICE [18, 19, 21]. Эксперты CANMAT/ISBD также рекомендуют комбинацию БПП с ЛИТ или ВПТ. В то же время в других руководствах, например Каталонских, и ICG, АД и их комбинации, включая таковую ФЛУ с ОЛЗ, рассматриваются только в качестве терапии второй линии [20, 22].
Нормотимики
В большинстве рекомендаций ЛИТ и ЛМТ в виде монотерапии или в составе комбинаций рассматриваются как терапия первой линии при БД (см. таблицу). Монотерапия ЛИТ в качестве лечения первого выбора предлагается в руководствах ICG, BAP, CANMAT /ISBD [18–20], в качестве второй линии – в руководствах WFSBP [17] и Каталонии [22]. Руководство NICE не рекомендует применение ЛИТ в виде монотерапии [21].
Эффективность ЛИТ при остром эпизоде БД была продемонстрирована в нескольких исследованиях. В контролируемых исследованиях значительное улучшение состояния под его влиянием наблюдалось среди 68% пациентов [46, 47]. Результаты нескольких исследований позволяют предположить, что высокие дозы ЛИТ помогают лучше, чем более низкие дозы, контролировать симптомы БД [48, 49]. ЛМТ оказывает умеренный эффект при БД и более эффективен для больных тяжелой депрессией. В регрессионном мета-анализе индивидуальных данных 1072 участников 5 РКИ эффективность ЛМТ удалось продемонстрировать только в отношении пациентов с суммарным баллом по шкале Гамильтона (HDRS) >24, в то время как у пациентов с HDRS <24 он не превосходил плацебо по эффективности [50]. При этом ни в одном из отдельно взятых исследований, включенных в данный мета-анализ, не было выявлено статистически значимых преимуществ ЛМТ перед плацебо, в связи с чем его место в терапии БД, по мнению многих экспертов, включая авторов мета-анализа, остается не вполне ясным [30, 31, 50].
Отношение к ВПТ в современных рекомендациях по лечению БД неоднозначное. В руководствах WFSBP и BAP он считается препаратом первой линии как в виде монотерапии, так и в комбинации с ЛИТ или АД [17,19]. В руководстве CANMAT/ISBD применение ВПТ рекомендуется только в составе комбинированной терапии с ЛИТ или АД [18]. В руководствах ICG, NICE и Каталонии ВПТ не включен в препараты первого выбора ни в виде монотерапии, ни в составе комбинаций [20–22]. Доказательная база для ВПТ и дивальпроекса при БД весьма скудна. Заключение об их эффективности и хорошей переносимости базируется на результатах двух мета-анализов, в каждый из которых было включено по 4 РКИ с общим числом участников 142 [51,52]. При применении комбинации ВПТ с ЛИТ ответ на лечение аналогичен таковому при применении комбинации ЛИТ или ВПТ с АД [38].
КМЗ не изучался при БД в двойных слепых контролируемых исследованиях, однако, согласно объединенным данным 4 небольших РКИ и 8 открытых исследований, ответ на лечение этим препаратом наблюдается среди 56% пациентов [53].
Наиболее эффективной комбинацией нормотимиков при острой БД, согласно результатам систематического обзора, проведенного экспертами Всемирной психиатрической ассоциации (World Psychiatric Association – WPA), является комбинация ЛИТ с ЛМТ [54].
Антипсихотики
В подавляющем большинстве современных рекомендаций препаратом первого выбора считается КВЕ в виде монотерапии. В руководстве NICE КВЕ рассматривают в качестве адъювантного препарата [21]. КВЕ имеет наиболее высокий уровень доказательности эффективности среди всех рекомендуемых лекарственных средств для купирования острого эпизода БД [55]. Всемирная федерация обществ биологической психиатрии (WFSBP) кроме КВЕ также рекомендует монотерапию ОЛЗ [17], а в большинство руководств включена комбинация ОЛЗ с ФЛУ. Согласно результатам большого мета-анализа 29 краткосрочных (4–16 недель) двойных слепых РКИ (n=8331), эта комбинация превосходила другие препараты по размерам эффекта и частоте ответа на лечение, в связи с чем была рекомендована авторами в качестве терапии первой линии при БД [56]. В другом недавно опубликованном мета-анализе комбинация ОЛЗ с ФЛУ превосходила другие препараты по эффективности по отношению к плацебо (ОЛЗ+ФЛУ ≥ВПТ > КВЕ >луразидон >ОЛЗ, арипипразол и КМЗ) [57].
Данные об эффективности арипипразола противоречивы. Анализ, проведенный экспертами WPA с использованием модифицированного метода PORT (patient outcomes research team) [58], показал, что эффективность арипипразола при остром эпизоде БД в виде монотерапии и в комбинациях с ЛИТ или ВПТ подтверждена доказательствами наиболее высокого уровня (А) [54]. В то же время в другом мета-анализе было сделано заключение об отсутствии доказательств его эффективности [56]. Еще в одном мета-анализе показано, что достоверная разница с плацебо при лечении больных острым эпизодом БД отмечается лишь через 8 недель применения арипипразола, при этом эффект препарата был слабым (0,17 по отношению к плацебо) [59]. В руководствах CANMAT/ISBD и ICG арипипразол отнесен к числу нерекомендуемых препаратов [18, 20]. Зипразидон в виде монотерапии и в комбинации с нормотимиками не превосходил по эффективности плацебо [56, 60, 61]. Применение других антипсихотиков помимо КВЕ и ОЛЗ рекомендуется только при наличии у пациента сопутствующего психоза и только в составе комбинированной терапии [3].
Фармакотерапия депрессии у больных БАР-II
В большинстве руководств предлагается одинаковое лечение БД при БАР-I и БАР-II. Однако в последние годы показано, что БД при БАР-II отличается более тяжелым течением [7, 62] с более короткими периодами ремиссии, что способствует ее хронификации [8]. Кроме того, у пациентов с БАР-I и БАР-II наблюдается разный ответ на лекарственную терапию, в частности у больных БАР-II существенно реже, чем у пациентов с БАР-I (но чаще, чем при рекуррентной депрессии), возникает инверсия фазы при приеме АД [63].
В мета-анализе РКИ показано, что наибольшие доказательства эффективности (I уровня) при лечении острой депрессии у больных БАР-II имеются для КВЕ [64]. Эксперты считают, что он должен быть единственным препаратом выбора для этих пациентов, хотя необходимы дальнейшие исследования по изучению его эффективности при применении в качестве средства поддерживающей терапии [64]. Препаратами второго ряда могут быть ЛИТ (уровень доказательств III), ЛМТ (уровень доказательств III), или дивальпроекс (уровень доказательств IV) в качестве монотерапии или адъюнктивных средств [65–67]. Можно рассмотреть вопрос о назначении больным БАР-II и некоторых АД, например ВЛФ (уровень доказательств II) [35] и ФЛУ (уровень доказательств III) [68]. Последний включен в рекомендации CANMAT/ISBD в качестве препарата третьей линии для лечения БД при БАР-II [18]. Кратковременное применение АД этими больными не приводит к инверсии фазы, однако продолжает дискутироваться вопрос об их неэффективности и потенциальном негативном влиянии на прогноз [69].
Лечение БД должно быть индивидуализированным. При выборе препаратов конкретному пациенту следует учитывать их безопасность и переносимость, сопутствующие психические и соматические заболевания и потенциальные взаимодействия с лекарственными средствами, применяемыми для их лечения [70, 71]. В частности, больные пожилого возраста лекарственную терапию БД переносят хуже, чем лица среднего возраста, поэтому им рекомендуются более низкие дозы ЛИТ и ЛМТ [69]. У больных с сердечно-сосудистыми заболеваниями и метаболическими расстройствами или факторами риска их развития следует учитывать влияние психотропных препаратов на массу тела. Максимальное влияние на массу тела оказывают атипичные антипсихотики, особенно ОЛЗ и КВЕ, среди нормотимиков риск прибавки в весе наиболее высок при применении ЛИТ и ВПТ [72]. При одновременном применении ВПТ и ЛМТ следует корректировать и более медленно титровать дозу последнего, т.к. его концентрации в сыворотке крови повышаются под влиянием ВПТ. Необходимо избегать комбинации КМЗ с ВПТ, т.к. КМЗ ускоряет клиренс ВПТ, снижает его концентрации в крови и потенцирует токсическое воздействие на печень [69]. В отношении многих пациентов следует рассмотреть вопрос о назначении психотерапии в дополнение к фармакотерапии [31, 73].
В частности, психотерапия имеет критически важное значение для пациентов с субсиндромальными симптомами, циклотимией и личностными расстройствами [69].
Таким образом, при выборе фармакотерапии больному острым эпизодом БД следует учитывать современные рекомендации, основанные на данных доказательной медицины, и индивидуальные особенности пациента. После купирования острого эпизода БД необходимо проведение длительной поддерживающей терапии.



