Сложности при стратификации риска как фактор, затрудняющий выбор терапии
Хорошо известно, что степень интенсивности превентивной медикаментозной терапии пациентов с ишемической болезнью сердца (ИБС) должна напрямую определяться уровнем сердечно-сосудистого риска. К сожалению, несмотря на множество разработанных для этой цели шкал, оценка риска для больных ИБС без острого инфаркта миокарда (ОИМ) в анамнезе сегодня сильно затруднена. В большинстве случаев существующие шкалы занижают степень риска для пациентов группы высокого риска и завышают – в группе низкого риска [1].
Наиболее значимой практической сложностью здесь представляется невозможность получения реальной информации о степени стабильности атеросклеротических бляшек в коронарных сосудах пациента с ИБС, обладающей первостепенной прогностической ценностью. По всей видимости, крупные, но имеющие плотную фиброзную покрышку атеросклеротические бляшки разрываются реже, но при этом обусловливают выраженную клиническую симптоматику (в частности, ангинозные боли). В то же время при их разрыве и высвобождении внутрь сосуда огромного количества прокоагулянтного тканевого фактора вероятно развитие тромботической окклюзии крупного сосуда, клиническим эквивалентом которого служит обширный инфаркт миокарда с формированием зубца Q [2].
Небольшие бляшки реже приводят к значимому снижению коронарного кровотока, что определяет более редкие и менее интенсивные приступы ангинозной боли. Но при этом бляшки небольшого размера могут быть значительно менее стабильными, эрозии или разрывы их тонкой фиброзной покрышки могут приводить к развитию ОИМ, как правило, без формирования зубца Q (рис. 1). В качестве наглядного примера можно привести истории болезни пациентов с плохо компенсируемым сахарным диабетом 2 типа, в анамнезе часто имеющих несколько мелкоочаговых инфарктов и эпизодов нестабильной стенокардии.
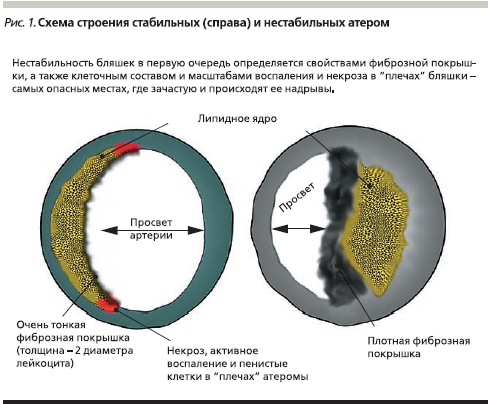
По новым данным, при нестабильной стенокардии внутри коронарных артерий возможно формирование своеобразного динамического равновесия, при котором в течение достаточно длительного времени на поверхности интимы происходят небольшие надрывы или образуются эрозии интимы, но формирования тромба удается избежать за счет активации антитромботической системы. Использование методов прямой визуализации структуры атером in vivo, таких как оптическая когерентная томография/спектроскопия, позволяет выявить такие бляшки [3].
В рамках данной концепции несложно объяснить результаты исследования COURAGE (Clinical Outcomes Utilizing Revascularization and Aggressive Drug Evaluation), в котором стентирование коронарных артерий не приводило к улучшению прогноза, но значительно улучшало клиническую симптоматику. По всей вероятности, несмотря на то что ангинозные боли у данных пациентов были связаны с крупными, с успехом стентированными бляшками, прогноз в данном случае определялся мелкими нестабильными бляшками, стентирования которых, по понятным причинам, не выполнялось.
Сегодня оценка степени стабильности атеросклеротических бляшек и вмешательства, направленные на их стабилизацию, в т. ч. через “упрочнение” фиброзной покрышки, становятся новой парадигмой превентивной кардиологии. По сути, все традиционные шкалы, разработанные для больных ИБС, решают задачу оценки риска посредством анализа факторов, опосредованно характеризующих именно стабильность атером.
Новые неинвазивные диагностические опции
Одним из основных направлений развития современной кардиологии является поиск минимально инвазивных методов прямой или косвенной оценки стабильности атеросклеротических бляшек, что позволит более точно предсказывать риск развития острого коронарного синдрома (ОКС). Их практическое применение представляется особенно важным при ведении пациентов со средним риском, выбор оптимального лечения которых часто затруднен. Сегодня на Западе с этой целью наиболее широко используется такой интегральный показатель масштаба поражения коронарного русла, как кальциевый индекс, который рассчитывается при проведении мультиспиральной компьютерной томографии (МСКТ) [4].
Другим подходом, который также может быть реализован при проведении МСКТ, служит оценка распределения плотности контраста в коронарном русле, что позволяет определять участки коронарных артерий с низким напряжением сдвига, где ожидаемо могут формироваться нестабильные атеромы [5].
Сегодня появляется все больше экспериментальных неинвазивных методик, призванных фокусно определять состояние атеросклеротических бляшек.
К ним относятся следующие методы диагностики:
• МР-визуализация с применением внутрисосудистых катушек и новых контрастов (например, ультрамалых частиц оксида железа, которые накапливаются макрофагами);
• совмещенные технологии МСКТ/МРТ (магнитно-резонансная томография), ПЭТ/КТ (позитронно-эмиссионная томография/компьютерная томография), КТ/сцинтиграфия;
• молекулярная лучевая диагностика (например, сцинтиграфия с 99Tc-аннексином 5, 99Tc-IL-2, с меченными тромбоцитами и липопротеидами низкой плотности).
Среди перспективных биохимических маркеров нестабильности атеросклеротических бляшек можно обозначить липопротеин-ассоциированную фосфолипазу А2, матриксную металлопротеиназу 9, растворимый лиганд CD40, неоптерин, а также широко доступный для практического определения высокочувствительный С-реактивный белок [6].
Основные принципы фармакотерапии
ИБС – хроническое “доброкачественное” заболевание, в связи с чем основными задачами ее лечения служат уменьшение числа, продолжительности и тяжести приступов ангинозных болей и улучшение прогноза, который определяется риском развития таких сердечно-сосудистых осложнений, как ОИМ, жизнеугрожающие нарушения ритма и хроническая сердечная недостаточность (ХСН).
В настоящее время влияние на прогноз пациентов с ИБС доказано только для статинов, ингибиторов ангиотензинпревращающего фермента – иАПФ (рамиприла и периндоприла), антитромбоцитарных препаратов и β-адреноблокаторов (после перенесенного ОИМ). В данном обзоре мы сосредоточимся на терапии, способной в первую очередь облегчать состояние больных стенокардией напряжения.
Антиангинальная и антиишемическая терапия хронической ИБС
Бета-адреноблокаторы (БАБ) по праву считаются краеугольным камнем лечения ИБС. В отсутствие абсолютных противопоказаний селективные β1-адреноблокаторы в обязательном порядке следует назначать всем пациентам с ОИМ в анамнезе ввиду их способности повышать выживаемость таких пациентов и снижать частоту развития повторных ОИМ.
Кардиоселективные БАБ служат основным инструментом лечения стенокардии напряжения, и прибегать к антиангинальным препаратам других групп следует только после того, как потенциал БАБ максимально задействован [7].
Крайне важно добиваться целевых значений частоты сердечных сокращений (ЧСС, 55–60 ударов в минуту), без достижения которых антиангинальная терапия не может быть признана оптимальной. В том случае когда на фоне применения БАБ у пациента со стабильной стенокардией продолжают отмечаться приступы ангинозных болей, следует предпринять попытку снизить ЧСС до 50 ударов в минуту, если на этом фоне не развивается атриовентрикулярная (АВ)-блокада [7]. При этом измерять ЧСС следует утром до приема очередной дозы препарата.
Сегодня нередко можно встретить больных, принимающих большие дозы нитратов в связи с выраженной ангинозной болью, но не получающих оптимальной терапии БАБ.
В большинстве случаев это связано со следующими факторами:
• неоправданными опасениями в отношении развития побочных эффектов, которые редко встречаются (в первую очередь различных блокад и бронхообструктивного синдрома);
• желанием назначить низкую дозу БАБ в рамках комбинированной антиангинальной терапии (реальная эффективность которой может значительно уступать терапии БАБ в полной дозе);
• трудностями при сопоставлении дозировок различных БАБ (сегодня врачи часто используют бисопролол в дозе 10 мг, но избегают применения метопролола в дозах выше 150 мг/сут, в связи с чем пациенты, получающие метопролол, часто имеют более высокую ЧСС);
• сложностями, связанными с титрованием БАБ (особенно это относится к липофильному карведилолу, обладающему труднопредсказуемой зависимостью между дозировкой и эффективностью);
В случае непереносимости БАБ их можно заменить на блокаторы кальциевых каналов (БКК). Следует особо отметить, что ни в одном из контролируемых исследований БКК не было показано их влияния на выживаемость пациентов со стенокардией.
У пациентов с бронхиальной астмой препаратом выбора можно считать верапамил пролонгированного высвобождения, обладающий пульсурежающим эффектом. При этом следует помнить, что по сравнению с БАБ его применение пожилыми пациентами сопряжено с более высоким риском развития АВ-блокады II–III степеней. При появлении значимого замедления АВ-проведения на фоне применения верапамила оправданно проведение холтеровского мониторирования ЭКГ, в т. ч. для исключения АВ-блокады II степени в ночные часы.
Дигидроперидиновые БКК обладают более слабым антиангинальным эффектом, нежели недигидроперидиновые, но могут с успехом применяться пациентами с нарушениями проводимости. Ряд больных эти препараты могут приводить к развитию субэндокардиальной ишемии [7].
В случае наличия противопоказаний к назначению БАБ, в первую очередь при наличии блокады АВ-проведения ΙΙ степени или бронхиальной астмы, в качестве пульсурежающего препарата может использоваться ингибитор If-каналов ивабрадин. Антиангинальный эффект ивабрадина реализуется только за счет урежения ЧСС, ввиду чего он “по силе” уступает БАБ, обладающим многогранным механизмом антиишемического и кардиопротективного действий. Следует отметить, что в крупном клиническом исследовании, включившем более 10 тыс. пациентов с ИБС и ХСН, ивабрадин не показал влияния на сердечно-сосудистую смертность и частоту госпитализаций, обусловленных ОИМ и ХСН [8].
Комбинированная антиангинальная терапия
Наличие жалоб на ангинозные боли пациентов с ИБС, получающих терапию первой линии, диктует необходимость подключения дополнительных антиишемических лекарственных средств. Алгоритм их применения представлен на рис. 2.
До инициации комбинированной антиангинальной терапии следует удостовериться, что целевая ЧСС достигнута с применением БАБ. В случае непереносимости БАБ, не связанной с наличием блокад, следует предпринять попытку назначения верапамила или дилтиазема в режиме монотерапии.
Добавление к БАБ препарата ивабрадин оправданно, только если ЧСС на фоне максимальной дозы БАБ (20 мг биспопролола или 400 мг метопролола) превышает 70 ударов в минуту либо если титрование дозы БАБ невозможно (например, в связи с хронической обструктивной болезнью легких или клинически выраженным атеросклерозом сосудов нижних конечностей). Применение ивабрадина совместно с малыми дозами БАБ с целью урежения ЧСС у больных, которые хорошо переносят БАБ, ввиду отсутствия доказательной базы следует отнести к нерациональным назначениям.
В том случае если на фоне целевой ЧСС больного продолжают беспокоить ангинозные боли, в качестве “второго” препарата оптимально назначать БКК [11], в ряде случаев можно также использовать длительно действующие нитраты/донаторы NO или никорандил.
Жалобы на наличие ангинозной боли у пациентов с ИБС, получающих терапию двумя антиангинальными препаратами, служат прямым показанием к проведению коронарографии с последующим решением вопроса о тактике реваскуляризации. В настоящее время ежедневная комбинированная терапия тремя и более антиангинальными препаратами может считаться оправданной только для тех пациентов, у которых по какой-либо причине проведение реваскуляризации невозможно.
Ведение пациентов с рефрактерной стенокардией при невозможности проведения реваскуляризации
Концепция рефрактерной стенокардии включает три следующих фактора:
1. Ишемию миокарда;
2. Ангинозную боль;
3. Невозможность проведения реваскуляризации [12].
“Неподходящими” кандидатами для проведения реваскуляризации обычно считаются такие категории пациентов [12]:
• больные вазоспастической стенокардией;
• пациенты с подозрением на микрососудистую дисфункцию (с объективными признаками ишемии миокарда в отсутствие значимых стенозов коронарных артерий или с нормально функционирующими шунтами);
• больные, обладающие небольшим объемом ишемизированного миокарда, при невозможности проведения ангиопластики (например, с гемодинамически значимым симптом-связанным дистальным однососудистым поражением), стратифицированные в группу низкого риска;
• пациенты с диффузным, “нитевидным” коронарным атеросклерозом (характерно поражение двух и более коронарных артерий, захватывающее дистальное русло с артериями < 1 мм в диаметре);
• лица с очень высоким периоперационным риском (ввиду тяжелых сочетанных заболеваний, часто к этой группе относятся пожилые люди с многососудистым поражением).
Необходимо подчеркнуть, что заключение о невозможности проведения реваскуляризации должно приниматься полидисциплинарной командой и этот статус может быть пересмотрен с учетом изменения состояния больного, возможности привлечения опытной хирургической бригады, способной оперировать пациентов высокого риска.
Далее мы рассмотрим препараты, которые могут использоваться в схемах “максимизированной” антиангинальной терапии таких пациентов.
Одним из высокоэффективных антиангинальных препаратов является никорандил – активатор АТФ-зависимых калиевых каналов плазматической и митохондриальных мембран с нитратоподобными свойствами. Обычно к никорандилу прибегают в случае непереносимости БАБ и БКК, но он может использоваться и в составе комбинированной терапии. В двойном слепом исследовании, включившем больных стабильной стенокардией, было показано, что никорандил приводил к значимому увеличению толерантности к физической нагрузке, времени до появления ангинозной боли и депрессии ST ≥ 1 мм [13]. В рандомизированном клиническом исследовании (РКИ) IONA, включившем более 5000 больных хронической ИБС, никорандил, назначенный в дозе 20 мг 2 раза в сутки, продемонстрировал превосходство над плацебо в плане влияния на частоту госпитализаций, что было расценено как снижение риска развития нестабильной стенокардии. Примерно в трети случаев в первые дни после приема никорандила может отмечаться головная боль [13], также существует риск развития толерантности к его действию.
Другим перспективным лекарственным средством является ранолазин, частично ингибирующий окисление жирных кислот и блокирующий поздние натриевые каналы (работающие в диастолу). Ранолазин способен нивелировать индуцированную ишемией натриевую и кальциевую “перегрузку” кардиомиоцитов, улучшая перфузию и диастолическую функцию миокарда. Кроме того, он обладает антиаритмическим действием и способен снижать уровень гликозилированного гемоглобина у пациентов с сочетанием ИБС и СД.
В нескольких рандомизированных двойных слепых исследованиях (MARISA, ERICA, CARISA) показано, что ранолазин снижает частоту эпизодов стенокардии, потребление нитратов и повышает толерантность к физической нагрузке без клинически выраженного влияния на ЧСС и АД [14]. При этом в исследовании MERLIN TIMI 36 (Metabolic Efficiency With Ranolazine for Less Ischemia in Non-ST Elevation Acute Coronary Syndromes), в рамках которого пациенты с ОКС наблюдались в течение года, ранолазин не показал влияния на риск развития ОИМ и сердечно-сосудистую смертность. При лечении стенокардии у лиц с микрососудистой дисфункцией возможно также использовать препараты с анальгетическими свойствами, такие как ингибитор фосфодиэстеразы аминофиллин, антидепрессант имипрамин. Можно также применять методы психотерапии и кардиореабилитации [15].
Среди нелекарственных методов, которые могут облегчать состояние ряда пациентов с рефрактерной стенокардией, можно указать усиленную наружную контрпульсацию, ударно-волновую терапию и электростимуляцию спинного мозга [16]. Такая инвазивная процедура, как трансмиокардиальная лазерная реваскуляризация, согласно мета-анализу 7 исследований (n = 1137), не может быть признанной эффективным методом лечения рефракторной стенокардии [17].
В настоящее время уточняется эффективность таких экспериментальных методик лечения резистентной стенокардии, как клеточная терапия и применение факторов роста, активирующих ангиогенез, в т. ч. гранулоцитарно-макрофагального колониестимулирующего фактора, способного “мобилизовать” стволовые клетки костного мозга для участия в ангиогенезе коронарного русла.
Метаболическая и антиоксидантная терапия
“Антиоксидантная терапия” гармонично вписывается в традиционные схемы лечения ИБС благодаря использованию таких препаратов, как статины, иАПФ, карведилол, обладающих выраженным антиоксидантным действием. При этом благоприятные антиишемические, кардиопротективные и антиатеросклеротические эффекты “чистых” антиоксидантов (биофлавоноидов, полифенолов, витаминов, глутатиона, эмоксипина, этилметилгидроксипиридина), показанные на различных биологических моделях, в настоящее время не были продемонстрированы ни в одном крупном клиническом исследовании. В нескольких проспективных плацебо-контролируемых РКИ были показаны нейтральные и даже негативные эффекты витаминов [18]. Недавно обнаружилось, что ряд экспериментов, в которых было показано положительное действие кверцетина, проведен с грубейшими нарушениями биомедицинской этики [19]. Таким образом, использование больными ИБС антиоксидантов, в т. ч. в составе БАД, не оправданно.
Метаболические препараты также имеют достаточно скудный доказательный базис. В связи с этим Европейское агентство по оценке лекарственных средств сократило спектр показаний к применению препарата триметазидин, который может использоваться лишь в качестве дополнительного антиангинального средства в случае непереносимости или недостаточной эффективности терапии первой линии [20]. В качестве сферы рационального применения триметазидина в составе комплекс ной антиангинальной терапии можно указать стенокардию, обусловленную микрососудистой дисфункцией.
В России при лечении пациентов с ИБС также применяется препарат мельдоний – аналог γ-бутиробетаина. Мельдоний ингибирует фермент γ-бутиробетаин-гидроксилазу, что приводит к замедлению биосинтеза карнитина и транспорта длинноцепочечных жирных кислот через митохондриальную мембрану in vitro (при этом β-окисление жирных кислот замедляется, происходит “переключение” внутриклеточного метаболизма на гликолиз). Обратным действием обладает препарат L-карнитин, ускоряющий транспорт длинноцепочечных жирных кислот в митохондрии, β-окисление которых значительно более выгодно энергетически, но и требует бoльших количеств кислорода. Вопрос о том, какая из данных стратегий может считаться оптимальной в условиях клинической практики, когда длительно существующая хроническая ишемия миокарда может смениться острой при развитии ОКС, остается открытым.
Заключение
Современная кардиология обладает широким арсеналом антиангинальных препаратов, рациональное использование которых позволяет добиваться от большинства пациентов с ИБС удовлетворительного контроля стенокардии. В настоящее время парадигма лечения пациентов с хронической ИБС все больше сдвигается от симптоматического лечения к терапии, направленной на улучшение прогноза. В связи с этим практика наращивания дозировок и количества антиангинальных препаратов в схеме лечения пациентов со стабильной стенокардией с целью отсрочить проведение коронарографии с последующей реваскуляризацией является неприемлемой. Несмотря на высокую клиническую эффективность, сфера применения схем терапии, включающих более двух антиангинальных средств, в настоящее время применяется лишь пациентами, которым не может быть проведена реваскуляризация миокарда.



