Введение
Стремительно развивающаяся комплексная кардиореабилитационная система, твердо утвердившая свою высокую доказательную эффективность при ишемической болезни сердца (ИБС), в т.ч у пациентов, перенесших острые коронарные события (ОКС) и реваскуляризацию миокарда, требует необходимого понимания некоторых частных аспектов при реализации программ физических тренировок (ФТ) для широкого внедрения в клиническую практику [1].
Не вызывающий сомнений в современном медицинском сообществе факт снижения риска сердечно-сосудистых заболеваний на фоне регулярных дозированных физических нагрузок как непосредственно, так и за счет коррекции и сокращения ряда кардиоваскулярных факторов риска (ФР) – гиподинамии, дислипидемии, артериальной гипертонии, ожирения – позволил широко использовать кардиотренировки в программах кардиореабилитации и вторичной профилактики [2]. Доказано, что рационально и правильно организованная программа физических тренировок у больных ишемической дисфункцией имеет много физиологических, биохимических и гемодинамических преимуществ.
В соответствии с современными рекомендациями [3] все пациенты со стабильным течением ИБС и перенесшие острые коронарные события должны включаться в программы реабилитации и вторичной профилактики. Основными компонентами комплексных программ кардиореабилитации и вторичной профилактики являются оптимальная медикаментозная терапия, физическая и психологическая реабилитация, немедикаментозная коррекция факторов риска ИБС. До настоящего времени первым и ключевым компонентом реабилитационно-профилактического вмешательства является физическая реабилитация длительных ФТ согласно индивидуально разработанной программе [4]. Прямое и опосредованное влияние ФТ на сердечно-сосудистую систему, проявляемое в улучшении клинического течения ИБС (уменьшение эпизодов возникновения приступов стенокардии и их интенсивности) [4], замедлении развития атеросклеротического процесса [5, 6], достоверном снижении цифр артериального давления (АД), улучшении показателей допплер-эхокардиографии (уменьшение размеров левого желудочка и левого предсердия, увеличение фракции выброса), улучшении липидного профиля, а также увеличении физической работоспособности, толерантности к физическим нагрузкам доказано и у лиц, перенесших ОКС при сочетании медикаментозной терапии и физической реабилитации [7, 8]. Пациенты с высоким риском развития сердечно-сосудистых осложнений (ССО) (лица с ИБС после ОКС, процедуры неполной реваскуляризации миокарда) требуют постоянной адекватно подобранной комбинированной терапии (β-адреноблокаторы, ингибиторы ангиотензин-превращающего фермента, ацетилсалициловая кислота, статины) [9, 10], по необходимости с последующей ее коррекцией при проведении кардиореабилитационных мероприятий [3].
Основополагающим принципом поддерживающей лекарственной терапии при проведении контролируемых ФТ является не только предупреждение возможных кардиоваскулярных осложнений, но и обеспечение наибольшего потенциированного лечебного эффекта, заключающегося в комплексном кардиореабилитационном подходе: антиишемическом, антиатеросклеротическом, антитромботическом, антиаритмическом [3].
Современные утвержденные национальные и европейские рекомендации для лиц с перенесенным ОКС, реваскуляризацией, с целью вторичной профилактики ССО, а также для снижения риска развития инфаркта миокарда (ИМ), смерти от кардиоваскулярных причин указывают на жесткий контроль уровня холестерина липопротеидов низкой плотности (ЛПНП), и в качестве препаратов первой доказанной линии рекомендуют применять «неопределенно долго» статины в отсутствие противопоказаний (Рекомендации ESC по ведению больных ОИМпST, 2012; рекомендации ACCF/AHA по ведению больных ОИМпST, 2013; Рекомендации ACC/AHA по контролю уровня холестерина для снижения атеросклеротического кардиоваскулярного риска у взрослых, 2013, доказанность: класс I, уровень А) [9, 10].
Известно, что снижение атерогенной фракции холестерина на фоне проведения регулярных дозированных ФТ умеренной интенсивности в комбинации с приемом статинов у лиц с ИБС оказывает выраженное влияние на гипохолестериемический и антиатеросклеротический процесс [9, 10]. В ряде мета-анализов одним из важных факторов, влияющих на приверженность пациентов к лечению, является экономический, что обусловливает широкое применение генерических препаратов [11]. При этом, по нашему мнению, очень важно, чтобы этот генерический препарат имел не только биоэквивалентность, без наличия которой выпуск препарата невозможен, но и собственные исследования по терапевтической эквивалентности по сравнению с оригинальным препаратом. В работе Е.В. Ковш и соавт. [12] по терапевтической эквивалентности препарата Розулип по сравнению с оригинальным розувастатином у пациентов с гиперхолестеринемией было показано, что оба препарата обладают сопоставимым гиполипидемическим действием (при сравнении данных липидограммы статистически значимых различий между группами пациентов, принимавших Розулип или оригинальный розувастатин в дозе 20 мг, не было выявлено). Была отмечена хорошая переносимость и безопасность в обеих группах.
В исследовании АРГО-2 [13], где пациентам в возрасте 30 лет и старше, обратившимся к врачу, определялся уровень общего холестерина и назначалась терапия розувастатином (99,4% пациентов принимали Розулип компании EGIS, Венгрия). К 33-му дню лечения снижение уровня общего холестерина составило 22%. При этом большинству пациентов препарат назначался в дозе 10 (62,8%) и 20 мг (27,3%). По мнению авторов, в реальной клинической практике назначение даже средних доз препарата может приводить к достоверной положительной динамике показателей липидного обмена. Еще раз отмечено, что применение препарата с наиболее выраженным гиполипидемическим действием, даже в дозах 10 и 20 мг, позволяет существенно улучшать липидный профиль. Это не касается пациентов, имеющих диагноз ОКС, где уже на старте лечения рекомендуются максимальные дозы наиболее сильных статинов (в частности, розувастатин в дозе 40 мг) [14].
Таким образом, своевременно начатая и рационально проводимая гиполипидемическая терапия, осуществляемая под контролем врача и при понимании пациентом целей и задач своего лечения может уменьшить количество осложнений сердечно-сосудистых заболеваний.
Статин-индуцированная миопатия: стратегии безопасности статинотерапии и снижение риска на фоне ФТ в реабилитации
Однако важным элементом терапевтического подхода пациентов с ИБС, перенесших ОКС и/или процедуру реваскуляризации, нуждающихся в реабилитационных мероприятиях, является контроль переносимости, эффективности и безопасности ФТ на фоне приема холестеринснижающих лекарственных средств в силу опасения развития таких побочных эффектов, как статин-индуцированная миопатия и рабдомиолиз. Вероятность развития и выраженность миопатии могут увеличиваться при неправильном сочетании терапии статинами и физических нагрузок. В то же время необоснованно излишняя настороженность в отношении развития осложнений при статинотерапии и низкая информированность врачей сказываются в назначении неэффективных низких доз препарата или полной его отмене и, соответственно, дальнейшем недостижении целевых показателей липидограммы при лечении, в прогрессировании атеросклероза.
Тем не менее реальная клиническая ситуация требует широкого внедрения реабилитационно-профилактических мероприятий в ежедневную кардиологическую практику, что обусловливает необходимость клинических исследований с целью определения безопасных доз липидснижающей терапии, интенсивности кардиотренировок и выявления пациентов высокого риска развития миопатий.
Лица высокой группы риска развития миопатий на фоне статинотерапии
T.R. Joy, Y.S. Chatzizisis и ряд других исследователей предлагают перед началом статинотерапии и физической реабилитации выявлять пациентов из группы риска миопатии. К данной катогории относятся пожилые лица [15], определенные расовые группы (азиатские) [16], лица с генотипами некоторых митохондриальных заболеваний (митохондриальные заболевания, связанные с низким синтезом коэнзима Q10, т.е. мутацией генов COQ2, COQ4, PDSS1, и PDSS2 [что в дальнейшем способствовало проведению рандомизированных исследований по поводу эффективного лечения статин-ассоциированной миалгии коэнзимом Q10 [17]] [18], мутацией гена, кодирующего карнитин-пальмитилтрансферазу II, болезнью Макардл [19], дефицитом миоаденилат-диаминазы) [20], лица с сопутствующими заболеваниями мышц (боковой амиотрофический склероз [21], миотоническая дистрофия, мышечная дистрофия, моторная нейропатия) [22], лица с дефицитом витамина D [23]; лица с заболеваниями печени, алкогольным поражением печени, почечной недостаточностью [16].
На реабилитационном этапе при ведении пациентов с ИБС после ОКС и реваскуляризации миокарда одним из важных критериев безопасности и эффективности является своевременное выделение лиц с высоким риском развития миопатий. ФТ на фоне приема статинов данной категорией лиц зачастую могут приводить к изначальному появлению миопатии и определенных побочных эффектов в виде слабости, миалгии, ранней и быстрой мышечной утомляемости (более выраженной в проксимальных мышцах), мышечных судорог в ночные часы [24]. Такой наиболее опасный побочный эффект статинотерапии, как рабдомиолиз, при анализе более 30 клинических исследований встречается с частотой менее 0,01% [15], а по данным Паркера и Томпсона, факт фатального рабдомиолиза регистрируется редко – из расчета 0,15 случая на 1 млн лиц, принимающих статины [25].
Также согласно рекомендациям ACC/AHA/NHLBI, необходимо проводить мониторинг уровня креатинфосфокиназы (КФК) всем пациентам после начала терапии статинами и проявляющих признаков развития мышечных симптомов. Мониторинг включает измерение уровня КФК до лечения и использует его в качестве базовых значений (R.C. Pasternak, 2002). NLA в свою очередь рекомендует измерение базовых значений КФК только для пациентов с высоким риском развития миопатий, в частности для пациентов преклонного возраста или больных с комбинированной терапией препаратами, обладающими или потенцирующими миотоксический эффект (J.M. McKenney, 2006). ACC/AHA/NHLBI предлагают отменять терапию статинами при 10-кратном повышении уровня КФК от верхней границы нормы. В случае если уровень КФК менее 10-кратного от верхнего порога, предлагается проводить его еженедельное измерение.
Определение интенсивности ФТ на фоне статинотерапии в реабилитационной практике
Высокая эффективность как статинотерапии, так и дозированных ФТ, улучшающие прогноз, в программах комплексной кардиореабилитации нацелили ряд исследователей на изучение и безопасное применение вышеописанных методов в их комбинации, учитывая более выраженную клиническую и прогностическую результативность совокупности данных методов лечения [26]. Особый интерес исследователей при этом привлекает интенсивность проводимых ФТ. Неоднократно было доказано, что именно ФТ умеренной интенсивности в значимой степени влияют на коррекцию ФР (дислипидемию, уровень АД), а ФТ высокой интенсивности – в большей степени на формирование адаптации к ишемии и кардиопротективного эффекта [27]. P.D. Thompson в своем обзоре по статинотерапии на фоне физических нагрузок делает акцент на более высокий процент развития миопатии (в 14,7% случаев) у лиц с «некоторыми интенсивными видами спорта» по сравнению с развитием мышечной патологии у «менее физически активных лиц» (10,8%) [28].
Ряд исследований на спортсменах и на марафонцах, подвергающихся интенсивным физическим нагрузкам, и принимающих статины на фоне гиперхолестеринемии, показал факт более частого поражения мышечной ткани (как при гистологическом исследовании – некроз, воспаление, так и при биохимическом анализе – КФК) по сравнению со спортсменами без статинотерапии. B.A. Parker и коллеги при исследовании бостонских марафонцев с высокой достоверностью полученных результатов (р=0,03) показали, что у спортсменов, принимающих статины (1-я группа), через 24 часа после интенсивных ФТ отмечалось повышение КФК до 1,104±150 ЕД/Л (при исходном 133±15 ЕД/Л) по сравнению с группой контроля (спортсмены без статинотерапии, 2-я группа) – 813±137 ЕД/Л после ФТ (при исходном 125±12 ЕД/Л). Также у лиц 1-й группы через 24 часа отмечено увеличение МВ-КФК до 8,9±7,0 ЕД/Л (при исходном 1,1±3,9 ЕД/Л) по сравнению с лицами 2-й группы (0,0±0,0 исходно и 4,2±5,0 ЕД/Л после ФТ), р<0,05 [29, 30]. В том же исследовании был отмечен факт большей восприимчивости пожилых спортсменов к статин-ассоциированному повреждению мышц [30].
P.D. Thompson и соавт., изучая влияние и эффекты ловастатина, получили также более высокие показатели уровня КФК после бега пациентов на беговой дорожке [31]. В исследовании, опубликованном P.M. Coen и соавт. [32], физически малоактивные пациенты с гиперхолестеринемией были разделены на 2 группы, 3-ю группу составили физически активные лица также с гиперхолестериемией. Пациенты первых двух групп в течение 20 недель получали розувастатин 10 мг. Кроме того, пациенты первой группы приняли участие в программе физического воспитания между 10-й и 20-й неделями исследования, включившей упражнения на выносливость и программы резистивной тренировки (3 дня в неделю). Временное увеличение активности КФК через 48 часов после первого курса упражнений было отмечено в 1-й группе, но эти показатели достигли исходных нормальных значений через 48 часов после пятого курса упражнений. Побочные эффекты, такие как мышечная боль и скованность, были выявлены очень рано у лиц 1-й группы, но их появление не было связано с увеличением КФК. Выявленные в данном исследовании особенности значимо отличаются от результатов, полученных P.D. Thompson и соавт. в 1997 г. [31], вероятно обусловленных более низкими физическими нагрузками у пациентов и более низкой миотоксичностью розувастатина, по сравнению с высоким риском миопатии на фоне приема ловастатина в исследовании P.D. Thompson.
В другом исследовании H. Sinzinger и J. O’Grady были проанализированы побочные мышечные эффекты у профессиональных спортсменов с семейной гиперхолестеринемией, принимавших аторвастатин, флувастатин, ловастатин, правастатин, симвастатин. Было выявлено, что более чем у ¾ (78%) пациентов отмечались симптомы мышечной боли. Однако увеличение активности КФК не превышало допустимых уровней для спортсменов [33].
Немаловажную роль в выраженности миотоксичности играет также липофильность препарата: доказано, что гидрофильные статины, в частности розувастатин, реже вызывают статин-ассоциированную миопатию [34–36]. Безопасность статинотерапии на фоне ФТ не только определяется в выявлении лиц высокого риска развития миопатии (пожилые, азиаты, лица митохондриальными заболеваниями, сопутствующими заболеваниями мышц, с дефицитом витамина D, заболеваниями печени, с почечной недостаточностью), типе используемого статина, интенсивности ФТ, контроле приема групп препаратов (фибраты, некоторые антибиотики и противогрибковые препараты, эзетимиб, амиодарон, антагонисты кальция), но и зависит в большей степени от дозы принимаемого препарата.
Недавние исследования лиц с плохой переносимостью статинов показали, что нерегулярный, в частности, прием дозы розувастатина 5 или 10 мг через день достоверно эффективно снижает уровень ЛПНП в среднем на 34,5% за 4,6 месяца (с полученным отсутствием рецидивов миалгии у 80% обследуемых на фоне нерегулярной статинотерапии) [37, 38]. При дальнейшем изучении механизмов развития миопатии, дыхательного коэффициента обмена, а также побочных эффектов и влияния статинов на мышцы при физических нагрузках ряд исследователей выявили «безопасную» дозу статина при анаэробной нагрузке. Чангом и соавт. было отмечено, что при 8-недельном приеме средних доз статинов не ухудшается окисление жирных кислот и не происходит развитие миопатии при физических тренировках среди лиц, не относящихся к группе риска миопатии [39].
Клинический опыт применения розувастатина у больных ИБС, после ЧКВ в комплексе реабилитационных мероприятий
В проведенном нами исследовании пациенты ИБС после ЧКВ были рандомизированы в основную группу пациентов, которые в течение 12 месяцев выполняли кардио-ФТ умеренной интенсивности, и в контрольную группу, пациенты которой не выполняли кардио-ФТ. Все пациенты получали медикаментозную терапию согласно имевшимся показаниям с учетом стандартов и современных рекомендаций по ведению пациентов после ЧКВ, обязательно назначался розувастатин в дозе 10,6+4,3 мг. Через 6 месяцев в основной группе определялась более выраженная позитивная динамика по липидному спектру: число пациентов с уровнем общего холестерина (ОХС) <175 11="" 7=""> 115 мг/дл уменьшилось на 15,7%, оптимальный уровень липопротеидов высокой плотности (ЛПВП) определялся у 77,6% пациентов, число пациентов с целевым уровнем триглицеридов (ТГ) достигло 86,6%. В то же время в контрольной группе в отличие от основной сохранялась тенденция к увеличению числа пациентов с гиперхолестеринемией: число пациентов с уровнем ОХС<175 1="" 4="" 89="" 5="" 83="" 7="" p="">
Целевые значения показателей липидного профиля через 12 месяцев наблюдения в основной группе имели 84,7% пациентов, а в контрольной группе число пациентов, имевших целевые значения, было в 3 раза меньше, чем в основной группе (см. таблицу).
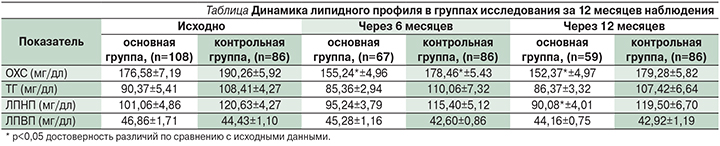
Таким образом, результаты липидного профиля у больных ИБС после ЧКВ наглядно демонстрируют, что систематические кардио-ФТ умеренной интенсивности оказывают благоприятное влияние на липидный профиль крови, длительные контролируемые ФТ умеренной интенсивности в течение 6 месяцев и более способствуют повышению уровня ЛПВП и значимому снижению ЛПНП, ОХС и ТГ.
При планировании программ физической реабилитации пациентов, перенесших ЧКВ, следует ориентироваться на их безопасность, т.е. поддержание стабильности клинического состояния и гемодинамических показателей и ритма, учитывать выраженность дисфункции левого желудочка, порог ишемии и стенокардии (в случае неполной реваскуляризации). С целью обеспечения безопасности кардио-ФТ умеренной интенсивности нами производилось определение маркеров повреждения: тропонина, предсердного натрийуретического пептида, МВ-КФК. В ходе исследования уровни определяемых маркеров не првысили реферантных значений.
Заключение
Высокая клиническая эффективность вторичной профилактики и комбинированного лечения пациентов с ИБС после ОКС и реваскуляризации миокарда, доказанная в ряде крупных клинических исследований, не оспорима в современном кардиологическом обществе. Комбинация приема статинов в сочетании с умеренными ФТ приводит к снижению смертности, риска инфаркта, инсульта, ожирения, сахарного диабета [40–42]. Однако принципиально важным остается факт тщательного отбора больных для комплексной кардиореабилитации с учетом предварительного определения пациентов с высоким риском развития миопатий, интенсивности ФТ, контролем принимаемой дозы статина, а также выбор безопасного препарата статинового ряда в отношении мышечного поражения. На данном этапе развития кардиореабилитационной системы еще не проведено крупных клинических исследований о влиянии терапии статинами на весь процесс кардиологической реабилитации, однако данный алгоритм по рекомендациям холестеринснижающей терапии на фоне ФТ поможет клиницистам достигнуть максимального эффекта от реабилитационных мероприятий при минимальных рисках серьезных побочных эффектов.



