Актуальность
Вопросы сердечно-сосудистой безопасности тестостерон-заместительной терапии (ТЗТ) при возрастном андрогеном дефиците у мужчин по-прежнему являются поводом для активных обсуждений. В нескольких исследованиях было продемонстрировано повышение риска инфаркта миокарда (ИМ) и инсульта при применении тестостерона [1—3]. Публикация этих данных привела к массовому отказу от терапии тестостероном: после 2013 г. число назначений тестостерона снизилось в несколько раз [4]. Вместе с тем, результаты исследований противоречивы. Некоторые авторы поставили под сомнение постулат о том, что ТЗТ может значимо негативно повлиять на сердечно-сосудистую заболеваемость и смертность у пожилых мужчин [5—7].
Более того, в нескольких исследованиях было продемонстрировано снижение общей смертности среди мужчин с гипогонадизмом, получавших терапию тестостероном, несмотря на небольшое повышение риска сердечно-сосудистых событий (ССС) [8, 9]. Таким образом, в настоящее время отсутствует четкое представление о том, какова роль ТЗТ, в каких клинических ситуациях ее можно безопасно применять, в каком возрасте следует начинать такую терапию и до какого возраста ее можно безопасно назначать.
Данная ситуация очень напоминает массовый отказ от менопаузальной гормональной терапии (МГТ) у женщин [10] после публикации в 2002 г. предварительных результатов двойного слепого рандомизированного плацебо-контролируемого исследования Womens Health Innitiative, которое было досрочно прекращено вследствие того, что сердечно-сосудистые риски эстроген-прогестиновой терапии женщин в постменопаузе превышали преимущества [11]. В последующем результаты этого исследования неоднократно переоценивались [12, 13], и был сделан вывод, согласно которому применение МГТ в более молодом возрасте преимуществ имеет больше, чем рисков, в то время как впервые назначенная МГТ после 60 лет или через 10 лет после наступления менопаузы имеет больше рисков, чем преимуществ. Эта концепция получила название «временная гипотеза», или «окно терапевтических возможностей» [14, 15]. Было установлено, что применение МГТ в более позднем возрасте сопровождалось повышением риска артериального тромбоза, обусловленного атеросклеротическим поражением сосудов и как следствие — изменением рельефа стенки сосудов в сочетании с состоянием гиперкоагуляции, вызванной эстрогенным компонентом МГТ [16].
В связи с этим возникает ряд вопросов: могут ли существовать подобные ограничения и у мужчин, с чем может быть связан рост числа ССС на фоне ТЗТ у мужчин с возрастным гипогонадизмом, каковы оптимальные целевые значения тестостерона на фоне заместительной терапии, в каком возрасте оптимально начинать такую терапию и какой путь введения препарата является наиболее оптимальным — трансдермальный или инъекционный?
Целью данной публикации является анализ данных клинических и фундаментальных исследований о влиянии эндогенного и экзогенного тестостерона на сердечно-сосудистую систему у мужчин.
Уровни эндогенного тестостерона у пожилых мужчин и риск сердечно-сосудистых заболеваний
К факторам риска сердечно-сосудистых заболеваний (ССЗ), специфичным для мужчин, относят возраст, артериальное давление, уровни общего холестерина и холестерина липопротеидов низкой плотности [17]. Многочисленные исследования продемонстрировали обратную корреляцию между уровнем тестостерона и факторами риска ССЗ у мужчин [18—22]. В то же время исследования, посвященные влиянию возрастного гипогонадизма у мужчин на сердечно-сосудистую заболеваемость и смертность, показали неоднородные результаты. Исследование «случай—контроль» EPIC-Norfolk, включившее 11 606 мужчин в возрасте 40—79 лет, обнаружило обратную связь между уровнями эндогенного тестостеона и сердечно-сосудистой смертностью [23]. В проспективном популяционном исследовании у 794 мужчин в возрасте 50—91 года также было установлено, что пациенты с уровнем тестострона в нижнем квартиле (<241 нг/дл) имели повышенный на 38% риск сердечно-сосудистой смертности [24]. В японском исследовании у 171 мужчины в возрасте 30—69 лет те, кто имел уровень тестостерона в самом нижнем терциле (<14,2 нмоль/л), имел повышенный почти в 4 раза риск ССЗ [25]. Мета-анализ проспективных когортных исследований показал, что у мужчин с низким уровнем тестостерона был повышен риск инсульта [26]. И наконец, крупный мета-анализ, включивший 37 наблюдательных исследований и 43 041 пациента (средний возраст - 63,5 года, средняя длительность наблюдения — 333 недели), продемонстрировал, что низкий уровень тестостерона является фактором риска сердечно-сосудистой заболеваемости и смертности как в нескорректированных, так и в скорректированных моделях [27]. В других исследованиях сообщалось об отсутствии связи уровня тестостерона с риском ССЗ. В продольном когортном исследовании Cardiovascular Health Study, включившем 1032 мужчины в возрасте 66-97 лет, не было выявлено связи эндогенного тестостерона с риском ССЗ [28]. Проспективное исследование Framingham Heart Study с участием 254 мужчин (средний возраст - 75,5 лет) также не выявило статистически значимой связи между уровнем половых гормонов, сердечнососудистой заболеваемостью и общей смертностью у мужчин [29]. Результаты проспективного исследования MrOS при участии 552 мужчин старше 65 лет, проживавших в сообществах, также не подтвердили связи между уровнями тестостерона, глобулина, связывающего половые гормоны, и эстрадиола, с одной стороны, и ССС, с другой [30]. К недостаткам исследования авторы отнесли небольшую выборку больных [30]. В противоположность всем исследованиям, S. Luo et al. [31] обнаружили прямую ассоциацию между генетически опосредованными высокими уровнями эндогенного тестостерона и повышенными рисками сердечной недостаточности и ИМ у мужчин.
Данные по влиянию эндогенного тестостерона на риск венозной тромбоэмболии (ВТЭ) ограниченны. В проспективном исследовании 4673 мужчин из Copenhagen City Heart Study [32] не было выявлено связи между высокими эндогенными уровнями тестостерона, с одной стороны, и повышенным риском ВТЭ, глубоким венозным тромбозом и тромбоэмболией легочной артерии, с другой. Аналогичные результаты были получены в Atherosclerosis Risk in Communities Study - эндогенный тестостерон у мужчин не был связан с повышенным риском ВТЭ [33]. Однако S. Luo et al. обнаружили закономерность между генетически опосредованным высоким уровнем тестостерона и ВТЭ [31]. Эти противоречивые результаты могут быть связаны с различиями между исследуемыми популяциями, дизайном исследований, исходным сердечно-сосудистым риском, выбранными методиками оценки риска или методами определения половых гормонов.
Вероятнее всего, как дефицит, так и относительный избыток андрогенов у пожилых мужчин ассоциируются с негативными сердечно-сосудистыми исходами, т.е. между уровнями эндогенного тестостерона и риском ССЗ имеется U-образная зависимость [34, 35]. Эту концепцию подтверждает исследование HIMS [34], проведенное в Австралии в период с 2001 по 2010 г. и включившее возрастных мужчин (средний возраст - 70-89 лет). В данном исследовании показано, что самая высокая смертность в этой возрастной группе была при самых низких значениях уровня тестостерона (0,25-9,82 нмоль/л), а следующей по риску смерти оказалась группа с самым высоким уровнем тестостерона (15,79-46,5 нмоль/л). Самый же низкий риск смерти был отмечен при уровне общего тестостерона 12,56-15,75 нмоль/л [36].
Терапия тестостероном и риск ССС у пожилых мужчин
Не менее противоречивые результаты показали исследования по применению ТЗТ у мужчин с возрастным гипогонадизмом. Ряд исследований показал повышение риска нефатального артериального тромбоза (ИМ и ишемический инсульт) на фоне терапии тестостероном у мужчин с возрастным гипогонадизмом.
Двойное слепое плацебо-контролируемое рандомизированное исследование в параллельных группах TOM (Testosterone Treatment in Older Men with Mobility Limitations) у 209 мужчин старше 65 лет (средний возраст - 74 года) с ограниченной подвижностью было досрочно прекращено из-за повышенного риска ССС в группе пациентов, получавших трансдермальный тестостерон (23 в группе тестостерона против 5 в группе плацебо) [1]. Авторы исследования, тем не менее, отметили, что большинство пациентов имели хронические заболевания (сахарный диабет 2 типа, артериальную гипертензию и ожирение), а дозировки тестостерона (10 г 1%-ного геля ежедневно) были выше рекомендованных производителем [1]. К недостаткам исследования авторы также отнесли небольшую выборку больных, незначительное число ССС, исключение из исследования мужчин в возрасте до 65 лет и отсутствие структурного анализа побочных эффектов.
В ретроспективном когортном исследовании [2] у мужчин с гипогонадизмом (средний возраст пациентов, получавших тестостерон, - 60,6 года, ранее перенесших коронарографию на фоне терапии тестостероном), также была отмечена повышенная частота негативных ССС, включая общую смертность, ИМ и ишемический инсульт (относительный риск [ОР]=1,29; 95% доверительный интервал [ДИ]: 1,05-1,58). Авторы также отметили, что в данной когорте более 20% мужчин в анамнезе имели ИМ и сердечную недостаточность, а более 50% имели подтвержденную обструктивную ишемическую болезнь сердца (ИБС) по данным ангиографии [2].
В когортном исследовании W.D. Finkle et al. [3] также было выявлено повышение рисков нефатальных ССС на фоне терапии тестостероном, причем была показана прямая зависимость риска от времени начала терапии. Так, если терапия тестостероном была начата в возрасте до 55 лет, риск ССС не увеличивался (ОР=0,95; 95% ДИ: 0,54-1,67), однако у пациентов в возрасте 65-74 лет риск повышался более чем в 2 раза (ОР=2,19; 95% ДИ: 1,27-3,77), а у больных 75 лет и старше риск был повышен более чем в 3 раза (ОР=3,43; 95% ДИ: 1,54-7,56). Эта устойчивая ассоциация была значительно ослаблена у пациентов, принимавших ингибиторы фосфодиэстеразы 5-го типа. Авторы подчеркнули, что у мужчин, начавших ТЗТ в возрасте до 65 лет, избыточный риск ССС отмечен лишь у тех, кто имел установленные ССЗ [3]. Кроме того, установлено, что риск нефатального ИМ был повышен в первые 90 дней терапии.
В другом когортном исследовании S.Y. Loo et al. [9], проведенном в отношении 15 401 мужчины в возрасте 45 лет и старше (средний возраст - 60,4 года) продемонстрировано статистически значимое увеличение (скорректированный относительный риск [сОР]=1,21; 95% ДИ: 1,00-1,46) комбинированного риска ИМ и ишемического инсульта у пациентов, получавших терапию тестостероном. Это увеличение риска в абсолютных значениях выражалось в 2,4 дополнительного случая на 1000 человек в год. Риск ИМ и инсульта был самым высоким в течение первых 6 месяцев терапии тестостеоном и в основном был обусловлен повышенным риском среди мужчин в возрасте от 45 до 59 лет. Этот риск также увеличивался у мужчин как с предшествовавшими ССЗ, так и без них, однако результаты не достигали статистической значимости. Интересной находкой исследования оказалось то, что текущее использование ТЗТ, несмотря на повышение риска ССС, было связано с более низким риском смертности от всех причин (ОР=0,64; 95% ДИ: 0,52-0,78), а использование тестостерона в прошлом - с повышенным риском общей смертности по сравнению с неиспользованием (ОР=1,72; 95% ДИ: 1,212,45) [9]. Таким образом, риск ССС повышался и после отмены терапии тестостероном.
В противоположность этим данным, M.M. Shores et al. [8] в когортном исследовании мужчин старше 40 лет (n=1031, из них 398 получали терапию тестостероном) обнаружили снижение смертности на 39% (ОР=0,61; 95% ДИ: 0,42-0,88; p=0,008) у лиц, получавших тестостерон. При этом снижение риска смерти не зависело от возраста, наличия диабета и ИБС [8]. Пациенты в этой когорте имели более низкую частоту сердечных заболеваний (~20%), определяемых как стенокардия, ИМ, ИБС, операции по аортокоронарному шунтированию, чрескожная транслюминальная коронарная ангиопластика или сердечная недостаточность.
T.C. Cheetham et al. [5] в ретроспективном когортном исследовании, включившем 8808 (19,8%) мужчин, когда-либо принимавших тестостерон (средний возраст -58,4 года; 1,4% с предшествовавшими ССС) и 35 527 (80,2%) никогда не принимавших тестостерон (средний возраст - 59,8 года; 2,0% с предшествовавшими ССС), оценили риск ССС. Скорректированное отношение рисков (сОР) для комбинированной сердечно-сосудистой конечной точки в группе пациентов, когда-либо получавших тестостерон, составило 0,67 (95% ДИ: 0,62-0,73). Аналогичные результаты получены, когда исход был ограничен комбинированными событиями инсульта (инсульт и транзиторная ишемическая атака) (ОР=0,72; 95% ДИ: 0,62-0,84) и комбинированные сердечные события (ОИМ, нестабильная стенокардия, процедуры реваскуляризации) (ОР=0,66; 95% ДИ: 0,60-0,72). Авторы заключили, что среди мужчин с дефицитом андрогенов терапия тестостероном связана с более низким риском сердечно-сосудистых исходов в течение среднего периода наблюдения 3,4 года.
В популяционном когортном исследовании у мужчин в возрасте 66 лет и старше (10 311 пациентов, получавших тестостерон, и 28 029 - не получавших ТЗТ) средний период наблюдения составил 5,3 года (межквартильный интервал - 3,6-7,5) в группе ТЗТ и 5,1 года (3,4-7,4) в контрольной группе [37]. Было установлено, что риск ССС зависел от длительности терапии. Пациенты с самой низкой длительностью терапии тестостероном имели повышенный риск смерти (ОР=1,11; 95% ДИ: 1,03-1,20) и ССС (ОР=1,26; 95% ДИ: 1,09-1,46) по сравнению с группой контроля. Напротив, у лиц с наибольшей длительностью терапии тестостерона был снижен риск смертности на 33% (ОР=0,67; 95% ДИ: 0,620,73) и ССС на 16% (ОР=0,84; 95% ДИ: 0,72—0,98) со значительной тенденцией по терцилям (p<0,0001).
В рандомизированном плацебо-контролируемом исследовании ретроспективно оценивались результаты терапии тестостероном 857 мужчин с сахарным диабетом 2 типа в течение 4 лет после базового измерения уровня тестостерона. Низкие исходные уровни общего и свободного тестостерона были связаны с повышенной смертностью от всех причин. Терапия тестостероном и использование ингибиторов фосфодиэстеразы 5-го типа были независимо связаны с более низкой смертностью от всех причин [38], при этом наибольшая польза от двух видов лечения ботмечена у мужчин старшего возраста по сравнению с более молодыми [39].
Еще в одном крупном исследовании сравнивали частоту острого ИМ у 6355 мужчин в возрасте 66 лет и старше, получивших хотя бы одну инъекцию тестостерона, по сравнению с подобранной группой плацебо (n=19 065) в течение 8 лет [40]. Исследование не показало увеличения общего числа событий, при этом у пациентов с наиболее высоким риском ИМ наблюдалось снижение числа событий и смертности на 31% (ОР=0,69; 95% ДИ: 0,53-0,92) [40].
В ряде других исследований не продемонстрировано ни увеличения, ни снижения риска ССС на фоне терапии тестостероном у мужчин с возрастным гипогонадизмом. Так, F. Saad et al. [41], наблюдая 561 мужчину с гипогонадизмом (n=450 в возрасте 32-65 лет и n=111 в возрасте 66-84 лет) на фоне ТЗТ не обнаружили повышения риска ССС за 6 лет наблюдения ни в одной из возрастных групп, однако исследование было сфокусировано на урологических симптомах. В рандомизированном плацебо-контролируемом исследовании у 790 мужчин в возрасте 65 лет и старше с возрастным гипогонадизмом также не было показано увеличения или снижения риска ССС, однако опять же исследование сфокусировано на сексуальной функции и физических параметрах [42]. В небольшом ретроспективном когортном исследовании [7] у 165 мужчин старше 40 лет с гипогонадизмом, получавших терапию тестостероном, и 210 мужчин аналогичного возраста, не получавших этой терапии, показано нейтральное влияние экзогенного тестостерона на риск ССС.
Мета-анализ 39 рандомизированных контролируемых исследований [43] не показал негативного влияния терапии тестостероном у мужчин на риск ИМ, инсульта или смертность. И наконец, 20 наблюдательных исследований со средним периодом наблюдения 0,73-10,3 года не показали увеличения риска смертности и ССС на фоне терапии тестостероном [44]. Подобные противоречия отмечены и при анализе рисков ВТЭ на фоне терапии тестостероном. В проспективном исследовании «случай-контроль» у 30 572 мужчин в возрасте 40 лет и старше не было показано связи между ТЗТ и риском ВТЭ [45]. В ретроспективном когортном исследовании у 60 553 мужчин, получавших терапию тестостероном, также не было выявлено связи между экзогенным тестостероном и риском глубокого венозного тромбоза и тромбоэмболии легочной артерии [46].
В когортном анализе 102 650 мужчин, получавших тестостерон, и 102 650, не получавших, а также в анализе «случай-контроль» 2785 пациентов, получавших тестостерон, и 11 119, не получавших его, риски ВТЭ на фоне терапии тестостероном статистически значимо не повышались [47]. В противоположность этим данным, исследование C. Martinez et al. [48] продемонстрировало повышение риска ВТЭ на фоне терапии тестостероном у мужчин (средний возраст - 64,8 года) на 25% (сОР=1,25; 95% ДИ: 0,94-1,66) у получавших против не получавших. Авторы отметили, что повышение риска было наибольшим в первые 6 месяцев терапии (ОР=1,63; 95% ДИ: 1,12-2,37). После 6 месяцев терапии риск ВТЭ не повышался (ОР=1,00; 95% ДИ: 0,68-1,47). Повышение риска отмечено как у мужчин с патологическим гипогонадизмом (ОР=1,52; 95% ДИ: 0,94-2,46), так и без него (ОР=1,88; 95% ДИ: 1,02-3,45).
R.F. Walker et al. [49] в исследовании 39 622 мужчин (средний возраст -57,4 года) также выявили положительную ассоциацию между ТЗТ и риском ВТЭ.
После поправки на возраст использование терапии тестостероном во всех периодах наблюдения было связано с более высоким риском ВТЭ у мужчин с гипогонадизмом (отношение шансов [ОШ]=2,32; 95% ДИ: 1,97-2,74) и без (ОШ=2,02; 95% ДИ: 1,47-2,77). Среди мужчин без гипогонадизма точечная оценка для терапии тестостероном и риска ВТЭ в течение 3-месячного периода была выше для мужчин моложе 65 лет (ОШ=2,99; 95% ДИ: 1,91-4,68), чем для мужчин старшего возраста (ОШ=1,68; 95% ДИ: 0,903,14), хотя эта ассоциация не достигала статистической значимости (p=0,14). Следует отметить, что в большинстве исследований, показавших нейтральное влияние ТЗТ на риск ССС, этот риск не оценивался в зависимости от длительности применения этой терапии.
Противоречивость и неоднородность результатов, оценивающих влияние ТЗТ на риск ССС, обусловлены рядом недостатков исследований, включающих ограниченное число пациентов, разные критерии отбора и определение гипогонадизма, дозу и путь введения тестостерона, продолжительность терапии, разные методы измерения тестостерона и статистической оценки полученных результатов.
Потенциальные механизмы связи терапии тестостероном с ССС
Известно, что атеросклероз и тромбоз коронарных артерий служат причиной ИМ [50]. В двойном слепом плацебо-контролируемом исследовании M.J. Budoff et al. показана взаимосвязь терапии тестостероном и увеличения размера атеросклеротических бляшек в коронарных артериях у мужчин в возрасте 65 лет и старше с возрастным гипогонадизмом [51]. В то же время другое исследование с аналогичным дизайном у пациентов старше 60 лет (средний возраст - 67,6 года) с сопутствовавшими заболеваниями не выявило взаимосвязи терапии тестостероном и прогрессирования субклинического атеросклероза, определяемого по толщине комплекса интима-медиа сонных артерий и кальцификации коронарных артерий [52].
К возможным причинам повышения риска тромботических событий у пациентов, получающих ТЗТ, относят полицитемию и повышение гематокрита [53]. Установлено, что полицитемия встречается у 20% больных, получающих ТЗТ [53], однако причинно-следственной связи между полицитемией на фоне терапии тестостероном и повышением риска ССС впоследствии установлено не было. Также было описано, что терапия тестостероном может вызывать задержку жидкости у больных хронической сердечной недостаточностью и этот эффект имел прямую ассоциацию с возрастом [54].
Другой потенциальный механизм негативного влияния терапии тестостероном на повышение риска ССС у мужчин может быть опосредован повышением уровня эстрогенов. У мужчин тестостерон является основным источником эстрадиола плазмы, основного биологически активного эстрогена, только 20% которого секретируется яичками [55]. Из факторов, влияющих на уровень эстрадиола в плазме мужчин, тестостерон является определяющим. Однако возрастное снижение уровня тестостерона почти не отражается на уровне эстрадиола в плазме в результате повышения активности ароматазы с возрастом и связанного с возрастом увеличения жировой массы [55]. Уровни свободного и биодоступного эстрадиола незначительно снижаются с возрастом, как и соотношение свободного тестостерона к свободному эстрадиолу, что свидетельствует о возрастной ароматизации тестостерона [55]. Известно, что снижение уровня тестостерона у мужчин сопровождается развитием висцерального ожирения [18, 19]. В жировой ткани экспрессируется ароматаза, конвертирующая андрогены в эстрогены [56]. Показана обратная корреляция уровней эндогенного тестостерона с эстрадиолом у мужчин с ожирением. В исследовании G. Schneider et al. [57] уровень тестостерона у мужчин с нормальной массой тела составлял 519±42 нг/дл, а у мужчин с морбидным ожирением — 348±35 нг/дл, при этом уровень эстрадиола был в 2 раза выше у мужчин с ожирением, чем у худых, несмотря на более низкие показатели тестостерона.
Терапия тестостероном у мужчин приводила к увеличению и плазменных уровней не только тестостерона, но и эстрадиола [58]. Особенно этот эффект может проявляться при супрафизиологических концентрациях тестостерона, наблюдаемых на фоне инъекционных форм тестостерона [59]. Повышенные уровни эстрадиола у мужчин независимо ассоциируются с дислипидемией [60], прогрессированием атеросклероза [61], инсультом [62] и ИМ [63-65].
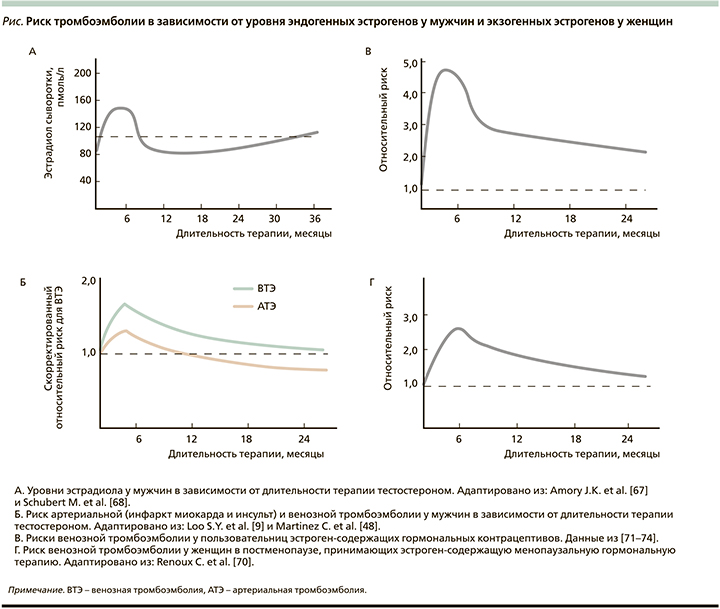
Установлено, что на фоне терапии тестостероном уровни общего и свободного эстрадиола повышаются в большей степени у пожилых (59-75 лет), чем у молодых (19-35 лет) мужчин [66]. В исследованиях J.K. Amory et al. [67] и M. Schubert et al. [68] показано, что уровень эстрадиола на фоне терапии тестостероном значимо повышается в первый год терапии, особенно в первые 6 месяцев, что по времени совпадает с повышением риска как артериальной тромбоэмболии [9], так и ВТЭ [48], как это было продемонстрировано в клинических исследованиях. Снижение концентрации эстрадиола при увеличении продолжительности терапии можно объяснить уменьшением жировой ткани на фоне терапии тестостероном, что может приводить к уменьшению его ароматизации.
Исследование E.A. Jankowska et al. [69] продемонстрировало нелинейную U-образную зависимость смертности средимужчинсССЗот уровней эстрадиола. Исследование показало, что у мужчин с уровнем эстрадиола 37,40 пг/мл или выше уровень смертности увеличился на 133%, тогда как у мужчин с уровнем эстрадиола ниже 12,19 пг/мл она увеличилась на 317%. Самый же низкий уровень смертности отмечен у мужчин с уровнем эстрадиола от 21,80 до 30,11 пг/мл. Аналогичная хронологическая взаимосвязь длительности приема эстрогенов и риска ВТЭ отмечена и у женщин, получавших как МГТ [70], так и эстроген-содержащие гормональные контрацептивы [71-74] (см. рисунок). В совокупности все эти данные позволяют предположить негативное влияние развивающейся гиперэстрогении на фоне терапии тестостероном в первые месяцы приема на сердечно-сосудистые осложнения у пожилых мужчин. У женщин, принимавших комбинированные оральные контрацептивы, эта взаимосвязь объяснялась наличием наследственных тромбофилий, которые клинически проявлялись в форме тромбозов в первые месяцы приема комбинированных оральных контрацептивов [75]. C.J. Glueck et al. [76] установили, что повышенный риск ВТЭ в первые месяцы терапии тестостероном у мужчин был также вызван наследственными тромбофилиями.
Механизмы, связывающиеэстрогены с тромботическими событиями, могут быть связаны с маркерами активированной коагуляции, снижением уровня ингибиторов коагуляции и активацией резистентности к протеину С [77].
Таким образом, применение препаратов тестостерона мужчинами с гипогонадизмом, особенно на фоне ожирения, может приводить к увеличению не только плазменных концентраций тестостерона, но и эстрадиола. Эстрадиол оказывает негативное влияние на систему гемостаза, повышая риск гиперкоагуляции, что в совокупности с атеросклеротическим поражением коронарных артерий может повышать риск ИМ у пожилых мужчин аналогично тому, как это происходит у женщин в поздней менопаузе на фоне МГТ [78].
Роль пути введения тестостерона при ТЗТ
Данные о влиянии различных форм тестостерона на риск ССЗ у мужчин также противоречивы. Терапия тестостероном чаще всего назначается в виде трансдермальных гелей, пластырей или внутримышечных инъекций, при этом каждая форма имеет свою скорость всасывания, потенциально влияюшую на сердечно-сосудистые патофизиологические факторы [79].
В ретроспективном когортном исследовании [80], включившем 544 115 пользователей препаратов тестостерона (37,4% получали тестостерон в виде инъекций, 6,9% - в виде пластыря и 55,8% - в виде геля) установлено, что лица, получавшие инъекции, имели повышенный на 26% риск ССС (включая ИМ, нестабильную стенокардию и инсульт), на 16% повышенный риск госпитализации и на 34% повышенный риск смерти по сравнению с пользователями гелей. По сравнению с гелями пластыри не увеличивали риск ССС (ОР=1,10; 95% ДИ: 0,94-1,29), госпитализации (ОР=1,04; 95% ДИ: 1,00-1,08) или смерти (ОР=1,02; 95% ДИ: 0,77-1,33). Риск ВТЭ не зависел от пути введения тестостерона [80]. В исследовании, продемонстрировавшем увеличение числа ССС на фоне терапии тестостероном [2], не было выявлено зависимости от пути введения тестостерона (гели, пластыри, инъекции). В исследованиях, показавших краткосрочное повышение риска ВТЭ на фоне терапии тестостероном, также не было выявлено зависимости повышения риска от пути введения тестостерона [48, 49]. В свою очередь S.E. Borst и J.F. Yarrow [81], проанализировав исследования по сердечно-сосудистым осложнениям терапии тестостероном, пришли к выводу, согласно которому инъекционные формы тестостерона безопаснее, чем гели и пластыри.
Таким образом, имеющиеся противоречивые данные не позволяют сделать вывод о наиболее оптимальном и безопасном пути введения тестостерона.
Оптимальная концентрация тестостерона на фоне ТЗТ
Важность достижения оптимальных уровней тестостерона на фоне ТЗТ продемонстрирована в исследовании R. Sharma et al. [82]. Для оценки риска ССС на фоне ТЗТ в ретроспективном когортном исследовании 83 010 мужчин-ветеранов (средний возраст получавших тестостерон - 66,0 лет) с документально подтвержденным гипогонадизмом были разделены на 3 группы (Гр. 1 — T3T с нормализацией уровней общего тестостерона, Гр. 2 — T3T без нормализации уровней общего тестостерона и Гр. 3 - не получавших T3T). Смертность от всех причин (ОР=0,44; 95% ДИ: 0,42—0,46), риск ИМ (ОР=0,76; 95% ДИ: 0,63—0,93) и инсульта (ОР=0,64; 95% ДИ: 0,43—0,96) были значительно ниже в группе Гр. 1 (n=43 931, средний возраст —с66 лет, средний период наблюдения — 6,2 года) по сравнению с Гр. 3 (n=13 378, средний возраст — 66 лет, средний период наблюдения — 4,7 года). Точно также смертность от всех причин (ОР=0,53; 95% ДИ: 0,50—0,55), риск ИМ (ОР=0,82; ДИ: 0,71—0,95) и инсульта (ОР=0,70; 95%
ДИ: 0,51—0,96) были значительно ниже в Гр. 1 по сравнению с Гр. 2 (n=25 701; средний возраст 66 лет, средний период наблюдения - 4,6 года). Не было разницы в риске ИМ или инсульта между Гр. 2 и Гр. 3. Таким образом, в этом когортном исследовании с большим периодом наблюдения нормализация уровней общего тестостерона на фоне T3T была связана со значительным снижением общей смертности, ИМ и инсульта [82].
В исследовании с аналогичным дизайном [83] оценивали риск рецидива ИМ и общую смертность среди пациентов с перенесенным ИМ на фоне терапии тестостероном. Точно так же общая смертность снижалась только в группе пациентов, достигших нормальных показателей тестостерона, а риск повторного ИМ был одинаковым во всех 3 группах [83].
На сегодняшний день не существует единой точки зрения об оптимальной концентрации общего тестостерона на фоне ТЗТ у мужчин с возрастным андрогенным дефицитом. По мнению экспертов, отраженному в клинических рекомендациях AUA [84], следует использовать минимальную дозировку тестостерона, необходимую для достижения нормального физиологического диапазона тестостерона в 450-600 нг/дл, что является средним уровнем нормального диапазона для большинства лабораторий. Авторы признают, что для определения этого среднего диапазона могут потребоваться возрастные поправки, однако с практической точки зрения диапазон 450-600 нг/дл приемлем для всех возрастных групп. Достижение уровня тестостерона в этом окне должно облегчить любые симптомы, которые действительно связаны с дефицитом тестостерона [85, 86].
Заключение
Таким образом, ТЗТ может усугублять сердечно-сосудистую патологию у некоторых пациентов с субоптимальными уровнями тестостерона. В целом риск ССС на фоне ТЗТ невелик и ограничен недавними пользователями. Вероятнее всего, у мужчин в отличие от женщин сложно будет выделить определенный временной интервал, после которого применение препаратов тестостерона будет иметь больше рисков, чем преимуществ, т.к. у большинства женщин менопауза наступает в возрасте 50-52 лет [87], в то время как у мужчин наблюдаются индивидуальные различия в сроках наступления возрастного андрогенного дефицита, обусловленные главным образом половой конституцией. Соответственно, и скорость прогрессирования атеросклероза будет различаться у разных мужчин одного и того же возраста в зависимости от выраженности дефицита тестостерона и генетических факторов. В то же время наибольшие риски, согласно имеющимся на сегодняшний день данным, отмечены у мужчин старше 60-65 лет.
Также необходимы маркеры, предсказывающие развитие сердечно-сосудистых осложнений на фоне ТЗТ. Измерение уровня эстрадиола и определение его безопасных пороговых концентраций в первые 6 месяцев ТЗТ могут быть ключом к решению проблемы сердечно-сосудистых осложнений андроген-заместительной терапии при возрастном гипогонадизме. Помимо этого необходимо определять группы риска пациентов, у которых такие осложнения наиболее вероятны. Определение генетических полиморфизмов, ассоциированных с тромбофилией, может быть целесообразным для пациентов с семейным анамнезом тромбоэмболии. В свою очередь, чем раньше при возрастном андрогеном дефиците будет начата терапия тестостероном, тем больше преимуществ и меньше рисков она будет иметь. Это трудновыполнимая задача, т.к. в настоящее время популяционный скрининг возрастного гипогонадизма у мужчин не рекомендован [88]. Требуются исследования с хорошим дизайном и большой выборкой пациентов, чтобы подтвердить или опровергнуть как «временную», так и «эстрогеновую» гипотезу.



