Система интерферонов (ИФН) и иммунная система (ИС) ребенка находится в процессе становления с момента рождения и до окончания периода полового созревания, переживая при этом 5 критических периодов, во время которых развивающийся организм ребенка особо уязвим и высокочувствителен к инфекциям. Немаловажную роль в развитии ответа ИС и системы ИФН ребенка при встрече с инфекционными патогенами, безусловно, играют как генетические особенности ИС и системы ИФН, так и особенности микро- и макроокружения. ИС здорового ребенка проходит определенные этапы «тренировки» при его столкновении с внезапно возросшим или постепенно возрастающим потоком микробных антигенов при значительном расширении контактов, в первую очередь, в детском коллективе. У детей с адекватно функционирующей системой ИФН и ИС наблюдается значительное возрастание эпизодов ОРЗ (более 10 в год) на первых этапах посещения детских коллективов или контактов с часто болеющими членами семьи. Реабилитация таких детей, которых относят к диспансерной группе часто и длительно болеющих (ЧДБ) детей, как правило, дает хороший результат после проведения лечебно-профилактических и оздоровительных мероприятий количество эпизодов ОРЗ значительно уменьшается. В то же время среди ЧДБ детей имеются пациенты, не отвечающие на традиционные методы реабилитации и, несмотря на кажущуюся адекватность проводимых лечебных мероприятий, они продолжают болеть респираторными инфекциями (вирусными, бактериальными или вирусно-бактериальными) с высокой степенью частоты. Такие пациенты, как правило, относятся к категории иммунокомпрометированных, при этом частота эпизодов ОРВИ может достигать 15–24 и более в год. Такая высокая частота возвратных респираторных инфекций является клиническим проявлением инфекционного синдрома, ассоциированного с нарушениями механизмов функционирования противовирусной и антибактериальной иммунной защиты, а также с дефектами системы интерферонов (ИФН). Кроме того, показано, что у детей возвратные ОРВИ часто ассоциированы с различными активными и/или латентными герпесвирусными инфекциями [1–5].
При контакте с вирусами должна происходить немедленная активация врожденного иммунитета – продукция ИФН I типа, и провоспалительных цитокинов, которые инициируют последующее включение в активную работу механизмов адаптивного иммунитета. ИФН реализуют свои эффекты через когнитивные рецепторные комплексы (IFNAR и IFNGR) [6, 7]. При острой вирусной инфекции значительно повышаются уровни ИФН и более 70% клеток находятся в состоянии антивирусного статуса, т.е. защищены от внедрения вирусов, и способны активно их обезвреживать. В то же время тяжелые вирусные инфекции повреждают систему ИФН [8], могут приводить к ее истощению и как следствие – к присоединению вторичной инфекции. Описаны врожденные генетические дефекты синтеза ИФНα/β и ИФНγ, дефекты рецепторов к ИФНα и ИФНγ (IFNAR и IFNGR), которые сопровождаются клиническими проявлениями тяжелой вирусной и/или микобактериальной инфекции. С другой стороны, многочисленными исследованиями убедительно показано, что вторичное приобретенное нарушение системы ИФН также влечет за собой снижение противовирусной резистентности. Вирусы используют различные контрмеры для борьбы с системой ИФН. Они могут не только ускользать от воздействия ИФН, но и ингибировать действие ИФН, нарушать их продукцию посредством разнообразных механизмов [9–12]. Описаны приобретенные дефекты в системе ИФН у лиц, страдающих повторными ОРВИ и различными герпесвирусными инфекциями (ГВИ). Кроме того, показана возможность длительной персистенции респираторных вирусов, в т.ч. и непосредственно в клетках иммунной системы (ИС) [2, 3, 6, 13].
Наиболее широко в комплексе иммунореабилитационных мероприятий для иммунокомпрометированных детей с повторными ОРВИ и ГВИ используются различные препараты рекомбинантного ИФНα2, что обусловлено универсальным противовирусным, антибактериальным и иммуномодулирующим характером действия ИФНα2 [1, 5, 13–15]. Многолетний опыт использования препарата Виферон® – рекомбинантного человеческого ИФНα2 в комбинации с антиоксидантами (витаминами Е и С), показал, что наряду с позитивными эффектами в ряде случаев при проведении интерферонотерапии детей как в острый период, так и при повторных ОРВИ, рецидивирующей и/или активной различной ГВИ не удается достичь стойкой и длительной клинико-иммунологической ремиссии, элиминации вирусных патогенов [15]. Предложена и доказана целесообразность модификации интерферонотерапии, заключающейся в применении увеличенных доз и длительности курса терапии в острый период ОРВИ у детей с отягощенным преморбидным фоном [1, 14]. При повышенной восприимчивости детей к ОРВИ, наличии иммуно- и интерферонодефицита обосновано использование пролонгированной терапии (не менее 2–2,5 месяцев) рекомбинантным ИФНα с постепенным («шаг за шагом») снижением суточной дозы препарата каждые 2–4 недели. Однако даже при таком подходе части иммунокомпрометированных детей при существенном увеличении длительности клинически благополучного периода не удается добиться желаемого клинического эффекта и восстановления нарушенных функций ИС и системы ИФН [13]. В то же время имеются пациенты, страдающие не только возвратными вирусными, но и бактериальными инфекциями респираторного тракта и лимфоглоточного кольца, у которых наряду с нарушениями в системе ИФН имеют место дефекты функционирования противобактериального иммунитета, манифестирующие частыми обострениями хронического тонзиллита, хронического синусита, хронического отита и т.д.

Исходя из изложенного, нами сделано предположение о возможности повышения клинической эффективности и улучшения результатов реабилитации иммунокомпрометированных детей с возвратными ОРВИ, с возвратными ОРВИ, осложняющимися частыми обострениями хронической бактериальной инфекции лимфоглоточного кольца и респираторного тракта, ассоциированными с рецидивирующими и латентными ГВИ, за счет оптимизации сочетанной пролонгированной интерферонотерапии с дифференцированной в зависимости от выявляемых нарушений ИС иммунотерапией.
Цель исследования: разработать эффективную программу интерферонотерапии в сочетании с дифференцированной в зависимости от выявляемых нарушений ИС иммунотерапией для иммунокомпрометированных детей, страдающих возвратными вирусными или вирусно-бактериальными респираторными инфекциями, ассоциированными с рецидивирующими и/или латентными ГВИ.

Материал и методы
Под нашим наблюдением находились 47 детей в возрасте от 5 до 8 лет обоего пола: 1-я группа – 13 детей, страдающих повторными ОРВИ, ассоциированными с моно- или микст- ГВИ (ВПГ I/II типы, ВЭБ, ЦМВ, ВГЧ VI тип); 2-я группа – 14 детей, страдающих повторными ОРВИ, ассоциированными с моно- или микст-ГВИ (ВПГ I/II типы, ВЭБ, ЦМВ, ВГЧ VI тип); 3-я группа – 20 детей с повторными ОРВИ, ассоциированными с хроническими латентными или рецидивирующими ГВИ (ВПГ I/II типа, ВЭБ, ЦМВ, ВГЧ VI тип), и хронической ЛОР-патологией. Контрольную группу составили 20 условно здоровых детей, сопоставимых по полу и возрасту. Тестирование состояния ИС и ИФН статуса проводилось дважды – до и после проведения курсов интерфероно- и иммунотерапии вне периода острых клинических проявлений респираторных и герпетических инфекций, хронических заболеваний ЛОР-органов. Исследованы: а) субпопуляции Т-, В-лимфоцитов, естественных киллерных клеток (ЕКК) (Beckman Coulter, США); б) уровень сывороточных IgA, IgM, IgG (ИФА); в) фагоцитарная и микробицидная функции нейтрофильных гранулоцитов (НГ) с определением количества активно фагоцитирующих НГ (%ФАН, ФАНабс), оценкой процессов киллинговой активности (ФЧ и ФИ) и переваривания (%П, ИП, ИППА); г) NADPH-оксидазная активность НГ- NBT-тест, спонтанный и стимулированный St. aureus (штамм 209): %ФПК, СЦИ и коэффициент мобилизации (КМ – %ФПКст/%ФПКсп.); д) ИФН-статус – уровень сывороточных ИФНα, ИФНγ (ИФА). Детекция герпесвирусов проводилась серологическими и ПЦР-методами. Для выявления типичной и атипичной бактериальной флоры использовались бактериологические посевы из носо- и ротоглотки, ПЦР и серодиагностика. Для оценки клинической эффективности комбинированной интерфероно- и иммунотерапии использовались клинические критерии: частота и длительность ОРВИ, длительность клинически благополучного периода. Статистическую обработку данных проводили в программном пакете StatSoft Statistica 6.0. Для сравнения групп использовали непараметрические критерии: U-критерий Манна–Уитни и критерий Вилкоксона. Различие групп полагали статистически значимым при р<0,05.
Результаты исследования
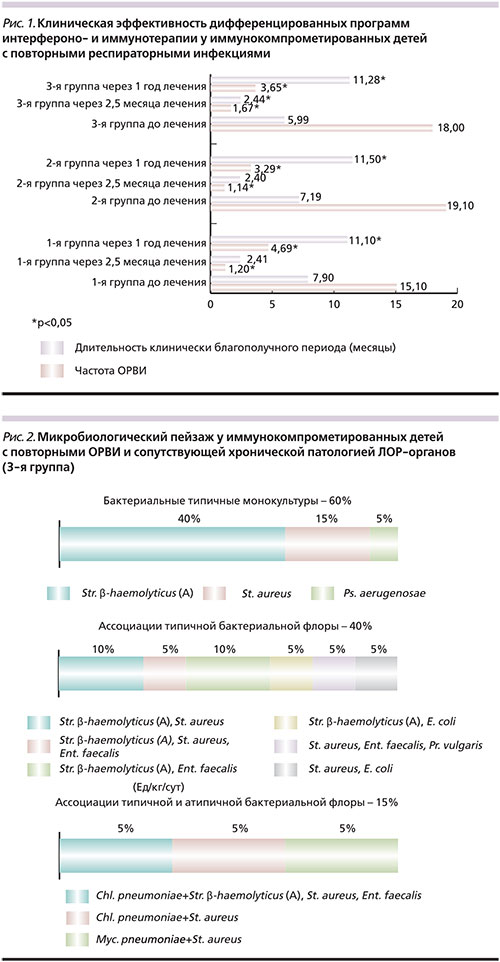
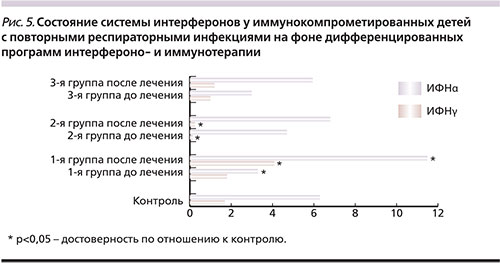
Анализируя клинический статус детей, важно отметить, что в данные группы исследования вошли т.н. трудные дети, имеющие клинические признаки иммунокомпрометированности. Все дети на протяжении 2 и более лет (в среднем 4,5 года) переносили с высокой частотой повторяемости ОРВИ – от 10 до 24 и более ОРВИ в год, с продолжительностью острого периода ОРВИ от 4 до 14 и более дней (рис. 1). А в 3-й группе детей повторные ОРВИ сопровождались частыми обострениями хронических заболеваний ЛОР-органов. При проведении клинической, серологической и ПЦР-диагностики, направленной на выявление ГВИ, у 100% детей с повторными ОРВИ выявлены различные варианты моно- и микст-ГВИ (ВПГ I/II типов, ВЭБ, ЦМВ, ВГЧ VI тип), при этом в 100% случаев выявлена репликация разных типов герпесвирусов. Наличие рецидивирующих форм ВПГ I/II типов встречалось в 40% случаев. У детей с сопутствующей хронической патологией ЛОР-органов (3-я группа) микробиологический пейзаж при исследовании бактериологических посевов из носо- и ротоглотки представлен в 60% случаев монокультурами и в 40% случаев ассоциациями представителей типичной бактериальной флоры, в 15% случаев выявлены ассоциации атипичной и типичной бактериальной флоры (рис. 2).
По данным анамнеза детей с клиническими признаками иммунокомпрометированности, ранее при проведении традиционного лечения отмечены резистентность к терапии повторных ОРВИ, непродолжительные позитивные клинические эффекты на фоне эпизодических коротких курсов интерфероно- или иммунотерапии. При столь высокой повторяемости и продолжительности ОРВИ с осложненным и неосложненным течением длительность клинически благополучного периода была всего 6–7 месяцев в году.

При тестировании состояния иммунной системы детей с повторными ОРВИ были выявлены различные нарушения ИС: изолированные (1-я гр. – 46%; 2-я гр.– 42%; 3-я гр. – 65%) и комбинированные (1-я гр. – 54%; 2-я гр. – 58%; 3-я гр. – 35%) иммунодефициты. При этом преобладающим было дефектное функционирование системы НГ (1-я гр. – 96%; 2-я гр. –93%, 3-я гр. – 90%), а в 3-й группе на 2-м месте по частоте встречаемости – дефекты гуморального иммунитета (35%).
Состояние лимфоцитарного зве-на у детей с повторными ОРВИ имело однонаправленные изменения в группах исследования (рис. 3). Абсолютное содержание цитотоксических CD3+CD8+-лимфоцитов было достоверно повышено во всех группах (р1<0,05, р2<0,05, р3<0,05), что привело к снижению иммунорегуляторного индекса (ИРИ) в 1,3 раза (р1<0,05, р2<0,05, р3<0,05). Также увеличено абсолютное содержание СD16+CD56+- лимфоцитов (ЕКК) (р1<0,05, р2<0,05, р3<0,05). Вероятно, увеличение CD3+CD8+-лимфоцитов и ЕКК связано с ответом на имеющуюся постоянную вирусную нагрузку (персистенция и репликация респираторных вирусов и герпесвирусов), несмотря на отсутствие острых клинических проявлений заболеваний. Со стороны гуморального иммунитета изменения выявлены у 3-й группы детей с сопутствующей хронической патологией ЛОР-органов в виде незначительного увеличения уровня IgМ и снижения уровня IgA у 35% детей на фоне неадекватного IgG ответа на имеющийся инфекционный процесс (рис. 3в). Анализ состояния системы НГ у детей всех групп с повторными ОРВИ показал наличие дефектов их фагоцитарной и микробицидной функций, проявляющихся депрессией поглотительной, киллинговой и переваривающей, в т.ч. NADPH-оксидазной, активности (рис. 4).
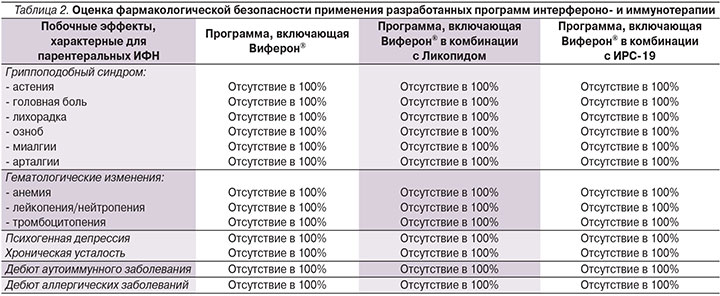
В ИФН-статусе у детей с повторными ОРВИ выявлено, что в 1-й и 2-й группах детей ИФНα был снижен в 1,9 и 1,4 раза соответственно (1-я гр. – 3,39±0,87 против 6,42±1,05 пг/мл в контроле, р<0,05; 2-я гр. – 4,62±0,91 против 6,42±1,05 пг/мл в контроле, р>0,05) (рис. 5). Значительный дефицит ИФНγ имел место во 2-й группе (0,11±0,07 против 1,78±0,53 пг/мл в контроле, р<0,001), а в 1-й группе ИФНγ был в пределах контрольных значений (1,8±0,51 против 1,78±0,53 пг/мл в контроле, р>0,05). В 3-й группе также выявлено дефектное функционирование системы ИФН. Так, на фоне персистенции респираторных вирусов и репликации герпесвирусов уровень сывороточного ИФНα и ИФНγ не возрастал в ответ на контакт с вирусами, а оставался в пределах контрольных значений (ИФНα – 5,07±0,25 против 6,42±1,05 пг/мл в контроле, р>0,05; ИФНγ 1,05±0,11 против 1,78±0,53 пг/мл в контроле, р>0,05) (рис. 5). Таким образом, в 100% случаев у детей с повторными ОРВИ установлены дефекты системы ИФН в виде снижения уровня ИФНα и/или ИФНγ либо отсутствия адекватного ответа на вирусную нагрузку системы ИФН.
На основе выявленных нарушений функционирования иммунной и интерфероновой систем нами разработаны программы оптимизированной монотерапии рекомбинантным ИФНα2 в комбинации с антиоксидантами (Виферон®) и комбинированной интерфероно- и иммуномодулирующей терапии, учитывающие дифференцированные подходы к реабилитации иммунокомпрометированных детей с повторными ОРВИ. Обследованные иммунокомпрометированные дети, рандомизированые на три группы в зависимости от клинико-иммунологического статуса, получали следующие программы интерфероно- и иммунотерапии (табл. 1).
В результате проведения базисной системной и локальной терапии препаратом Виферон® в виде моно- или комбинированной интерфероно- и иммунотерапии продемонстрирована высокая клиническая эффективность разработанных программ лечения детей с повторными ОРВИ, ассоциированными с ГВИ, без сопутствующей хронической ЛОР-патологии (группы 1 и 2) или сопровождающихся хроническими заболеваниями ЛОР-органов (группа 3) как после окончания курсового лечения, так и в катамнезе через год (рис. 1). В рамках программного лечения регистрировались единичные, как правило неосложненные, ОРВИ. После окончания курсового лечения частота эпизодов ОРВИ сократилась в 12,6 раза в 1-й группе, в 16,8 – во 2-й и в 10,7 – в 3-й. Продолжительность клинически благополучного периода возросла в 3 раза (р1<0,05, р2<0,05, р3<0,05).
За год наблюдения произошло значительное сокращение частоты ОРВИ: в 3,2 раза – в 1-й группе, в 5,8 – во 2-й, в 5 раз –в 3-й, длительности периода острых клинических проявлений – в 1,2–1,4 раза с 10–14 и более дней до 5–6 дней. Как следствие – продолжительность клинически благополучного периода возросла в 1,5–1,9 раза с 6–7 до 11 месяцев в год (р1<0,05, р2<0,05, р3<0,05), т.е. период между эпизодами ОРВИ увеличился в среднем с 7–10 до 100–160 дней (рис.1). У детей группы 3 осложненное течение ОРВИ в виде присоединения острой и/или обострения хронической бактериальной инфекции респираторного тракта и ЛОР-органов зарегистрировано через 2,5 месяца лечения лишь у 15% и через год у 60% детей, тогда как до лечения у 100% детей ОРВИ протекали с бактериальными осложнениями. Соответственно, частота назначения курсов антибактериальной терапии уменьшилась с 8 до 1 курса в год после проведения лечения. Важно подчеркнуть, что всеми иммунокомпрометированными детьми достигнуты позитивные клинические результаты благодаря дифференцированным подходам к проведению интерфероно- и иммунотерапии, что позволяет как улучшить состояние здоровья детей, так и адаптировать их к дошкольно-школьным учреждениям.
Немаловажно и то, что значительно сократилось число детей (в 2,5–4 раза) с рецидивами орофациальной формы ВПГ I/II типов инфекции, а случаи возникновения обострений инфекции были единичными на более поздних сроках наблюдения (через 8–10 месяцев). Снижение вирусной нагрузки через 2,5 месяца лечения наблюдалось и по другим ГВИ (ВЭБ, ЦМВ, ВГЧ-VI). Так, уменьшилось число детей с репликацией герпесвирусов (ВЭБ, ЦМВ, ВГЧ-VI) в группах исследования, особенно детей 1-й группы, у которых до лечения была более низкая репликативная активность вирусов. После проведенной интерфероно- и иммунотерапии детекция герпесвирусных белков обнаружилась только в одном биоматериале (слюна или соскоб из носоглотки), тогда как до лечения герпесвирусы выделялись из нескольких биоматериалов (кровь, слюна, соскоб из носоглотки, моча).
Позитивный клинический эффект проведенной интерфероно- и иммунотерапии иммунокомпрометированным детям с повторными ОРВИ сопровождался и улучшением параметров, характеризующих состояние ИС и системы ИФН.
Так, в 1-й группе детей, получивших Виферон и Изопринозин, количество CD3+CD8+-лимфоцитов снизилось до уровня контроля (р>0,05) и восстановился баланс между CD3+CD4+- и CD3+CD8+-лимфоцитами (р>0,05). При этом абсолютное содержание СD16+CD56+-лимфоцитов осталось повышенным (р<0,05) (рис. 3а). Фагоцитарная активность НГ имела тенденцию к восстановлению, но показатели всех исследуемых параметров оставались ниже контрольных значений: %ФАН (р<0,001), ФЧ (р<0,05), ФИ (р<0,001), ИП (р<0,001). При этом резервная NADPH-оксидазная активность повысилась в 2 раза по КМ ФПК и в 1,4 раза по КМ СЦИ по сравнению с исходными данными, что было выше контроля (р1<0,05, р2<0,05) (рис. 4а). При оценке системы ИФН достоверно увеличился как уровень ИФНα – в 3,4 раза (с 3,39±0,87 до 11,49±2,31 пг/мл, р<0,05), так и уровень ИФНγ – в 2,3 раза (с 1,8±0,51 до 4,17±10,72 пг/мл, р<0,05) и стал выше уровня здорового контроля: по ИФНα в – 1,8 раза (р<0,05) и по ИФНγ – в 2,3 (р<0,05) (рис. 5).
Во 2-й группе детей, получивших Виферон, Ликопид и Изопринозин, увеличилось количество активно фагоцитирующих НГ до контрольных величин, при этом восстановилась поглотительная функция НГ (ФЧ, ФИ), улучшилась интенсивность и завершенность фагоцитарного акта (ИП, ИППА). Кроме того, отмечена активация резервной NADPH-оксидазной активности в 2 раза по КМ ФПК и в 1,6 раза по КМ СЦИ по отношению к показателям до лечения, что выше контроля (р1<0,05, р2<0,05) (рис. 4б). У данной группы детей с более глубокими дефектами в системе ИФН уровень ИФНα восстановился до такового здоровых детей (с 4,62±0,91 до 6,85±0,95 пг/мл, р>0,05), а ИФНγ при тенденции к повышению оставался ниже контрольных значений (с 0,11±0,07 до 0,21±0,12 пг/мл против 1,78±0,53 пг/мл в контроле, р<0,05) (рис. 5). При этом снижения содержания CD3+CD8+-лимфоцитов до контрольных значений не произошло (р<0,01); 0,86±0,04×109 против 0,62±0,08×109 (р<0,01), а ИРИ увеличился до уровня контроля (р>0,05). Одновременно после курса терапии количество других клеток с цитотоксической направленностью действия – ЕКК – также снизилось незначительно и по-прежнему было достоверно повышенным (р<0,05) (рис. 3б).
Вероятно, отсутствие полного восстановления количества цитотоксических Т-лимфоцитов, ЕКК связано с уменьшенной, но еще сохраняющейся после курса комбинированной интерфероно- и иммунотерапии репликативной герпесвирусной активностью в 1-й и 2-й исследуемых группах, особенно во 2-й группе детей, имеющих в большинстве микст-герпетическую инфекцию с высокой вирусной нагрузкой.
В 3-й группе детей, получивших Виферон, ИРС-19 и Изопринозин, параметры клеточного иммунитета (CD3+CD8+, ЕКК) восстановились до уровня здоровых детей (р1<0,05, р2<0,05) (рис. 3в). Характеризуя гуморальный иммунитет детей на фоне проведения интерфероно- и иммунотерапии, наибольшие изменения связаны с нормализацией уровня IgA, IgM, IgG, что клинически сопровождается уменьшением частоты обострений хронических заболеваний ЛОР-органов, частоты ОРВИ и их осложненного течения (рис. 3в). На фоне проводимой комбинированной интерфероно- и иммунотерапии количество активно «работающих» НГ увеличилось до контрольных значений (%ФАН 51,17±0,41; р>0,05) при одновременной нормализации поглотительных функций (ФИ 2,16±0,16; р>0,05). Сохраняется некоторое снижение процессов киллинга и переваривания НГ (ИП 1,37±0,13; р<0,05), несмотря на стимуляцию резервной микробицидной активности NADPH-оксидаз (КМ СЦИ, р<0,05) (рис. 4в). Важно отметить, что в 3-й группе детей, имеющих неадекватный ответ системы ИФН на вирусно-бактериальную нагрузку в рамках проводимой программы интерфероно- и иммунотерапии при снижении «шаг за шагом» дозы препарата Виферон® отмечалась тенденция к восстановлению и поддержанию уровня ИФНα (с 5,07±0,25 по 5,97±1,94 пг/мл против 6,42±1,05 пг/мл в контроле, р>0,05) и ИФНγ (с 1,05±0,11 по 1,21±0,86 пг/мл против 1,78±0,53 пг/мл в контроле, р>0,05) в пределах контрольных значений (рис. 5), что сопровождалось позитивными клинико-лабораторными параллелями в виде уменьшения вирусной нагрузки: снижения частоты ОРВИ, репликации герпесвирусов.
Следует отметить, что дифференцированные подходы к выбору тактики интерфероно- и иммунотерапии иммунокомпрометированных детей с возвратными острыми респираторными инфекциями демонстрируют различные позитивные модулирующие клинико-иммунологические эффекты во всех трех группах исследования, направленные на восстановление полноценности реагирования преимущественно врожденного иммунитета и не оказывающие негативного воздействия на имеющийся адекватный ответ адаптивного противовирусного и антибактериального иммунитета. При использовании пролонгированной в адекватных дозах моно- интерферонотерапии и комбинированной интерфероно- и иммуномодулирующей терапии побочных эффектов, в т.ч. характерных для парентеральных интерферонов, не зарегистрировано ни во время проведения лечения, ни через год наблюдения в катамнезе ни у одного пациента (табл. 2).
Заключение
Программы комбинированной интерфероно- и иммунотерапии, разработанные для лечения и реабилитации иммунокомпрометированных детей с повторными ОРВИ (от 8 до 24 и более эпизодов в год), хроническими латентными или рецидивирующими ГВИ (ВПГ I/II типов, ВЭБ, ЦМВ, ВГЧ-VI) с сопутствующей хронической ЛОР-патологией или без таковой, показали высокую клиническую эффективность: значительное снижение частоты эпизодов повторных ОРВИ, при этом длительность клинически благополучного периода увеличилась с 6 до 11 месяцев в год. Одновременно значительно сократилось число детей с рецидивами орофациальной формы ВПГ I/II типов инфекции и случаи возникновения обострения ГВИ были единичными. Отмечено также уменьшение репликативной активности герпесвирусов (ВЭБ, ЦМВ, ВГЧ-VI). Выявлена и позитивная иммунологическая эффективность: отмечен модулирующий характер влияний предложенных программ лечения на Т-клеточное и гуморальное звенья ИС, ЕКК, НГ, систему ИФН. Адекватные дозы монотерапии рекомбинантным ИФНα2 способствуют значимому повышению уровней ИФНα и ИФНγ у детей с ассоциированными повторными ОРВИ и различными ГВИ (1-я группа). Достигнутый эффект повышения уровней сывороточного ИФНα и ИФНγ необходим для элиминации или прекращения репликации респираторных вирусов или герпесвирусов. Такое повышение уровней сывороточного ИФНα и ИФНγ является признаком позитивной активации продукции ИФН и коррелирует с позитивной клинической динамикой. Использование интерферонотерпии в комбинации с ликопидом позволило скорректировать дефектное функционирование системы не только ИФН (восстановление преимущественно уровня ИФНα), но и НГ у детей с ассоциированными повторными респираторными и различными ГВИ (2-я группа). При наличии вирусно-бактериального процесса (3-я группа), ассоциированного с неадекватной работой системы ИФН в сочетании с дефектным функционированием НГ и гуморального звена, включение в программу лечения ИРС-19 на фоне пролонгированной терапии препаратом Виферон® демонстрирует весомые преимущества, связанные с эффективной коррекцией выявленных нарушений, преимущественно гуморального и лимфоцитарного звеньев. Таким образом, отмечена дифференцированность влияний различных программ интерфероно- и иммунотерапии на восстановление дефектных звеньев ИС и системы ИФН: при выявлении мононарушений в системе ИФН имеет место восстановление уровней сывороточного ИФНα в 100% случаев на фоне пролонгированной терапии препаратом Виферон® в адекватных дозах, в случаях выраженных дефектов функционирования НГ и нарушений системы ИФН выявлены преимущества комбинированной терапии препаратом Виферон® и Ликопидом, при преобладании дефектов сывороточных иммуноглобулинов и нарушений системы ИФН продемонстрированы позитивные эффекты влияний препарата Виферон® и ИРС-19. При этом следует особо подчеркнуть, что ни у одного иммунокомпрометированного ребенка во всех трех группах исследования проведение интерферонотерапии препаратом Виферон® не сопровождалось побочными эффектами, характерными для парентеральных интерферонов, ни во время проведения лечения, ни через год наблюдения в катамнезе.



