Введение
Бронхиальная астма (БА) и хроническая обструктивная болезнь легких (ХОБЛ) представляют собой широко распространенные хронические заболевания, вносящие огромный вклад в заболеваемость и, в случае ХОБЛ, в смертность населения, что в свою очередь, создает высокую нагрузку на систему здравоохранения как в развитых, так и в развивающихся странах. Оба заболевания возникают вследствие взаимодействий факторов окружающей среды и организма человека, которые приводят к широкому спектру клинических проявлений, в первую очередь – респираторных. БА и ХОБЛ – заболевания, имеющие сходные синдромальные характеристики: бронхиальную обструкцию и хроническое воспаление дыхательных путей [1, 2]. Особой когортой являются пациенты с сочетанием БА и ХОБЛ. По данным литературы, сочетание БА и ХОБЛ встречается у 11,1–61,0% из 339 млн больных астмой и у 4,2–66,0% из 252 млн больных ХОБЛ во всем мире [3, 4]. Статистические показатели значительно различаются в разных странах и в различных исследованиях. Проблема возможности сочетания БА и ХОБЛ дискутируется до настоящего времени. Возможно, в реальной клинической практике такая когорта больных встречается много чаще, чем мы видим по данным литературы [3]. Больные с сочетанием БА и ХОБЛ чаще, чем пациенты с изолированной хронической обструктивной патологией бронхов, характеризуются низкими показателями объема форсированного выдоха в первую секунду (ОФВ1), неконтролируемым течением заболевания и частым приемом короткодействующих бронхолитиков. Также пациентам с сочетанной паталогией – БА и ХОБЛ присущи частые обострения этих заболеваний, которые требуют госпитализаций в стационар и назначения системных глюкокортикостероидов и антибактериальных препаратов, а также высокая смертность [5].
Терапия пациентов с сочетанием БА и ХОБЛ
Современная цель терапии БА – достижение контроля симптомов и предотвращение обострений [1]. Одной из наиболее сложных когорт в отношении достижения контроля являются пациенты с сочетанием БА и ХОБЛ. Терапия больных ХОБЛ направлена на улучшение функции легких, снижение частоты обострений и улучшение качества жизни [2].
В терапии как ХОБЛ, так и БА применяются ингаляционные бронходилататоры длительного действия и глюкокортикостероиды. При этом в терапии ХОБЛ ключевыми лекарственными средствами являются бронходилататоры – β2-агонисты длительного действия (ДДБА) и длительно действующие антихолинергические препараты (ДДАХ), которые могут использоваться в комбинации с ингаляционными глюкокортикостероидами (ИГКС), а для пациентов с БА основой терапии является противовоспалительный компонент – ИГКС, который может комбинироваться с ДДБА или с ДДБА+ДДАХ.
Больные сочетанной патологией БА и ХОБЛ, как правило, трудно достигают контроля. Эти пациенты могут быть рефрактерными к традиционной терапии, у них отмечается высокая частота обострений заболеваний, незапланированных визитов к врачу, обращений за неотложной медицинской помощью и госпитализаций.
Современные подходы к поддерживающей терапии ХОБЛ с сочетанием БА, согласно позициям GOLD (Global Initiative for Chronic Obstructive Lung Disease) 2023 г., рекомендуют рассматривать в качестве стартовой терапии базисное лечение с использованием тройной комбинации ИГКС/ДДБА/ДДАХП [2].
При использовании фиксированных комбинаций улучшается приверженность пациентов терапии приблизительно в 2 раза, что в свою очередь приводит к повышению эффективности лечения. При выборе комбинации рекомендуется учитывать форму доставки, периферическую легочную депозицию препарата, т.е. доставку лекарственного средства к малым дыхательным путям пациента с точки зрения как эффективности, так и безопасности (в т.ч. риска развития пневмоний) [6].
Фиксированная комбинация беклометазона дипропионата/гликопиррония бромида/формотерола фумарата
В настоящее время в Российской Федерации зарегистрирован препарат Тримбоу® (беклометазона дипропио-нат ([БДП]/гликопиррония бромид [ГБ]/формотерола фумарат [ФФ]) в дозе 100/10/6 мкг, назначаемый дважды в сутки (дозированный аэрозольный ингалятор – ДАИ).
Эффективность фиксированной тройной комбинации БДП/ГБ/ФФ в форме ДАИ изучалась на больных тяжелой БА и ХОБЛ. Ключевыми исследованиями, посвященными использованию тройной комбинации при БА, были международные многоцентровые рандомизированные клинические исследования (РКИ) TRIMARAN и TRIGGER, при этом в исследовании TRIGGER применялась дозировка препарата 200/10/6 мкг, не зарегистрированная в Российской Федерации на настоящий момент [7]. Основными конечными точками, оцениваемыми в исследовании TRIMARAN, являлись изменение ОФВ1 и утренней пиковой скорости выдоха (ПСВ) через 26 недель от начала терапии, показатели контроля астмы и частота среднетяжелых и тяжелых обострений астмы за 52 недели лечения.
В исследовании TRIMARAN сравнивалась эффективность БДП/ГБ/ФФ в форме ДАИ в дозировке 100/10/6 мкг и БДП/ФФ в форме ДАИ в дозировке 100/6 мкг соответственно по 2 ингаляции 2 раза в сутки у пациентов с БА с недостижением контроля на фоне базисной терапии средними дозами ИГКС/ДДБА (n=1155).
Первичными конечными точками были изменение ОФВ1 на 26-й неделе относительно начала исследования и частота среднетяжелых и тяжелых обострений БА за 52 недели лечения. По обеим конечным точкам была достигнута достоверная разница с препаратом сравнения (см. рисунок). Прирост ОФВ1 относительно начала исследования составил 185 мл в группе тройной комбинации и 127 мл – в группе БДП/ФФ, разница между группами составила 57 мл (95% ДИ: 15–99; p=0,008). Частота среднетяжелых и тяжелых обострений БА составила 1,825 случая на пациента в год в группе БДП/ГБ/ФФ и 2,157 – в группе БДП/ФФ (95% ДИ: 0,725–0,987; p=0,033).
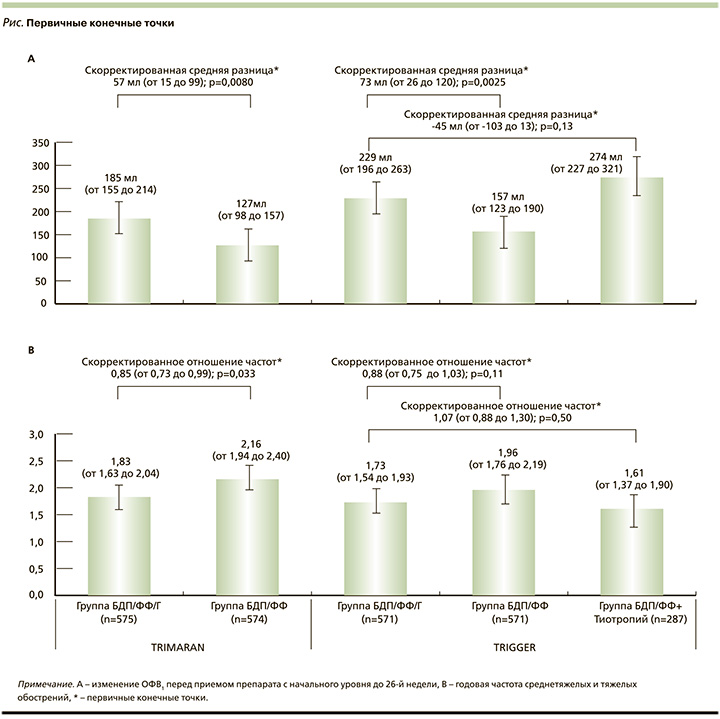
Достоверные различия получены в отношении пикового ОФВ1 в первые 3 часа после бронходилатации. Приведенное среднее различие между группами составило 84 мл в пользу тройной терапии (485 мл по сравнению с 401 мл в группах БДП/ГБ/ФФ и БДП/ФФ соответственно; p<0,001). Утренняя ПСВ в группе БДП/ГБ/ФФ на 26-й неделе терапии увеличилась на 5,3 л/мин по сравнению с началом исследования, а в группе БДП/ФФ снизилась на 3,1 л/мин (приведенное среднее различие – 8,46 л/мин; p<0,001).
Изменение контроля БА по опроснику ACQ-7, определяемое как изменение результатов опросника на менее чем на 0,5 на 52-й неделе по сравнению с началом исследования, отмечалось у 350 пациентов в группе БДП/ГБ/ФФ и 340 – в группе БДП/ФФ.
Эффективность и безопасность тройной комбинации были показаны у больных ХОБЛ тяжелого или очень тяжелого течения (n=1368) в международном многоцентровом РКИ TRILOGY [8]. Исследуемыми клиническими параметрами являлись оценка интенсивности одышки по шкале транзиторного индекса одышки, потребность в короткодействующих бронходилататорах (КДБА), качество жизни пациентов и частота обострений. Сравнивался ДАИ БДП/ГБ/ФФ (100/10/6 мкг) в назначаемой дозировке по 2 ингаляции 2 раза в сутки с БДП/ФФ в дозе 100/6 мкг, а также в форме ДАИ по 2 ингаляции 2 раза в сутки.
Более чем у 50% больных обеих групп отмечалось значимое уменьшение одышки (≥1 балла по шкале транзиторного индекса одышки), при этом на 26-й неделе лечения выявлена достоверно более высокая доля таких пациентов в группе принимавших БДП/ГБ/ФФ: 57 и 52% (ОШ=1,28, 95% ДИ: 1,03–1,59; р=0,027).
На 26-й неделе у пациентов, принимавших БДП/ГБ/ФФ, по сравнению с получавшими терапию БДП/ФФ выявлена достоверно меньшая потребность в КДБА и бóльшая процентная доля дней, свободных от использования препаратов неотложной помощи. В дальнейшем статистически незначимая тенденция сохранялась.
На фоне терапии БДП/ГБ/ФФ выявлено достоверное снижение частоты среднетяжелых и тяжелых обострений ХОБЛ на 23% (р=0,005) и увеличение времени до первого обострения (р=0,020) по сравнению с группой БДП/ФФ. При этом более выраженное снижение частоты обострений (на 33%) наблюдалось у больных, перенесших ≥2 обострений ХОБЛ в течение предыдущего года [9]. К концу курса терапии у лиц, получавших комбинацию БДП/ГБ/ФФ, зарегистрировано достоверное улучшение качества жизни по сравнению с таковым в группе контроля (среднее различие составило -1,69 балла, 95% ДИ: -3,2–-0,17; р=0,029).
По данным исследования TRILOGY показано, что комбинация БДП/ГБ/ФФ превосходит таковую БДП/ФФ по влиянию на базальный уровень ОФВ1 в среднем на 0,81 л (95% ДИ: 0,052–0,109; р<0,001) и ОФВ1, измеренный через 2 часа после ингаляции, – на 0,117 л (95% ДИ: 0,086–0,147; р<0,001) [8].
В международном РКИ IIIb-фазы TRIBUTE проведена сравнительная оценка эффективности и безопасности БДП/ГБ/ФФ и комбинации индакатерол (ИНД)/ГБ у 1532 больных ХОБЛ тяжелого и очень тяжелого течения, перенесших по крайней мере 1 среднетяжелое или тяжелое обострение в течение предыдущего года, несмотря на проводимую терапию двойными комбинациями ИГКС/ДДБА, ИГКС/ДДАХ или ДДБА/ДДАХ или монотерапию ДДАХ [10].
Исследование показало, что риск развития обострений на фоне терапии БДП/ГБ/ФФ при сравнении с терапией ИНД/ГБ составила 0,848 (95% ДИ: 0,723–0,995; р=0,043). Кроме того, выявлено, что тройная комбинация БДП/ГБ/ФФ имела преимущество в лечении больных ХОБЛ с бронхитическим фенотипом: у них частота обострений снизилась на 25% по сравнению с контрольной группой.
При лечении ингаляционными препаратами имеет значение возникновение местных побочных эффектов и абсорбция препарата в системный кровоток. Использование экстрамелкодисперсного аэрозоля в виде тройной комбинации БДП/ГБ/ФФ является залогом улучшения легочной депозиции на фоне снижения орофарингеальной депозиции [11]. Тройная комбинация БДП/ГБ/ФФ в виде ДАИ обеспечивает стабильную легочную депозицию >30% вне зависимости от скорости вдоха, а при помощи «медленного» облачка аэрозоля уменьшается риск ошибок, связанных с координацией нажатия и вдоха при использовании аэрозольных ингаляторов [12].
Анализ РКИ, в которых изучалось воздействие комбинации БДП/ГБ/ФФ, проведенного D. Singh et al. [13], выявил, что частота развития побочных эффектов при использовании данной комбинации не отличалась от таковой в группах сравнения с применением других лекарственных препаратов – 50,8–61,4% – для БДП/ГБ/ФФ, 50,9% – БУД/ФФ, 55,8% – для тиотропия бромида (ТБ), 57,0% – для БДП/ФФ в сочетании с ТБ и 68,5% – для ИНД/ГБ [13].
Также выявлена низкая частота развития пневмонии при использовании фиксированной комбинации БДП/ГБ/ФФ, сравнимая с терапией, не содержащей ИГКС [13].
Обсуждение
Результаты TRIMARAN и TRIGGER показали, что тройная комбинация БДП/ГБ/ФФ эффективна, способствует улучшению функций легких, снижению частоты среднетяжелых и тяжелых обострений в популяции взрослых пациентов с БА, которая не контролируется при применении средней дозы ИГКС/ДДБА [7, 14]. Выявлено улучшение контроля астмы на фоне тройной терапии БДП/ГБ/ФФ.
В исследованиях TRILOGY и TRIBUTE показано, что при использовании комбинации БДП/ГБ/ФФ в одном ингаляторе достоверно снижается частота обострений, улучшаются показатели функций легких и качество жизни больных ХОБЛ.
Таким образом, тройная фиксированная комбинация БДП/ГБ/ФФ открывает новые возможности терапии как для пациентов с ХОБЛ с высоким риском развития обострений, так и пациентов с неконтролируемой БА на фоне приема средних доз ИГКС.
Заключение
Фиксированная комбинация БДП/ГБ/ФФ, выпускаемая в форме ДАИ (Тримбоу®) в дозировке 100/10/6 мкг, отвечает современным требованиям к клинической эффективности и профилю безопасности препаратов для лечения БА и ХОБЛ.
Назначение тройной фиксированной комбинации БДП/ГБ/ФФ в форме ДАИ позволит повысить приверженность терапии по сравнению со свободными тройными комбинациями и может быть рекомендовано как для пациентов с ХОБЛ, так и с БА.



