Вступление
Начиная с 1990-х гг. и до настоящего времени развивается интерес к проблеме взаимовлияния двух многофакторных хронических состояний: ожирения и бронхиальной астмы (БА). Более 20 млн детей в возрасте до 5 лет во всем мире имеют избыточную массу тела. Скорость распространенности ожирения среди детей превышает таковую среди взрослых, одновременно растет число детей с БА в возрасте младше 5 лет [1]. Ожирение увеличивает риск развития БА у взрослых и детей и сопряжено с вполне определенным фенотипом, но лечение таких пациентов остается сложной задачей, особенно в педиатрии [2]. В последней версии отечественной национальной программы «Бронхиальная астма у детей. Стратегия лечения и профилактика» (2012) более подробно, чем в предыдущих версиях, отражена связь между ожирением и увеличением риска развития БА среди детей, приведены клинико-эпидемиологические характеристики этого сочетания [3].
Целью данного обзора является анализ современного состояния проблемы БА у детей с ожирением, попытка структурировать неоспоримые утверждения и определить области, требующие дальнейшего изучения. Особенно важно сформулировать практические шаги на пути к достижению контроля БА у детей данной категории, основываясь на текущем уровне знаний.
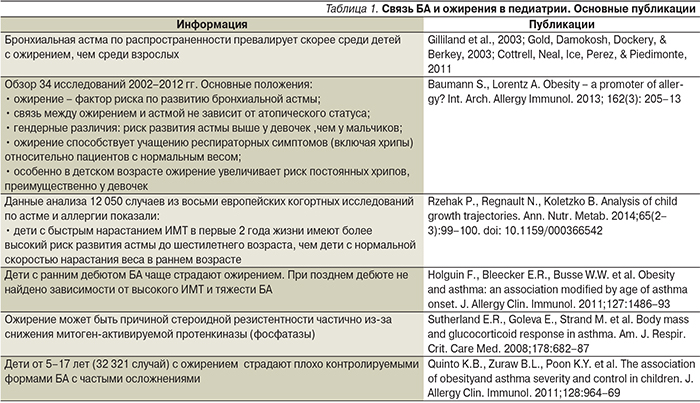
Мы обсудим, как ожирение влияет на функциональные характеристики органов дыхания, выраженность симптомов БА и наилучшие пути контроля БА при данном сочетании. К сожалению, педиатрических публикаций значительно меньше, чем о взрослом контингенте пациентов. Для краткости изложения в табл. 1 приведены данные по ряду наиболее значимых последних исследований по данной теме.
Данные наиболее достоверных источников по связи БА и ожирения у детей с основными отличиями от взрослого контингента больных Ведение ребенка с ожирением и БА требует вдумчивого и индивидуального подхода. По данным GINA (Global Initiative for Asthma), только 5% пациентов с БА достигают оптимального уровня контроля [4]. Высокий риск возникновения БА у детей с избыточной массой тела объясняется теми же теориями, что и у взрослых [5–7]. Они предусматривают аномальное латентное воспаление, окислительный стресс, наличие сопутствующих заболеваний, снижение объема и экскурсии грудной клетки, сужение просвета бронхов, генетическую предрасположенность.
В эксперименте на мышах с ожирением показано наличие у них гиперреактивности бронхов, усиление воспаления в ответ на внешние проастматические раздражители [8]. Эти феномены не представляется возможным доказать в детском возрасте из-за ограничений в обследовании. Несмотря на гетерогенность детской астмы, набор внешних факторов, формирующих фенотип, известен. Безусловно, они влияют на течение БА у детей с ожирением. На рис. 1 схематично отражены взаимосвязи ожирения и БА у детей.

Ожирение и астма связаны с персистирующим воспалением жировой ткани, которое запускает гиперреактивность бронхов и под влиянием внешних раздражителей приводит к появлению симптомов астмы.
О правильности этой гипотезы говорят следующие факты:
- хроническое воспаление и оксидантный стресс являются отличительными чертами как ожирения, так и астмы;
- в воспалении при БА и ожирении задействованы одни и те же медиаторы, например фактор некроза опухоли α (ФНО-α) [9, 10] и лейкотриены [11–13];
- выделяемые жировой тканью адипокины имеют полиорганное влияние, в т.ч. на легкие [5, 9[;
- молекулы адипонектина, интерлейкина-6, ФНО-α, лептина влияют на воспаление и могут изменить реактивность бронхолегочной системы [8, 9, 14–16].
Как было показано в исследовательской программе CAMP (Childhood Asthma Management Program), вышеописанные метаболические эффекты способствуют воспалению дыхательных путей и препятствуют достижению контроля БА в детском возрасте [17].
По показателям NO в выдыхаемом воздухе доказано, что ожирение не является фактором риска БА и аллергической сенсибилизации, а повышает вероятность воспаления дыхательных путей [18].
Обнаружена связь между нарушением липидного баланса, метаболизма глюкозы и астмы независимо от степени ожирения [19].
Из эндогенных процессов у детей наиболее полно изучен оксидантный стресс при тяжелой БА. Он проявляется увеличением недоокисленных продуктов, что усугубляет бронхоспазм и увеличивает продукцию слизи в просвете бронхов. Увеличение уровня малонового деальдегида и снижение уровня глутатиона в выдыхаемом воздухе и плазме свидетельствуют о повреждении липидного компонента клеточных мембран и крайне тяжелом течении БА у детей [20–22].
Другая гипотеза предполагает, что сопутствующие заболевания, связанные с ожирением, могут повышать риск возникновения астмы.
Ожирение увеличивает риск нарушений дыхания, включая синдром обструктивного апноэ во сне. Есть основания предполагать, что эпизоды гипоксемии во время ночных апноэ могут способствовать формированию БА, служить предрасполагающими факторами к астме [23–25]. Это доказано в отношении взрослых пациентов, но в педиатрии требуются дополнительные исследования. Бауманн и Лорец в своем обзоре по БА указывают на ряд особенностей фенотипа «астма+ожирение» в детском возрасте. По их данным, ожирение в детском возрасте связано с риском развития БА больше у девочек, причем преобладают неспецифические симптомы: апноэ, ночные просыпания [26]. Гастроэзофагеальный рефлюкс (ГЭР) чаще встречается среди тучных детей и взрослых и считается причиной появления приступов кашля и хрипов в легких. Пока недостаточно данных для того, чтобы утверждать, будто ГЭР может быть изолированной причиной БА у детей. ГЭР при БА и ожирении может стать препятствием для достижения контроля БА. При ГЭР образуется порочный круг взаимосвязанных синдромов, что отражено на рис. 2.
Jason и соавт. не рекомендуют лечить «тихий ГЭР», но при появлении симптомов показано применение противорефлюксных средств [27].
Риниты и риносинуситы как коморбидные состояния характерны как для БА, так и для ожирения. Аллергические риниты (АР) имеют 15% детей с БА [28]. Доля таких пациентов значительно выше, т.к. риск БА одинаков при аллергическом и неаллергическом ринитах [29]. Наличие нелеченых ринитов тесно связано с неконтролируемым течением детской астмы. АР и БА считаются патогенетически единым целым. Доказана эффективность и безопасность применения монтелукаста при лечении ринита и БА у детей начиная с двух лет [30]. Связи ожирения с АР, конъюнктивитами и сенсибилизацией к пищевым аллергенам не выявлено. Нет точных данных по распространенности ринитов у детей с ожирением, как нет их и в группе с БА на фоне ожирения [26].
Механическое воздействие гипертрофии жировой ткани на воздухоносные пути было первым научным объяснением влияния ожирения на провокацию симптомов БА. На лабораторных животных было показано, что в результате сдавления грудной стенки отмечается снижение жизненной емкости легких, дыхательного объема, уменьшение калибра дыхательных путей с последующей бронходилатацией [30, 40]. При ожирении создаются условия для формирования гиперреактивности бронхов [31, 41]. Эти процессы доказаны у взрослых пациентов с БА на фоне ожирения. У детей их влияние может варьироваться в связи с возрастной эластичностью грудной клетки, гладкой мускулатуры бронхов вплоть до отсутствия какой-либо значимости для провокации симптомов БА [32, 33].
В большинстве исследований детей с БА на фоне ожирения учитываются периоды детства с определенными особенностями обоих хронических состояний, однако недостаточно внимания уделяется анатомо-физиологическим особенностям органов и систем в разных возрастных группах, включая особенности ожирения, возрастную склонность к гиперреактивности бронхов, богатое кровоснабжение и высокую гидрофильность тканей. Например, есть принципиальное отличие гиперплазии жировой ткани у детей и взрослых при ожирении. Адипоциты способны к делению, и увеличение объема жировой ткани дополняется увеличением их числа у здоровых детей до 3 лет, при ожирении – до 12 лет. Предполагается, что это одна из причин наличия тяжелых неконтролируемых, резистентных к терапии форм БА у людей, страдающих ожирением с детства. Жировые отложения могут депонироваться в подкожной клетчатке, вокруг внутренних органов, образовывая эктопические очаги [34].
Индекс массы тела, или Кетле-2 (ИМТ), – основной диагностический критерий определения избыточной массы тела или ожирения – также зависит от возраста и пола ребенка. До 11 лет при массовых обследованиях детей для выделения групп с пограничными значениями ИМТ и возможными патологическими отклонениями признаков применяются таблицы центильного типа по шкале Стюарт, предусмотренные границы – 3, 10, 25, 50, 75, 90 центилей распределения, в США чаще применяют частотные точки 5 и 95 центилей. При описании признаков, свойственных резко выраженной патологии (ожирение, БА), более информативен метод сигмальных отклонений. Всемирная организация здравоохранения рекомендует применение показателя «Z-score», удобного при наличии малого числа наблюдений (Z-score=показатель ребенка – стандарт, деленный на сигму стандарта) [34]. А.П. Аверьянов в докторской диссертации для диагностики избыточной массы тела рекомендует применять критерий нормированной по росту окружности талии для верификации абдоминального ожирения, тесно связанного с развитием метаболического синдрома у детей школьного возраста, при значениях более 0,5 – до начала пубертата и более 0,49 – в пубертате независимо от пола. Отношение «талия/рост» рассчитывают путем деления окружности талии на рост. Жир верхней части живота при андроидном висцеральном ожирении метаболически более активен, провоцирует выработку различных гормонов, дислипидемию, способных вызывать тяжелые коморбидные состояния: диабет, артериальную гипертензию и БА [35]. Вышеописанные методические особенности диагностики избыточной массы тела в педиатрии частично объясняют противоречивые данные о влиянии снижения ИМТ на контроль БА у детей, тогда как у взрослых пациентов потеря массы тела (снижение ИМТ) – одна из главных составляющих комплексной терапии. Большинство педиатрических исследований основываются на небольшом количестве наблюдений, выбор диагностического критерия для оценки эффекта снижения ИМТ не всегда объективно отражает состояние контроля БА. В обзоре 34 исследований с 2002 по 2012 г. Бауман и соавт. (2013) выявили, что высокий ИМТ усиливает выраженность респираторных симптомов у детей по сравнению с детьми, больными БА, с нормальными значениями ИМТ [26].
Классические триггерные внешние факторы: диета, физические нагрузки, психологические проблемы приобретают другое многогранное звучание и значимость в случае БА на фоне ожирения у детей.
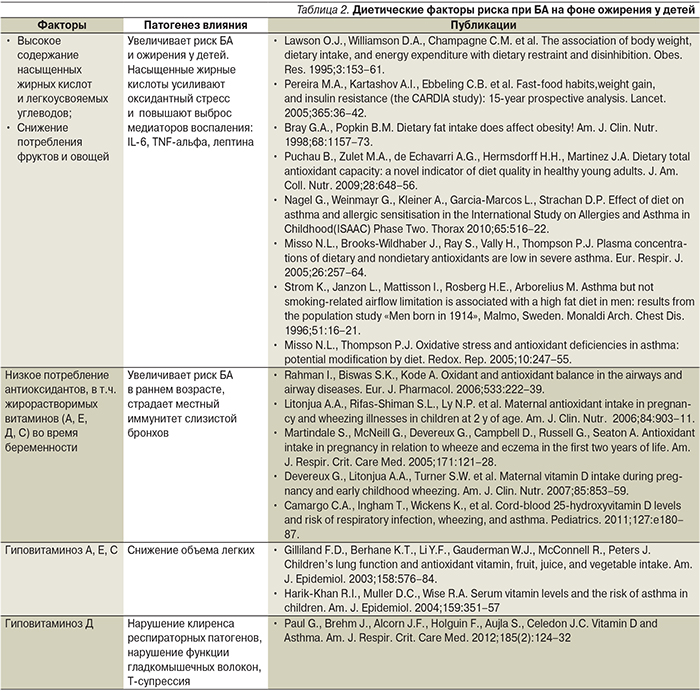
Понятие сбалансированного питания меняется в зависимости от возраста ребенка. Сложившееся в процессе эволюции оптимальное для человека соотношение омега-6/омега-3 жирных кислот составляет 2:1 [36]. Современная диета большинства населения планеты содержит в 25 раз больше омега-6 жирных кислот. Доказано, что диета, богатая антиоксидантами, омега-3 жирными кислотами, снижает вероятность появления рецидивирующих хрипов у детей раннего возраста [37]. Диета с преобладанием n-6-полиненасыщенных жирных кислот (ПНЖК) увеличивает продукцию медиаторов воспаления из 5-липоксигеназного каскада (пути), усугубляя выброс свободных радикалов и оксидантный стресс [38, 39], тогда как нормализация баланса n-3/n-6 омега ПНЖК ведет к улучшению показателей контроля БА [40]. Перестройка соотношения ПНЖК с преобладанием насыщенных жирных кислот в фосфолипидных слоях мембран лейкоцитов повышает выделение продуктов 5-липогеназного пути: лейкотриенов, ФНО-α, других молекул, играющих важную роль в патогенезе БА и тактике терапии [41, 42]. Дисбаланс в витаминном и антиоксидантном обменах способствует формированию гиперреактивности бронхов и БА. В табл. 2 перечислены главные дефекты диеты, усиливающие риск БА в детском возрасте.
Данные из основных источников по влиянию диетических компонентов на формирование БА и ожирения, дополнительно – иллюстрация патогенетического единства и терапевтических подходов.
Большая масса тела при рождении является фактором риска диабета у матери, который напрямую связан с ожирением в раннем возрасте и последующие периоды жизни ребенка [43].
Продолжительность грудного вскармливания является важным условием профилактики ожирения у детей. Дети, получавшие искусственное вскармливание первые 6 месяцев жизни, в 2,5 раза чаще страдают ожирением, чем дети, получавшие материнское молоко. Считается, что естественное вскармливание снижает риск аллергических реакций в раннем возрасте [44].
Хотя есть данные, согласно которым ожирение служит фактором риска атопии среди девочек-подростков [45, 46]. Два больших исследования, ISAAC и NHAMES III фазы, не показали связи ожирения и БА [47, 48]. Связанное с ожирением воспаление может рассматриваться как отдельный фенотип в отличие от классического детского атопического варианта.
Гиподинамия и генетическая предрасположенность увеличивают риск и ожирения, и астмы. Дети с избыточной массой тела имеют меньшие, чем дети с нормальной и сниженной массой тела, двигательные нагрузки. Есть публикации, в которых предполагается, что физическая нагрузка может играть роль в снижении риска астмы [49] и подавлении симптомов БА [50–52], однако есть исследования, где это предположение не подтверждается [37, 52]. Противоречивые результаты, по-видимому, связаны с затруднениями контроля интенсивности физической активности и воздействием других факторов, связанных с ожирением, которые повышают заболеваемость БА [53]. Склонность к гиподинамии, психологические проблемы, связанные с понижением качества жизни, и физическая нагрузка как провокатор бронхоспазма требуют совместных усилий аллергологов, психологов, врачей по лечебной физкультуре в ведении таких пациентов. При сочетании ожирения и астмы важен анализ патофизиологии дыхания во время физических нагрузок. Необходимо разработать схемы дозированных комплексов упражнений с учетом возраста, степени и типа ожирения, маркеров контроля БА. Во время физической нагрузки возникают гипервентиляция, расслабление гладкой мускулатуры и бронходилатация, преобладают симпатические влияния. Однако бронходилатирующее действие непродолжительно – 1–5 минут, и вскоре охлаждение слизистой оболочки бронхов приводит к гиперосмолярности бронхиального секрета, механическому раздражению бронхов, повышению тонуса блуждающего нерва, дегрануляции тучных клеток, гранулоцитов с выделением медиаторов (гистамина, лейкотриенов, хемотаксических факторов и т.д.), вызывающих спазм и воспаление бронхов [54]. Приблизительно через 15–20 минут происходит инактивация медиаторов. При высвобождении медиаторов тучные клетки резко снижают свою способность к дальнейшему их выделению, наступает рефрактерность тучных клеток. Полупериод восстановления тучных клеток к синтезу половинного количества медиаторов в них составляет около 45 минут, а полное исчезновение рефрактерности наступает через 3–4 часа [55, 56].
Исследования in vitro предполагают, что связанная с упражнениями компрессия эпителия может улучшать бронхиальный клиренс и калибр [57].
Поскольку и БА, и ожирение являются многофакторными заболеваниями, было сделано предположение об общей генетической предрасположенности этих нозологий [6, 58]. Определены геномные локусы, которые содержат гены, связанные и с ожирением, и с БА [6, 7, 58, 61], но только пять из них имеют полиморфизм, ассоциированный как с ожирением, так и с БА [60, 61], в т.ч. ген β2-адренергических рецепторов, лимфотоксина-б, гена рецепторов витамина D. Необходима дополнительная оценка этих локусов в популяции без ожирения и астмы для уточнения их взаимовлияний в случае их сочетания.
Клинический интерес представляет найденный в двух исследованиях полиморфизм гена ALOX5 среди взрослых пациентов с БА. ALOX5-ген контролирует 5-липоксигеназу, которая запускает процессы окисления арахидоновой кислоты на мембране клеток, инициирует синтез лимфотоксина-б4.Согласно данным E. Jason и Lang, частота полиморфизма ALOX5 составляет 57% среди пациентов с ожирением при 40% в группе с нормальным ИМТ [27]. Предполагается, что пациенты без БА имеют больший риск ее развития из-за мутаций ALOX5 и угрозы дисрегуляции лейкотриенового пути по сравнению с диким генотипом [62–64]. Возможно, что превалирование ALOX5-варианта при ожирении на фоне высокого ИМТ приводит к завышенному уровню лейкотриенов, делая этот контингент целевой группой для применения антилейкотриеновых препаратов.
Обсуждение
В настоящее время определены отдельные черты фенотипа с элементами эндотипирования «БА+ожирение» у детей. Его определяют характер воспаления, тип ожирения, возрастные и гендерные особенности. Сравнительно с классическим детским аллергическим фенотипом (АФ) тяжесть симптомов БА не отличается либо несколько превышает таковую. Объективность затруднена из-за выраженного снижения качества жизни. В отличие от АФ время дебюта БА варьируется, реже встречается атопия, не исключается наличие нейтрофильного варианта со сниженным уровнем NO в выдыхаемом воздухе, снижение ответа на бронходилататоры и реакции на бронхопровокацию. При «БА+ожирение» отмечается разной степени выраженности снижение отношения объем форсированного выдоха за одну секунду (ОФВ1)/форсированная жизненная емкость легких на выдохе (ФЖЕЛ) при нормальной ФЖЕЛ, при классическом АФ – эпизоды обструкции и различные варианты ремоделирования дыхательных путей. Процессы ремоделирования при «БА+ожирение» практически не изучались. Коморбидный статус при описываемом сочетании отличается более выраженной депрессией и тревогой, гиперинсулинемией, высоким содержанием триглицеридов, липопротеидов низкой плотности. Маркеры атопии (АР, экзема, синуситы) встречаются реже. Несмотря на выброс воспалительных маркеров при ожирении, это не единственный фактор, определяющий интенсивность воспаления дыхательных путей в детстве. Исследования взрослых показали положительное воздействие на контроль БА при снижении ИМТ [65, 66]. Наиболее достоверные данные включали уменьшение одышки, устойчивость к физической нагрузке, уменьшение выраженности симптомов БА и улучшение показателей функции внешнего дыхания. В отличие от взрослых снижение ИМТ в педиатрической практике изолированно влияет на снижение обструктивного синдрома, а не контроль БА в целом. У детей при снижении ИМТ трудно отличить улучшение астма-специфических симптомов от положительной динамики со стороны сердечно-сосудистой системы и улучшения общего самочувствия. Улучшение симптомов БА у детей при снижении массы тела остается малоизученным и служит первостепенной задачей на данном этапе. Так же как влияние коррекции диеты, контроль объема физических нагрузок требует дальнейших изысканий. В настоящее время не имеет смысла вносить какие-то изменения в основные протокольные документы GINA, но определенные особенности медикаментозной терапии необходимо учитывать.
При ведении детей с БА на фоне ожирения необходимо учитывать следующие особенности:
- объем гормонально-метаболических нарушений, связанных с ожирением, оказывает влияние на фармакокинетику лекарственных препаратов, снижает ответ на ингаляционные глюкокортикостероиды – ИГКС [67–69] – и низкие дозы теофиллина [70];
- есть данные об улучшении контроля БА у детей с ожирением в ответ на терапию монтелукастом при высоком уровне ИМТ [69];
- триггерным фактором является метаболический синдром при ожирении центрального происхождения, при котором окислительный стресс достигает своего апогея. Необходимо учитывать наличие симптомов acanthosis nigricans, стрий, периодические курсы перорального приема глюкокортикоидов.
Таким образом, наиболее эффективный план ведения детей с БА на фоне ожирения включает применение ИГКС, мероприятия по снижению массы тела (сбалансированная диета, ежедневные дозированные физические упражнения с включением дыхательной гимнастики, обучающие мероприятия по технике пользования ингаляторов, небулайзеров с информацией о неблагоприятном воздействии окружающей среды). Будущее за созданием «консилиумных» групп по контролю БА данного фенотипа, состоящих помимо аллерголога и педиатра из психолога, эндокринолога и специалиста по лечебной физкультуре. Гетерогенность ответов на лекарственную терапию имеют дети с БА на фоне ожирения и без него. Это означает, что определенная часть детей будут реагировать на ИГКС-LABA, часть – на ИГКС+монтелукаст, а оставшиеся – на повышенные дозы ИГКС. Тем не менее из-за плоской кривой дозозависимости у детей с БА на фоне ожирения первым шагом и терапией выбора служит сочетание ИГКС и монтелукаста.
В пользу этого утверждения говорит выраженная альтерация цитоплазматических мембран, повышение активности лейкотриенового пути на фоне:
- оксидантного стресса;
- генетической предрасположенности;
- дисбаланса диеты;
- превышения порога физических нагрузок.
Заключение
Ожирение существенно увеличивает риск БА у детей, хотя не все механизмы этой ассоциации изучены. Ожирение многофакторно влияет на различные характеристики БА. Терапия ребенка с БА на фоне ожирения требует комплексного, индивидуального подхода.



