Современные проблемы антиаритмической терапии
Аритмии играют важную роль в развитии сердечно-сосудистых осложнений, таких как внезапная сердечная смерть (ВСС), инсульт, декомпенсация хронической сердечной недостаточности (СН) [1]. Лечение эффективными антиаритмическими препаратами (ААП) теоретически должно снижать риск ВСС и, соответственно, смерти от любых причин, однако эту гипотезу не подтвердили результаты рандомизированных клинических исследований.
В зависимости от механизма действия современные ААП подразделяются на четыре класса, и все они обладают теми или иными недостатками. Во-первых, ААП характеризуются ограниченной эффективностью, обычно составляющей 50–70 %, причем со временем результаты антиаритмической терапии (ААТ) обычно ухудшаются. При лечении других состояний, например артериальной гипертензии или дислипидемии, эту проблему решают путем увеличения доз лекарственных средств или назначения комбинированной терапии, но при аритмиях такие подходы не безопасны для больного. Во-вторых, подавляющее большинство ААП оказывает аритмогенное действие и может вызывать угрожающие жизни аритмии, в первую очередь полиморфную желудочковую тахикардию по типу пируэт. Риск аритмогенного эффекта увеличивается у пациентов с тяжелой кардиальной патологией, ААТ как раз и показана. Поэтому многие ААП не рекомендуют назначать больным СН. В-третьих, ААП могут вызывать серьезные экстракардиальные побочные реакции. В частности, лечение амиодароном, обладающим высокой антиаритмической эффективностью и низкой аритмогенной активностью, иногда осложняется поражением щитовидной железы, глаз, легких и другими серьезными нежелательными явлениями. И наконец большинство контролируемых клинических исследований не подтвердили эффективность ААП в профилактике не только смерти от любых причин, но и ВСС. А в исследовании CAST применение ААП I класса даже увеличило смертность больных, перенесших инфаркт миокарда (ИМ), несмотря антиаритмический эффект [2].
В настоящее время ведущая роль в лечении жизнеугрожающих аритмий и профилактике внезапной сердечной смерти отводится имплантируемым кардиовертерам-дефибрилляторам (ИКД). В руководстве Американской коллегии кардиологов/Американской ассоциации сердца [3] их рекомендовано имплантировать, по сути дела, всем пациентам с высоким риском ВСС. Эти рекомендации отражают более высокую эффективность ИКД по сравнению с ААП во вторичной профилактике ВСС, показанную в нескольких крупных клинических исследованиях (AVID, CASH, CIDS) [4]. К сожалению, в России ИКД пока не нашли широкого применения из-за высокой стоимости. Остается неясной и оптимальная тактика ведения пациентов с менее серьезными нарушениями ритма (например, частой желудочковой экстрасистолией), у которых отсутствуют показания к установке ИКД. В рекомендациях европейских и американских экспертов (2006) для длительного лечения желудочковых аритмий предлагается применять только β-адреноблокаторы, амиодарон и соталол, а другие АПП даже не упоминаются [1].
С учетом всех перечисленных обстоятельств большой интерес представляет изучение возможностей применения при аритмиях ω-3 полиненасыщенных жирных кислот (ПНЖК), которые в крупных исследованиях улучшали прогноз у пациентов с ИМ и СН [5]
Фармакологические эффекты ω-3 ПНЖК
Насыщенные ЖК образуются в организме человека, а ненасыщенные (незаменимые) жирные кислоты в основном поступают с пищей. Выделяют три группы ненасыщенных ЖК в зависимости от номера атома углерода, участвующего в образовании последней двойной связи. К основным ω-3 ПНЖК относят эйкозопентаеновую (ЭПК) и докозагексаеновую (ДГК) кислоты. В экспериментальных и клинических исследованиях показано, что ω-3 ПНЖК обладают антиаритмическими свойствами, в частности, они блокировали вольтаж-зависимые натриевые каналы [6], кальциевые каналы L-типа [7] и калиевые каналы [8, 9]. В опытах на культуре кардимиоцитов крыс ЭПК и ДГК подавляли тахиаритмии, вызванные различными аритмогенными агентами [10]. Сходные результаты были получены в опытах на собаках, крысах и обезьянах [11]. Например, 16-недельное применение ω-3 ПНЖК у обезьян привело к значительному увеличению пороговой частоты электростимуляции, вызывавшей фибрилляцию желудочков как в отсутствие, так и при наличии ишемии миокарда [12]. В опытах на собаках внутривенное введение ЭПК и ДГК предупреждало развитие фибрилляции желудочков при экспериментальной ишемии миокарда [13]. Увеличение порога развития фибрилляции желудочков отмечено в 16-недельном исследовании на крысах, получавших ω-3 ПНЖК с пищей, тогда как применение насыщенных жиров давало обратный эффект [14].
Омега-3 ПНЖК оказывают благоприятное влияние на функцию вегетативной нервной системы, нарушение баланса которой способствует развитию аритмий и неблагоприятных сердечно-сосудистых исходов [15]. В двойном слепом рандомизированном исследовании применение ω-3 ПНЖК (5,2 г/сут) у пациентов с ИМ и низкой фракцией выброса привело к значительному улучшению вариабельности сердечного ритма, отразившему увеличение тонуса вегетативной нервной системы [16]. В другом исследовании применение ДГК (585 мг) и ЭПК (225 мг) в течение 4 месяцев сопровождалось достоверным снижением частоты сердечных сокращений, улучшением восстановления частоты сердечных сокращений в течение минуты после нагрузки и отдельных показателей вариабельности сердечного ритма [17]. В крупном популяционном исследовании, включившем более 5 тыс. мужчин и женщин, выявлена ассоциация между потреблением рыбы и снижением частоты сердечных сокращений, замедлением атриовентрикулярной проводимости и снижением вероятности удлинения интервала QT [18].
Омега-3 ПНЖК оказывают и другие положительные эффекты на сердечнососудистую систему: улучшают эндотелиальную функцию, снижают агрегацию тромбоцитов, концентрацию триглицеридов в крови, оказывают противовоспалительное действие, влияют на синтез эйкозаноидов, повышают стабильность атеросклеротической бляшки [19].
Клинические исследования ω-3 ПнЖК при аритмиях
Антиаритмическая эффективность ω-3 ПНЖК изучалась у пациентов с желудочковыми аритмиями и фибрилляцией предсердий, а также c ИКД. В двойном слепом рандомизированном исследовании 6-месячная терапия ω-3 ПНЖК в дозе 1 г/сут у 65 пациентов с нарушениями ритма без признаков ИБС или СН привела к снижению частоты и градации предсердных и желудочковых экстрасистол по сравнению с плацебо (оливковое масло) [20]. В другом исследовании у 39 пациентов частота желудочковых экстрасистол после 16-недельной терапии препаратом ω-3 ПНЖК (0,9 г ЭПК и 1,54 г ДГК) снизилась на 48 %, а в группе плацебо (подсолнечное масло) – на 25 %. Доля пациентов, ответивших на лечение (снижение числа экстрасистол по крайней мере на 70 %), составила 38 и 13 % соответственно (p < 0,01) [21]. У 40 пациентов с пароксизмальными предсердными тахиаритмиями лечение ω-3 ПНЖК в дозе 1 г/сут в течение 4 месяцев снижало число эпизодов аритмии на 59 % (р = 0,037), причем после прекращения терапии оно увеличилось до исходного [22]. В то же время в рандомизированном исследовании у 92 пациентов 14-недельная терапия ω-3 ПНЖК (700 мг ЭПК и 560 мг ДГК) не оказывала влияния на частоту желудочковых экстрасистол по сравнению с плацебо [23].
Е.М. Нифонтов и соавт. [24] применяли рецептурный препарат ω-3 ПНЖК (Омакор) в дозе 1 г/сут у 43 больных стабильной ИБС с нормальной фракцией выброса левого желудочка и частыми желудочковыми аритмиями. Более 60 % пациентов получали также β-адреноблокаторы или амиодарон. По данным суточного мониторирования ЭКГ, через месяц число одиночных желудочковых экстрасистол уменьшилось на 20,1 % (p = 0,01), парных – на 47,0 % (p = 0,0018), пароксизмов желудочковой тахикардии – на 49,0 % (p = 0,0029), а у 42 % пациентов пароксизмы полностью прекратились. У 23 пациентов, продолживших лечение в течение еще одного месяца, отмечено усиление антиаритмического эффекта, а у 20 больных, прекративших лечение, он, наоборот, уменьшился.
В трех плацебо-контролируемых исследованиях изучалась эффективность ω-3 ПНЖК в профилактике угрожающих жизни аритмий у пациентов с ИКД. Результаты этих исследований противоречивы. В работе М. Raitt и соавт. [25] время до первого срабатывания ИКД при лечении ω-3 ПНЖК снизилось по сравнению с плацебо, а в подгруппе пациентов с желудочковой тахикардией частота возникновения этой аритмии достоверно увеличилась. В исследовании А. Leaf и соавт. [26] у 402 пациентов, наоборот, была выявлена тенденция к увеличению времени до срабатывания ИКД или смерти (снижение риска на 28 %; р = 0,057). Некоторые преимущества (хотя и недостоверные) ω-3 ПНЖК перед плацебо были отмечены и в исследовании SOFA у 546 пациентов [27].
В нескольких исследованиях показана эффективность ω-3 ПНЖК в профилактике фибрилляции предсердий. Например, в исследовании L. Calo и соавт. [28] применение ω-3 ПНЖК в течение 5 дней перед аортокоронарным шунтированием у 160 пациентов привело к снижению частоты развития послеоперационной фибрилляции предсердий в 2 раза по сравнению с плацебо (с 33,3 до 15,2 %; р = 0,013). Сходные результаты получили А.В. Панов и соавт. [29]: риск развития послеоперационной фибрилляции предсердий снизился на 52 %. Достоверное снижение риска развития ранней фибрилляции предсердий после операций на сердце при применении ω-3 ПНЖК (с 47,3 до 31,0 %; р = 0,006) выявили также G. Mariscalco и соавт. [30] в крупном исследовании 530 пациентов.
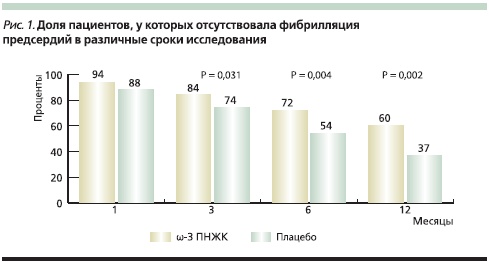
В то же время результаты некоторых исследований оказались отрицательными [31, 32]. S. Nodari и соавт. [33] в рандомизированном плацебоконтролируемом исследовании изучали эффективность ω-3 ПНЖК в профилактике рецидивов фибрилляции предсердий в течение года после электрической кардиоверсии у 158 пациентов, получавших также амиодарон и ингибиторы ренин-ангиотензиновой системы. Лечение ω-3 ПНЖК привело к значительному снижению частоты рецидивов фибрилляции предсердий. Разница между группами была статистически значимой уже через 3 месяца после начала лечения и достигла максимума через год (рис. 1). И.В. Антонченко и соавт. [34] также отметили улучшение результатов антиаритмической терапии пропафеноном при применении ω-3 ПНЖК у пациентов с пароксизмальной формой фибрилляции предсердий.
В настоящее время проводятся два крупных рандомизированных двойных слепых плацебо-контролируемых исследования, в которых изучается эффективность ω-3 ПНЖК в профилактике и лечении фибрилляции предсердий. В исследовании FORomegaARD планируется оценить эффективность 6-месячной терапии ω-3 ПНЖК в дозе 1 г/сут в профилактике рецидивов аритмии у 1400 пациентов с пароксизмальной или персистирующей фибрилляцией предсердий. Цель исследования OPERА – изучение эффективности периоперационного применения ω-3 ПНЖК в профилактике фибрилляции и трепетания предсердий у 1500 пациентов, которым проводятся операции на сердце.
Омега-3 ПНЖК в профилактике ВСС и других исходов
Убедительным подтверждением эффективности ω-3 ПНЖК в профилактике сердечно-сосудистых исходов стали результаты рандомизированного контролируемого исследования GISSI-Prevenzionе, в которое были включены 11 324 пациента, недавно перенесших ИМ (≤ 3 месяцев) [35]. На 4 группы были рандомизированы пациенты, в течение в среднем 3,5 лет получавшие ω-3 ПНЖК (1 г/сут), витамин Е (300 мг/сут) или комбинацию ω-3 ПНЖК и витамина Е. Пациентам контрольной группы проводили только стандартную терапию, сопоставимую в группах сравнения. Более 80 % пациентов получали антитромбоцитарные препараты, меньше половины – ингибиторы АПФ и β-адреноблокаторы. Исходно частота применения статинов была низкой, но увеличилась до 46 % к концу исследования. Риск неблагоприятных исходов у обследованных пациентов был относительно невысок (только 16 % пациентов были в возрасте ≥ 70 лет, снижение фракции выброса левого желудочка ≤ 40 % отмечено у 14 % больных, проба с физической нагрузкой была положительной в 29 % случаев). В отличие от многих других исследований в GISSI-Prevenzione применялся стандартизированный рецептурный препарат Омакор, содержащий 90 % высокоочищенных ЭПК и ДГК.
Таблица.Снижение риска различных исходов при лечении ω-3 ПНЖК 90 % в исследовании GISSI-Prevenzione.
Исследование не подтвердило эффективность витамина Е в профилактике неблагоприятных сердечнососудистых исходов. В то же время лечение ω-3 ПНЖК в дозе 1 г/сут достоверно снизило частоту первичных конечных точек: суммарной частоты смерти от любых причин, нефатальных ИМ и инсульта на 15 % (р = 0,023) и суммарной частоты смерти от сердечно-сосудистых причин, нефатальных ИМ и инсульта на 20 % (р = 0,008; см. таблицу). Более того, терапия ω-3 ПНЖК сопровождалась снижением общей смертности, сердечнососудистой смертности и смертности от ИБС, которые служили вторичным критерием эффективности (рис. 2). Наиболее значительно (на 45 %; р = 0,0006) снизился риск ВСС. В то же время частота нефатальных сердечнососудистых исходов достоверно не различалась. Таким образом, улучшение прогноза было достигнуто в основном за счет эффективной профилактики ВСС. Благоприятный эффект ω-3 ПНЖК проявлялся быстро и сохранялся на протяжении всего исследования: снижение риска ВСС достигло статистической значимости уже через 4 месяца после начала лечения (на 53 %; p = 0,048) [36]. Следует отметить, что эффективность лечения ω-3 ПНЖК была выше у пациентов, более строго соблюдавших средиземноморскую диету [37]. Таким образом, результаты GISSI-Prevenzione показали, что ω-3 ПНЖК 90 % должны быть стандартным компонентом вторичной профилактики у пациентов, перенесших ИМ.

Следующим важным этапом изучения эффективности ω-3 ПНЖК 90 % стало двойное слепое рандомизированное плацебо-контролируемое исследование GISSI-HF, в которое были включены 7046 пациентов с СН II–IV функционального класса [38]. Средний возраст пациентов составил 67 лет (42 % старше 70 лет). У подавляющего большинства больных фракция выброса левого желудочка была ниже 40 %. Только у половины пациентов причиной СН была ИБС. Частота применения блокаторов ренинангиотензиновой системы составила 94 %, β-адреноблокаторов – 65 %, спиронолактона – 39 %. Рандомизированным пациентам назначали ω-3 ПНЖК 90 % в дозе 1 г/сут или плацебо на фоне стандартной терапии. Медиана длительности наблюдения составила 3,9 года. Первичными конечными точками были время до смерти или госпитализации по поводу сердечно-сосудистых заболеваний.
Лечение ω-3 ПНЖК 90 % привело к небольшому, но статистически значимому снижению общей смертности на 9 % (р = 0,041), а суммарной частоты смерти вследствие любых причин или госпитализаций по поводу сердечно-сосудистых заболеваний на 8 % (р = 0,009). При анализе вторичных конечных точек выявлено достоверное снижение сердечно-сосудистой смертности на 10 % (р = 0,045) и частоты госпитализаций по поводу сердечнососудистых заболеваний на 7 % (р = 0,026). В отличие от исследования GISSI-Prevenzione достоверного снижения риска ВСС у обследованных пациентов отмечено не было. Тем не менее частота госпитализаций по поводу желудочковых аритмий снизилась на 28 % (р = 0,013). В выборке пациентов, которые выполняли требования протокола (т. е. продолжали лечение в течение по крайней мере 80 % от намеченного срока), общая смертность снизилась на 14 % (р = 0,004).
Таким образом, исследование GISSIHF подтвердило эффективность ω-3 ПНЖК 90 % в профилактике неблагоприятных исходов у пациентов с СН различного генеза. Необходимо отметить, что благоприятный эффект ω-3 ПНЖК 90 % был установлен при анализе общей смертности у пациентов, получавших адекватную стандартную терапию, на фоне которой было сложнее добиться дополнительного улучшения прогноза. Неожиданным стало отсутствие снижения риска ВСС.
Тем не менее частота госпитализаций по поводу желудочковых аритмий снизилась на 28 %, что подтверждает антиаритмическую эффективность препарата. Интересные результаты были получены при анализе результатов эхокардиографии в динамике у 608 пациентов. Лечение 3-ПНЖК 90 % привело к небольшому, но статистически значимому увеличению фракции выброса левого желудочка (р = 0,0050) через 1, 2 и 3 года по сравнению с плацебо [39]. Сходные результаты получены в небольшом рандомизированном плацебо-контролируемом исследовании у 133 пациентов с хронической СН неишемической этиологии и фракцией выброса левого желудочка < 45 % [40]. У больных, получавших ω-3 ПНЖК в течение года, выявили улучшение эхокардиографических показателей функции левого желудочка по сравнению с плацебо (p < 0,001). Кроме того, в основной группе отмечено достоверное снижение частоты госпитализаций по поводу сердечно-сосудистых заболеваний (15 и 40 % соответственно; р = 0,0029) и СН (6 и 30 %; р = 0,0002). Полученные данные не позволяют сделать однозначный вывод о том, что ω-3 ПНЖК уменьшают ремоделирование левого желудочка у больных хронической СН, хотя возможный благоприятный эффект имеет важное значение для препарата, обладающего антиаритмическими свойствами.
Исследования GISSI-Prevenzione и GISSI-HF продемонстрировали также высокую безопасность и хорошую переносимость ω-3 ПНЖК. Основными нежелательными явлениями были желудочно-кишечные нарушения, однако они были легковыраженными и нередко наблюдались не только в основной группе, но и в группе плацебо. В исследовании GISSI-HF частота прекращения лечения из-за нежелательных явлений была низкой (3 %) и одинаковой в группах сравнения.
Формы применения ω-3 ПНЖК: что выбрать?
Омега-3 ПНЖК в большом количестве содержатся в жире морских рыб. В эпидемиологических исследованиях показано, что регулярное употребление рыбы и морепродуктов ассоциируется со снижением сердечно-сосудистой смертности и риска других исходов [41]. Хотя польза средиземноморской диеты, предполагающей, в частности, увеличение количества рыбы в рационе, в сердечно-сосудистой профилактике, особенно первичной, не вызывает сомнений; одной диеты для проявления антиаритмических свойств ω-3 ПНЖК все же недостаточно. Диета не позволяет четко дозировать поступление ω-3 ПНЖК в организм и поддерживать их постоянные уровни в крови, причем ее эффективность может зависеть от условий приготовления пищи. Например, в популяционном исследовании CHS не была подтверждена польза употребления жареной рыбы, в то время как риск развития фибрилляции предсердий и нефатального ИМ значительно снизился при регулярном употреблении вареных рыбных продуктов [42].
В многоцентровом рандомизированном плацебо-контролируемом исследовании Alpha Omega применение маргарина, содержащего ω-3 ПНЖК в небольшой дозе (400 мг), у 4837 пациентов, перенесших ИМ, не привело к достоверному снижению риска сердечно-сосудистых исходов [43]. Частота неблагоприятных исходов, связанных с желудочковыми аритмиями, снизилась на 10 %, однако этот эффект также не достиг статистической значимости.
Источником ω-3 ПНЖК могут служить также биологически активные добавки (БАДы), в состав которых входят различные ЖК, некоторые из которых обладают аритмогенными свойствами [44]. Однако БАДы могут содержать различные примеси (например, продукты окисления, диоксины, ртуть и др.), ухудшающие переносимость лечения и дающие другие неблагоприятные эффекты (усиление оксидантного стресса и т. п.). Кроме того, БАДы различаются по содержанию действующих веществ и не изучаются в рандомизированных клинических исследованиях, что не позволяет судить об их эффективности и безопасности.
В отличие от БАДов Омакор – это стандартизированный рецептурный препарат, который производится в условиях GMP (Good Manufacturing Practice) в соответствии со строгими спецификациями, не предусматривающими наличия каких-либо примесей. Безопасность Омакора в рекомендуемых дозах хорошо изучена, а эффективность (в т. ч. в профилактике сердечно-сосудистых осложнений) установлена в рандомизированных контролируемых исследованиях.
Заключение
Эпидемиологические данные говорят о том, что ω-3 ПНЖК обладают антиаритмическими свойствами. Это подтверждают результаты опытов на животных и клинических исследований пациентов с желудочковыми и наджелудочковыми аритмиями, в т. ч. фибрилляцией предсердий. Многие клинические исследования были относительно небольшими, и их результаты оказались неоднозначными. Частично это могло быть связано с неоднородностью исследований (критерии эффективности, состав и дозы препаратов, особенности диеты, длительность лечения и т. п.). Тем не менее в двух крупных рандомизированных контролируемых исследованиях, GISSI-Prevenzione и GISSI-HF, установлена эффективность длительной терапии ω-3 ПНЖК 90 % в дозе 1 г/сут в профилактике неблагоприятных сердечно-сосудистых исходов у пациентов с ИМ и СН соответственно. Наибольшего антиаритмического эффекта при лечении ω-3 ПНЖК 90 %, по-видимому, следует ожидать у пациентов с ИБС и желудочковыми нарушениями ритма без выраженных структурных изменений в миокарде, при нормальной или умеренно сниженной фракции выброса левого желудочка [19]. Несомненными преимуществами ω-3 ПНЖК 90 % являются безопасность и хорошая переносимость, поэтому у пациентов с серьезными нарушениями ритма их можно применять в комбинации с антиаритмическими препаратами с целью улучшения результатов лечения. Если назначение антиаритмических препаратов необоснованно или противопоказано, возможна монотерапия ω-3 ПНЖК 90 %. Очевидна необходимость в дальнейшем изучении эффективности ω-3 ПНЖК 90 %.
В настоящее время проводятся исследования GISSI-R&P, ASCEND, VITAL, ORIGIN (в целом более 40 тыс. пациентов), позволяющие уточнить показания к их применению в клинической практике.
Информация об авторе:
Моисеев Сергей Валентинович – доктор медицинских наук, профессор кафедры терапии и профболезней
медико-профилактического факультета ГОУ ВПО “Первый МГМУ им. И.М. Сеченова” Минздравсоцразвития России.
E-mail: clinpharm@mtu-net.u



