Изучение факторов риска развития сердечно-сосудистых заболеваний у женщин в различные периоды жизни представляет собой отдельную, важную и достаточно сложную задачу. С наступлением менопаузы и утратой защитного влияния половых гормонов в организме женщины происходят изменения, способные оказывать неблагоприятное влияние на величину сердечно-сосудистого риска [1]. В постменопаузе происходит постепенное повышение инсулинорезистентности (ИР), что способствует развитию относительной гиперинсулинемии, повышению уровня глюкозы в плазме натощак, нарушению толерантности к глюкозе и в конечном итоге – к развитию сахарного диабета 2 типа (СД2).
К наиболее важным причинам снижения чувствительности тканей к инсулину, возникающих у женщин в постменопаузе, относят возрастной дефицит эстрогенов и развитие абдоминального ожирения (АО), часто сочетающихся с неблагоприятными метаболическими изменениями [1].
Период менопаузального перехода и ранняя постменопауза являются оптимальными периодами для начала лечения климактерического синдрома, а также для формирования здорового образа жизни и назначения менопаузальной гормональной терапии (МГТ). Однако до сегодняшнего дня применение МГТ для коррекции климактерического синдрома (КС) и опосредованно сопутствующих метаболических нарушений остается достаточно редким, а долговременная приверженность такой терапии из-за возможных осложнений по-прежнему низкая.
В cвязи с этим большое значение могут иметь и доза эстрогена, и характеристики прогестагена в составе комбинированного режима МГТ. Наиболее перспективной комбинацией для длительного ее использования у женщин в постменопаузе с КС и сопутствующими метаболическими нарушениями является низкодозовая комбинация, включающая натуральный эстроген [1 мг 17β-эстрадиола (E2)] и прогестин [2 мг дроспиренона (ДРСП)].
Цель исследования – оценка выраженности АО и нарушений углеводного обмена у женщин в период ранней постменопаузы и возможности длительного использования комбинированной МГТ 1 мг E2/2 мг ДРСП для коррекции выявленных нарушений.
Материал и методы
В исследование были включены 162 женщины периода ранней постменопаузы с различными проявлениями КС в возрасте 52,5 (48,0–56,0) лет. После получения письменного согласия на участие в исследовании все обследуемые пациентки в дальнейшем были разделены на 2 группы: 1-ю группу (основная) составили 84 пациентки, которым совместно с гинекологом-эндокринологом по клиническим показаниям была назначена для непрерывной комбинированной терапии МГТ 1 мг E2/2 мг ДРСП (препарат Анжелик®, Байер Фарма АГ) 1 раз в сутки ежедневно, 2-ю группу (контроля) составили 78 женщин, не получавших МГТ.
Решение о продолжении МГТ или отказе от нее принималось индивидуально, было отдано на усмотрение хорошо информированной пациентки и врача с учетом объективной оценки индивидуального баланса пользы и риска согласно существующим рекомендациям [2].
Длительность терапии составила 5,2 (крайние значения от 4,8 до 5,7) года. Динамическое наблюдение за женщинами, принимавшими МГТ, с обязательным скрининговым анализом мазка из шейки матки, выполнением ультразвукового исследования гениталий и маммографическим обследованием, оценкой лабораторных показателей гемостаза осуществлялось в сроки, установленные существующими рекомендациями [2, 3].
Критерии невключения в исследование: наличие клинически манифестного атеросклероза, СД1 и СД2, развитие артериальной гипертензии (АГ) в репродуктивном периоде и симптоматической АГ, нарушения ритма сердца, онкологические заболевания, преждевременная и ранняя менопауза, гистеровариэктомия, тяжелые соматические заболевания, курение на момент исследования и в анамнезе, противопоказания к приему МГТ.
При включении в исследование всем участницам проводили общеклиническое обследование, определение основных биохимических показателей крови. Для оценки степени избыточной массы тела или ожирения вычисляли индекс массы тела (ИМТ). Выраженность АО определяли косвенно по величине окружности талии (ОТ) и коэффициенту окружность талии/окружность бедер (ОТ/ОБ).
Состояние углеводного обмена оценивали по уровню тощаковой глюкозы венозной плазмы и по результатам перорального глюкозотолерантного теста.
Чувствительность периферических тканей к инсулину оценивали по концентрации иммунореактивного инсулина (ИРИ) и С-пептида, которые определяли в плазме венозной крови утром натощак методом иммуноферментного анализа. Для выяснения степени ИР определяли гомеостатический индекс ИР – HOMA-IR (Homeostasis Model Assessment of Insulin Resistance).
Степень тяжести КС (нейровегетативных, психоэмоциональных и обменно-эндокринных нарушений) и эффективность проводимого лечения оценивали в баллах модифицированного менопаузального индекса Куппермана–Уваровой.
Завершили исследование 69 женщин основной группы и 66 женщин группы контроля. За весь период наблюдения серьезных осложнений МГТ, включивших развитие венозного тромбоза и эмболий, ишемического инсульта и случаев острого коронарного синдрома, онкологических заболеваний выявлено не было. В целом переносимость терапии была удовлетворительной.
Статистическая обработка данных выполнена с помощью программы «Statistica 6.0». В случае нормального распределения изучаемые признаки представлены в виде M±SD и в виде медианы, а также интерквартильного интервала [Ме (25%;75%)], если изучаемые признаки не имели нормального распределения. Для качественных показателей вычисляли абсолютные и относительные частоты. При анализе межгрупповых различий количественных показателей использовался в случае нормальных распределений t-критерий Стьюдента и непараметрический критерий Манна–Уитни, если изучаемые признаки не имели нормального распределения. Для выявления существующих различий по качественным признакам использовали точный критерий Фишера, χ2-критерий. Отношение шансов (ОШ) рассчитывали с использованием четырехпольных таблиц. Различия считались значимыми, если 95% доверительный интервал (ДИ) не включал значение 1,0. Для исследования связи признаков рассчитывались коэффициенты корреляции Спирмена (r). Критический уровень значимости в исследовании принимался р<0,05.

Результаты и обсуждение
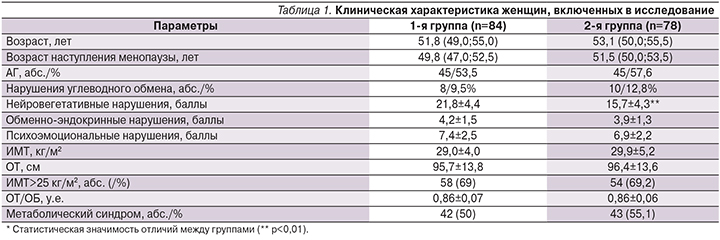
Клиническая характеристика женщин, включенных в исследование, представлена в табл. 1.
Достоверных различий между женщинами двух групп по основным анализируемым показателям выявлено не было. У обследуемых женщин в структуре КС преобладали нейровегетативные и психоэмоциональные симптомы, реже встречались обменно-эндокринные нарушения. Несмотря на схожую структуру жалоб, тяжесть КС, согласно результатам анкетирования модифицированного менопаузального индекса, у женщин основной группы была более выражена, что также стало дополнительным фактором обоснованности назначения МГТ.
Несомненно, МГТ является патогенетической терапией первой линии и самым эффективным методом лечения менопаузальных симптомов.
Выбор того или иного препарата МГТ определяется характером менопаузы, длительностью периода постменопаузы, а также степенью выраженности метаболических нарушений и наличием различной сопутствующей патологии. Побочные эффекты и переносимость комбинированных препаратов для МГТ во многом определяются свойствами прогестагенного компонента, что представляется особенно важным при использовании непрерывного режима терапии женщин в постменопаузе.
В рекомендациях IMS (International Menopause Society, 2016) подчеркивается, что MГT включает широкий список различных гормональных препаратов и путей их введения с потенциально разными рисками и преимуществами, поэтому термин «эффект класса» окончательно признан неправомочным [4]. В связи с этим следует отдавать предпочтение МГТ с метаболически нейтральным гестагенным компонентом.
Дроспиренон – прогестаген, фармакологический профиль которого наиболее близок к эндогенному прогестерону по сравнению с другими синтетическими прогестагенами, применяющимися в настоящее время.
В отличие от других доступных прогестагенов ДРСП обладает антиминералокортикоидной активностью, поскольку связывается с минералокортикоидными рецепторами, а его сродство к этим рецепторам существенно выше альдостерона. Он также обладает умеренным антиандрогенным влиянием, при этом у него отсутствуют нежелательные андрогенные и глюкокортикоидные свойства, что особенно важно при его применении пациентками с метаболическим синдромом [5].
По результатам проведенного исследования, прием 1 мг E2/2 мг ДРСП сопровождался значимым уменьшением выраженности КС с переходом из тяжелой и средней степеней тяжести в легкую или полное отсутствие симптомов. Данная динамика сохранялась в течение всего периода исследования, что существенно отличало женщин этой группы от пациенток, не принимавших МГТ, у которых сохранялись проявления КС с нарастанием обменно-эндокринных нарушений на протяжении всего периода наблюдения.
Проведена оценка изменений массы тела и выраженности АО у постменопаузальных женщин. Исходно достоверных отличий между женщинами двух групп по показателям ИМТ, ОТ и отношения ОТ/ОБ выявлено не было (табл. 2).
Важным свойством ДРСП является его способность воздействовать на висцеральную жировую ткань и дифференцировку адипоцитов, что препятствует увеличению объема висцерального жира, способствует нормализации чувствительности к инсулину и липидного обмена [6–8].
В проведенном нами исследовании установлено достоверное снижение ИМТ на фоне приема МГТ на протяжении всего периода наблюдения (табл. 2). Снижение ИМТ к окончанию исследования отмечено у 23 (33,3%) пациенток в среднем на 2,6 кг/м2, у 41 (59,4%) пациентки масса тела не изменялась и лишь у 5 (7,2%) масса тела увеличилась на 2,1 кг/м2. У женщин контрольной группы наблюдался иной характер изменений – достоверное увеличение ИМТ к окончанию исследования. Повышение ИМТ к окончанию исследования установлено у 45 (68,2%) женщин в среднем на 3,4 кг/м2, снижение массы тела выявлено лишь у 7 (10,6%) пациенток, а неизменной масса тела оставалась у 14 (21,2%) женщин.
На фоне длительной МГТ ДРСП в дозе 1 мг E2/2 мг отмечено изменение выраженности висцерального ожирения. У женщин основной группы установлено уменьшение выраженности АО (достоверное снижение показателей ОТ и отношения ОТ/ОБ) на протяжении всего периода наблюдения (табл. 2). К окончанию исследования снижение ОТ установлено у 27 (39,1%) женщин в среднем на 3,1 см, отсутствие динамики показателя выявлено у 34 (49,3%) женщин, увеличение висцерального ожирения было выявлено только у 8 (11,6%) женщин – в среднем на 3,4 см. У женщин группы контроля отмечен иной характер изменений – достоверное возрастание величины этих показателей к окончанию исследования. Повышение ОТ выявлено у 50 (75,7%) женщин в среднем на 3,7 см, отсутствие динамики выявлено у 11 (16,7%) и уменьшение ОТ установлено только для 5 (7,6%) пациенток.
Выявленное существенное уменьшение выраженности АО (достоверное уменьшение показателей ОТ и отношения ОТ/ОБ) при меньшем изменении ИМТ может свидетельствовать о перераспределении жировой ткани по «женскому» глютеофеморальному типу на фоне длительной МГТ ДРСП в дозе 1 мг E2/2 мг.
В этом контексте уместно отметить наличие у женщин фобий относительно повышения массы тела на фоне проведения МГТ. Восполняя эстрогенный дефицит, комбинация 1 мг E2/2 мг ДРСП способствует если не снижению, то по крайней мере стабилизации массы тела, уменьшая компенсаторное увеличение периферической жировой ткани, необходимое для трансформации андрогенов в эстрон.
Проведена оценка изменений углеводного обмена и показателей ИР у женщин в постменопаузе. На сегодняшний день недостаточно данных для рекомендации МГТ с целью профилактики СД, т.е. не является показанием. В то же время СД2 не служит противопоказанием к назначению МГТ. Однако у женщин с СД2 повышен риск ишемической болезни сердца, который ассоциирован с дислипидемией, ожирением, АГ. В связи с этим следует отдавать предпочтение применению МГТ с нейтральным гестагенным компонентом, что делает актуальным использование выбранной комбинации у женщин этой категории [1–3].
В некоторых исследованиях была показана возможность МГТ оказывать положительное влияние на уровень инсулина крови, на выраженность ИР, однако ограничением этих исследований стала их малая продолжительность. В связи с этим вызывает интерес изучение долгосрочных эффектов применения 1 мг E2/2 мг ДРСП на динамику углеводного обмена и показателей ИР у постменопаузальных женщин [7, 9, 10]. Исходных достоверных различий в величине изучаемых показателей у женщин двух групп выявлено не было. Нарушения углеводного обмена отмечены у 8 (9,5%) женщин основной группы и у 10 (12,8%) – группы контроля.
За период проведения исследования у женщин на фоне МГТ было зарегистрировано два случая СД2 и один случай нарушения толерантности к глюкозе (НТГ). У женщин группы контроля впервые диагностировано четыре случая СД2 и два случая НТГ.
Таким образом, длительное применение комбинации 1 мг E2/2 мг ДРСП ассоциировано с отчетливым уменьшением вероятности развития нарушений углеводного обмена (ОШ=0,42, 95% ДИ – 0,17–1,04).
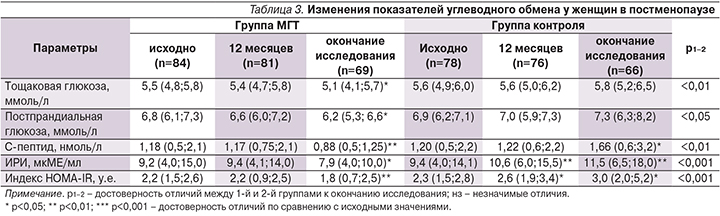
Изменения величины показателей углеводного обмена и ИР у женщин ранней постменопаузы представлены в табл. 3.
У женщин на фоне МГТ к 12 месяцам терапии достоверных изменений углеводного обмена выявлено не было: уровни базальной и постпрандиальной глюкозы крови, маркеры ИР (ИРИ, индекс НОМА-IR и С-пептид) значимо не отличались от исходного уровня. По окончании исследования отмечена достоверная динамика, свидетельствующая о снижении ИР: уменьшение уровня ИРИ и С-пептида, снижение индекса НОМА-IR, сочетающаяся со снижением уровней базальной и постпрандиальной глюкозы крови. Важно отметить, что снижение показателей ИР сочеталось с уменьшением выраженности АО.
Иной характер изменений выявлен у женщин группы контроля: по мере прогрессирования ожирения повышались уровни косвенных маркеров ИР – ИРИ и индекса НОМА-IR, С-пептида, отмечалась отчетливая тенденция к повышению уровня постпрандиальной глюкозы крови.
При проведении корреляционного анализа установлены связи между ИРИ и показателями висцерального ожирения – ИМТ (r=0,28; р<0,05), ОТ (r=0,36; р<0,01), отношением ОТ/ОБ (r=0,27; р<0,05); связи между величиной АО и С-пептидом – ИМТ (r=0,65; р<0,01), ОТ (r=0,72; р<0,01), отношением ОТ/ОБ (r=0,68; р<0,05). Эти взаимосвязи вполне логичны, т.к. ранее было показано, что повышение концентрации С-пептида у женщин в пери- и постменопаузе происходит раньше, чем повышение концентрации инсулина, поэтому С-пептид может быть более информативным, чем инсулин, показателем развивающегося состояния ИР [11].
Таким образом, на фоне длительного применения комбинированной МГТ ДРСП в дозе 1 мг E2/2 мг установлены положительные изменения углеводного обмена и ИР, уменьшение выраженности висцерального ожирения и снижение частоты новых случаев нарушений углеводного обмена. Полученные данные позволяют обсуждать важную роль комбинации 1 мг E2/2 мг ДРСП в предотвращении развития метаболического синдрома и нарушений углеводного обмена у женщин периода ранней постменопаузы.



