Введение
Постановка диагноза хронического гастрита (ХГ) невозможна без морфологического, включая и иммуногистохимическое, исследования слизистой оболочки желудка (СОЖ).
В рутинной практике для оценки СОЖ используется визуально-аналоговая шкала (ВАШ), которая не учитывает анатомо-физиологических особенностей организма ребенка. Результаты гистологической картины СОЖ базируются на полуколичественных критериях, что, с нашей точки зрения, ограничивает использование ВАШ в педиатрии. В связи с этим приобретает значение морфометрический анализ СОЖ, в рамках которого измеряются е1-толщина, глубина ямок и шеек, высота поверхностного эпителия, количество желез в отдельных областях. Однако эти показатели достаточно вариабельны, низкоспецифичны, кроме того, отсутствует нормативная база [1, 2]. В то же время оценка клеточного состава желез СОЖ более перспективна, особенно при сочетании световой микроскопии и иммуногистохимического анализа [3–5]. При этом информация о количественных характеристиках субпопуляций клеток в фундальных и пилорических железах у детей, страдающих хроническом гастритом, практически отсутствует.
Цель исследования: установить закономерности изменений клеточного состава фундальных и пилорических желез при ХГ у детей.
Методы
Обследованы 213 больных 7–17 лет с верифицированным ХГ, из них 111 мальчиков и 102 девочки.
Для морфологического исследования использовался биопсийный материал СОЖ, полученный из тела и антрального отдела. Срезы толщиной 5–10 мкм окрашивали гематоксилин-эозином и шифф-йодной кислотой с альциановым синим (PAS-реакция).
Результаты оценивались по стандартной ВАШ с оценкой обсемененности Нр, активности и выраженности воспалительного процесса (по степени нейтрофильной и лимфоплазмоцитарной инфильтрации соответственно), атрофии и кишечной метаплазии.
Определяли основные субпопуляции клеток желез тела и антрального отдела желудка (главные, париетальные, эндокринные, добавочные) в ‰ (абсолютное число клеток каждого пула из расчета на 1000 эпителиоцитов желез СОЖ).
Пятидесяти детям проведено иммуногистохимическое исследование биоптатов СОЖ (аппарат «Ventana Bench Mark XT», фирма «Roche»; Швейцария). Применялись наборы моноклональных антител к гастрину, соматостатину, пепсиногенам-I и -II, кислому и нейтральному муцинам (фирмы «Dako» и «Roche»). Количество эпителиоцитов, продуцирующих соответствующие субстраты, выявлены по методике C.R. Taylor, R. Cote [6].
В качестве референсной базы использовали данные морфометрического анализа СОЖ без достоверных признаков воспаления.
Статистическая обработка цифрового материала проводилась с применением программы «Statistica 10». Рассчитывали средние величины (М), их ошибки (m), стандартное отклонение (SD). Вариационные ряды анализировались на соответствие закону нормального распределения с помощью признака Шапиро–Уилка. Статистическая значимость различий в зависимости от его характера определялась по критериям Стьюдента или Манна–Уитни, в случае относительных величин (% и ‰) с помощью углового преобразования Фишера.
Результаты
В процессе работы нами было установлено, что воспалительный процесс сопровождается значительной перестройкой клеточного состава желез СОЖ как в теле, так и в антральном отделе.
В фундальных железах (табл. 1) по мере усиления воспалительного процесса наблюдалось резкое уменьшение числа главных клеток, которое при выраженном процессе составляло лишь 40,5% от нормы. Параллельно имело место нарастание числа париетальных и добавочных клеток. Наибольшим количественным изменениям были подвержены эндокринные клетки, число которых уже при незначительном воспалении возрастало более чем вдвое, а при выраженном в 3,5 раза.
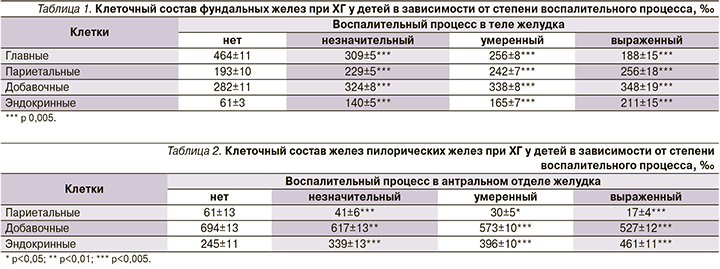
В антральном отделе (табл. 2), как и в теле, в наибольшей степени нарастало число эндокринных клеток: при выраженном воспалительном процессе он увеличивался по отношению к референсным значениям практически вдвое, что сопровождалось существенным снижением париетальных клеток. Количество добавочных клеток уменьшалось параллельно нарастанию степени воспалительного процесса (максимально на 24,1% при выраженном воспалении).
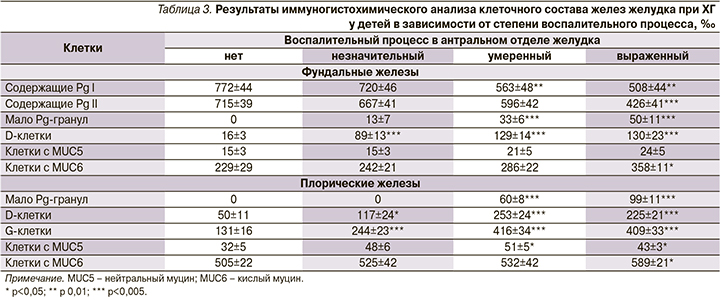
По данным иммуногистохимического анализа (табл. 3) было установлено, что в теле желудка по мере усиления воспалительного процесса наблюдалось значительное уменьшение числа клеток, содержавших пепсиногены-I и -II (PgI и PgII), возрастало число клеток с низким количеством гранул, содержащих Pg,как в фундальных, так и в пилорических железах.
Обсуждение
Как известно, главные клетки являются наиболее специализированным типом из всех клеток СОЖ и для их окончательной дифференцировки при миграции из генеративной зоны требуется значительное время [6–8]. При хроническом воспалительном процессе в СОЖ увеличивается скорость клеточного обновления, в ходе которого формируется большее число менее специализированных клеток, прежде всего добавочных. В этих условиях уменьшение секреции пепсиногена направлено на снижение агрессивной составляющей желудочного секрета, что проявляется ростом главных клеток с низким числом Pg-содержащих гранул в цитоплазме. То есть целесо-образной защитно-приспособительной реакцией при действии на СОЖ таких повреждающих факторов, как соляная кислота, пепсин, гистамин, является усиление продукции муцина, что может быть обеспечено увеличением числа шеечных мукоцитов.
Данные предположения подтвердились нашими результатами морфометрии. Число добавочных клеток в фундальных железах достоверно увеличивалось по мере усиления воспаления (на 23,4%). По результатам иммуногистохимического анализа еще более (на 56,3%) нарасла доля клеток, содержащих кислый муцин (MUC-6).
Одновременно количество добавочных клеток, иммунопозитивных к PgII, снизилось почтив в 2 раза, что отразило процесс муцинизации СОЖ и торможение продукции пепсиногенов в условиях текущего хронического воспалительного процесса.
В здоровой СОЖ определялся небольшой пул D-клеток. Уже при незначительном воспалении имело место кратное увеличение их числа (в 5,56 и 2,34 раза соответственно), а дальнейшее прогрессирование приводило к нарастанию числа D-клеток, максимально в 8,13 и 5,06 раза.
В отношении популяции D-клеток при хроническом воспалительном процессе СОЖ в специальной литературе приводятся прямо противоположные данные. В большинстве работ у взрослых пациентов констатируется уменьшение их числа, что сопровождается снижением плазменной концентрации соматостатина. После успешной антихеликобактерной терапии эти показатели демонстрируют обратную динамику [9–11]. Уменьшение числа D-клеток, регистрируемое у лиц среднего и старшего возраста при Нр-ассоциированном ХГ, рассматривается как следствие воздействия патогена. Другие исследователи сообщают об увеличении числа D-клеток у детей или отсутствие изменений [12–15].
По данным литературы, число G-клеток при воспалении в СОЖ увеличивается, при этом дефицит соматостатина в этих условиях приводит к нарушению контроля данной популяцией эндокриноцитов, что ведет к гипергастринемии [10, 12, 13, 16].
Известно, что D- и G-клетки взаимно влияют друг на друга. На мембранах G-клеток расположены рецепторы к соматостатину (SSTR2), а D-клетки имеют рецепторы для гастрина (CCK2R). Посредством соматостатина они паракринно оказывают тормозящее воздействие на G-клетки через специфический рецептор SSTR2. Избыточный уровень гастрина приводит к увеличению синтеза и секреции соматостатина D-клетками [17–19].
Детальный анализ количества клеток СОЖ, иммунопозитивных к гастрину и соматостатину в антральном отделе при различных степенях воспалительного процесса у детей с ХГ, позволил установить, что резкий прирост обоих видов клеток, достигший максимума при умеренном воспалении, затем сменился некоторым их снижением (в среднем на 11,1% для соматостатина и на 1,7% для гастрина). Следовательно, можно предположить, что по мере прогрессирования хронического воспалительного процесса на каком-то этапе возникает уменьшение синтетического потенциала, что в первую очередь затрагивает популяцию D-клеток.
Основываясь на результатах морфометрии, мы полагаем, что указанная диссоциация между пулами D- и G-клеток у детей служит результатом опережающего уменьшения числа клеток, продуцирующих соматостатин, на фоне более сохранной популяции клеток, секретирующих гастрин.
Усиление контролирующей функции соматостатина в условиях гиперфункции G-клеток подтверждается еще одним фактом. В отсутствие воспаления в слизистой оболочке антрального отдела абсолютное большинство D-клеток служат клетками закрытого типа, которые не имеют цитоплазматических выростов, обращенных в направлении интрагастрального пространства. По мере усиления воспаления резко увеличивается количество D-клеток открытого типа: в фундальных железах – в 3,6, в пилорических в 3,2 раза.
Известно, что на апикальной поверхности D-клеток открытого типа имеется рецептор, аналогичный таковому у G-клеток (CaSR). Посредством этих сенсорных структур ими считывается информация об уровне кислотности в полости желудка [20]. Увеличение числа D-клеток, зарегистрированных нами у детей с ХГ, по-видимому, отражает необходимость получения дополнительной информации об уровне рН для усиления контроля за G-клетками.
Причины увеличения числа париетальных клеток в теле желудка: гипергастринемия ведет к увеличению числа гистаминсодержащих клеток (ECL), имеющих соответствующие рецепторы (CCK-2), а увеличение их числа, сопровождающееся повышением секреции гистамина, стимулирует париетальные клетки посредством Н2-рецепторов, расположенных на их базальной мембране.
Другой механизм, вероятно имеющий меньшее значение, заключается в непосредственной стимуляции париетальных клеток гастрином путем связывания с рецептором CCK-2 [21].
Клиническим отражением гиперплазии пула париетальных клеток у детей и подростков с ХГ служит гиперацидность, которая определяется при рН-метрии у абсолютного большинства из них.
Естественным ограничителем активности париетальных клеток в теле желудка, тормозящим их кислотообразующую функцию, служит соматостатин. Увеличение общего числа D- и D-клеток открытого типа отражает усиление их контролирующей функции в отношении секреции соляной кислоты париетальными клетками.
При исследовании гастробиоптатов с использованием ВАШ у наших пациентов часто выявлялись морфологические признаки атрофии СОЖ (37,6%). Этот факт в сочетании с падением числа главных клеток нередко трактуется как проявление атрофического гастрита. Однако в ранее проведенных нами исследованиях показано, что клеточный состав желез СОЖ характеризуется высокой пластичностью. Регресс воспаления сопровождается увеличением количества главных клеток в фундальных железах, уменьшением или исчезновением признаков атрофии [22–25]. Такая динамика характерна для неопределенной атрофии, связанной с появлением смешанной клеточной инфильтрации и отеком СОЖ, сопутствующих ее воспалению [1, 26, 27].
Выводы
1. Процесс воспаления в СОЖ служит причиной ее значительной перестройки: в фундальных железах уменьшается число главных и увеличивается число обкладочных, добавочных и эндокринных клеток.
В пилорических железах также увеличивается число эндокринных клеток на фоне уменьшения пула обкладочных клеток.
2. Иммуногистохимический анализ показал, что в теле желудка на фоне роста степени интенсивности воспалительного процесса снижается число клеток, содержащих PgІ и PgІІ. В антральной области при невысокой интенсивности воспалительного процесса отмечается увеличение числа клеток, содержащих Pg-ІІ, однако при нарастании интенсивности воспалительного процесс их количество снижается.
3. Хронический воспалительный процесс проходит на фоне активации эндокринной функции желез СОЖ, что проявляется выраженным увеличением в них числа D- и G-клеток, а интенсификация продукции муцинов выражается в увеличении числа клеток, содержащих кислые и нейтральные муцины.



