Можно постулировать, что одним из наиболее часто встречающихся симптомов у пациентов любого профиля является боль, поскольку зачастую именно ее присутствие вынуждает человека обращаться за медицинской помощью. Однако ежедневное курирование пациентов, испытывающих боль, способно сделать этот симптом обыденным в глазах врача, лишить клинициста желания пристрастного анализа причин появления боли, обоснованного выбора анальгетического препарата с учетом индивидуальных рисков.
Определение боли и ее классификация
Актуальное определение термина «боль» подразумевает наличие неприятного сенсорного и эмоционального переживания, вызванного истинным или потенциальным повреждением ткани (IASP 1979). Восприятие боли человеком сугубо индивидуально и может зависеть от его генетических особенностей, пола, возраста, конституции, а также быть подверженным влиянию социально-культурных, гендерных факторов [1]. Известно, что пациенты европейского происхождения отмечают менее интенсивную боль в послеоперационном периоде по сравнению с афро- или латиноамериканцами, азиатами, что создает заманчивые перспективы исследований по поиску генетических предпосылок чувствительности к боли [2].
В зависимости от длительности выделяют острую и хроническую боль, длящуюся свыше 3 месяцев [3]. Как правило, острая боль возникает в ответ на повреждение тканей, способствует локализации данного повреждения и его отграничению от здоровых тканей, обеспечению иммобилизации для заживления ран и сопровождается выраженной нейроэндокринной реакцией. Различают следующие виды острой боли:
- поверхностная соматическая, точно локализована, носит колющий, жгучий характер (например, кожный порез);
- глубокая соматическая, менее локализованная, тупая, ноющая (встречается при заболеваниях суставов, сухожилий);
- висцеральная, диффузно распределенная, вегетативно окрашенная (сопровождает поражение внутренних органов и их оболочек).
Хроническая боль отличается длительным присутствием – свыше 3 месяцев, ослабленной нейроэндокринной реакцией, выраженными нарушениями сна, аффективными расстройствами, приводящими к болевому поведению и социальной дезадаптации. Стойкий болевой синдром плохо поддается лечению стандартными дозами анальгетиков и может быть обусловлен онкологической и неонкологической причинами. К последним относят заболевания с системным поражением соединительной ткани, патологию опорно-двигательного аппарата (системная склеродермия, артриты), а также заболевания центральной нервной системы. Согласно данным экспертов Всемирной организации здравоохранения (ВОЗ), частота хронической боли в популяции колеблется в широком диапазоне (от 2 до 49%) и обусловливает 11,3–40% всех обращений к врачу первичного звена, отличаясь неуклонным ростом распространенности [4]. Хроническая боль часто ассоциирована с депрессией и эмоционально-стрессовыми факторами, ее встречаемость выше среди женщин и пациентов старшего возраста, у лиц с низким уровнем дохода.
Ощущение боли формируется при термическом, механическом, химическом или ином раздражении кожных рецепторов, ноцицепторов глубоких тканей или внутренних органов, сопровождающимся генерацией импульсов, достигающих отделов нервной системы, где осуществляется их спинальная модуляция [5]. Итогом данной модуляции может явиться как усиление боли из-за ответа на стимулы ранее интактных нейронов, так и ее ослабление по причине супраспинального или сегментарного ингибирования, т.н. воротного контроля боли. Суть последнего заключается в том, что импульсы, проходящие по тонким периферическим волокнам, открывают «ворота» в нервную систему, чтобы достичь ее центральных отделов и сформировать ощущение боли. Закрыть «ворота» способны тормозящие импульсы, нисходящие из высших отделов нервной системы, а также импульсы, проходящие по толстым периферическим волокнам. Генерация таких импульсов достигается в результате растирания, поглаживания тканей в месте повреждения, аппликации разогревающих мазей или чрескожной электронейростимуляции, создающих контрраздражение, что и лежит в основе эффективности т.н. отвлекающей терапии [2]. Дальнейшим проводником болевого импульса являются классические нервные пути, заканчивающиеся в таламусе, осуществляющем координацию ноцицепции в центральной нервной системе. Эмоциональную окраску боль приобретает в лимбической системе; анализ, центральная модуляция и формирование ответа осуществляются в постцентральной извилине коры головного мозга.
Таким образом, становится понятной клиническая классификация боли, выделяющая ноцицептивную боль, формирующуюся при раздражении ноцицепторов; нейропатическую боль, возникающую вследствие повреждения периферической или центральной нервной системы и не связанную с раздражением ноцицепторов, и психогенную боль, обусловленную личностными характеристиками каждого индивида [6]. Кроме того, получают объяснение и клинические паттерны для каждого из представленных типов боли, и эффективные методы обезболивания. Так, ноцицептивная боль часто носит острый характер и поддается купированию применением анальгетиков, нестероидных противовоспалительных препаратов (НПВП), глюкокортикодов, опиоидов. Нейропатическая боль, напротив, чаще является постоянной, носит жгучий или стреляющий характер, сопровождается гипералгезией, гиперестезией, парестезией, аллодинией, дисфункцией симпатической нервной системы, ведет к нарушению трофики тканей и отличается резистентностью к стандартной терапии [7]. Препаратами, показавшими свою эффективность в терапии нейропатической боли, являются антиконвульсанты и антидепрессанты [8]. В случае психогенной боли дискомфортные ощущения не связаны с наличием эндогенных патологий и носят исключительно психоэмоциональный характер, при этом мнимый болевой синдром обычно является результатом стрессовых ситуаций и может сопровождаться повышенной тревожностью, паническими атаками. Чаще всего подобные болевые ощущения возникают в виде головной боли, кардиалгии, дорсалгии, абдоминалгии, не имеют точной локализации и четких вербальных дескрипторов; их развитию может предшествовать апатия, чувство душевного опустошения. Терапией выбора применительно к данному типу боли является психотерапия, а также назначение седативных средств, транквилизаторов или антидепрессантов [9, 10].
Объективизация болевого ощущения
Помимо понимания причин развития болевого синдрома для выбора терапии и оценки ее эффективности врачу важно учитывать интенсивность боли, испытываемой конкретным пациентом. Рекомендуется использовать валидизированные шкалы, такие как визуально-аналоговая шкала (ВАШ) боли, вербально-рейтинговая шкала боли, цифровая рейтинговая шкала, шкала мимической оценки боли Wong–Baker, позволяющие интерпретировать ощущения пациента. Для оценки нейропатической боли применяются опросник DN 4 и болевая шкала LANSS [8]. Существующая градация хронического болевого синдрома (ХБС) в зависимости от балльной оценки боли и ее влияния на ночной сон позволяет выделять слабый, умеренный и сильный ХБС и лежит в основе анальгетической лестницы, предложенной ВОЗ в 1986 г. для оказания паллиативной помощи лицам с онкологическими заболеваниями (рис. 1).
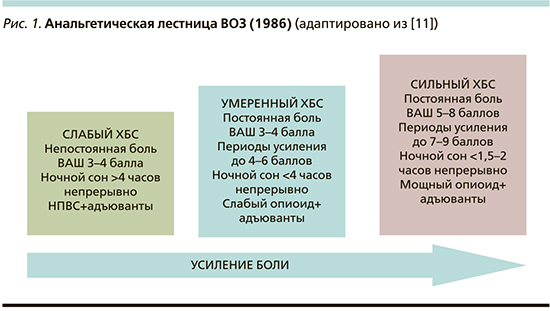
Как видно из рис. 1, основу анальгетического арсенала против слабого ХБС составляют представители класса НПВП, что согласуется с данными опросов, демонстрирующих высокую частоту назначения врачами препаратов данного класса [12, 13].
Выбор НПВП
Эффективность анальгетического действия НПВП определяется их противовоспалительной активностью и влиянием на основные элементы патогенеза острой боли [14]. Так, нарушение целостности живой ткани приводит к выбросу биологически активных субстанций, активирующих болевые рецепторы. Соответственно, подавляя активность фермента циклооксигеназы (ЦОГ), НПВП уменьшают опосредованную выработку простагландинов, что снижает чувствительность рецепторов к медиаторам боли [15, 16]. Помимо снижения активности периферических ноцицепторов НПВП способны подавлять нарастающую чувствительность спинальных нейронов, лежащую в основе патогенеза хронической боли [17, 18]. Существуют сведения, подтверждающие проникновение НПВП в ликвор здоровых добровольцев и подавление ими активности ЦОГ-2 в ткани ЦНС [19].
Согласно данным метаанализа M. Watson от 2007 г., все НПВП близки по своей эффективности при использовании в эквивалентных дозировках и выбор конкретного лекарственного средства необходимо осуществлять с учетом побочных эффектов каждого из них [20]. Основными нежелательными реакциями (НР) применения НПВП являются желудочно-кишечные осложнения, повышение риска сердечно-сосудистых событий и токсическое воздействие на почки [21], частота наступления которых зависит от возраста пациента [22]. Ведущей причиной развития НР приема НПВП является способность этого класса лекарственных веществ блокировать не только ЦОГ-2, активирующуюся в связи с повреждением ткани, но и ЦОГ-1, выполняющую ряд важных физиологических функций [23]. Так, ЦОГ-1 опосредованно участвует в синтезе слизи и бикарбонатов в желудке, агрегации тромбоцитов, снижении артериального давления, экскреции натрия, расслаблении бронхов и делении клеток. Вскоре после создания селективного НПВП (целекоксиба) была доказана зависимость негативного влияния различных представителей НПВП на желудочно-кишечную безопасность терапии от степени угнетения препаратами ЦОГ-1 (рис. 2) [24].
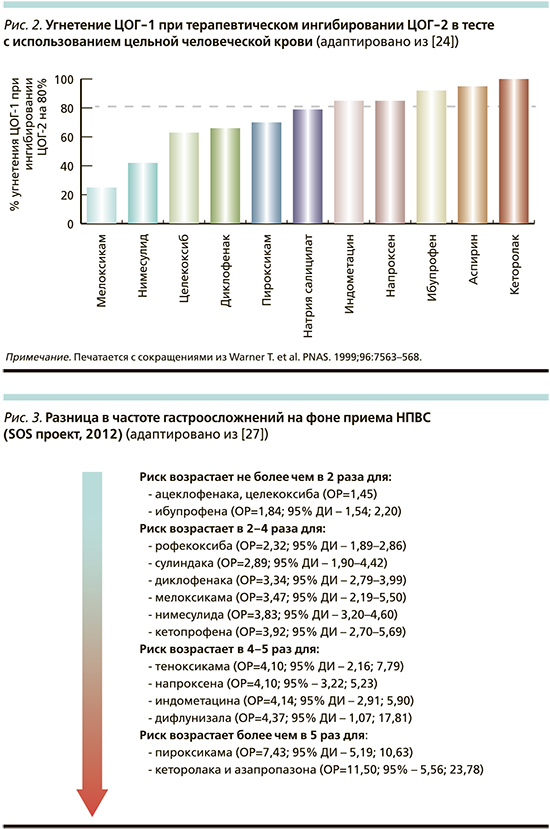
Представленная на рис. 2 закономерность в последующем нашла подтверждение во многих исследованиях. Так, масштабное рандомизированное клиническое исследование MEDAL (n=34 700) продемонстрировало сопоставимую частоту развития диспепсии и язвенных дефектов слизистой ЖКТ в случае использования эторикоксиба или диклофенака; меньшую суммарную частоту ЖКТ-осложнений при применении мелоксикама по сравнению с неселективными НПВП [25]. Мета-анализ A. Moore продемонстрировал наименьший суммарный риск осложнений со стороны всех отделов ЖКТ при приеме целекоксиба по сравнению с неселективными НПВП [26], а самый высокий риск гастроинтестинальных осложнений подтвержден для кеторолака.
Интересными представляются результаты международного проекта SOS, проведенного в 2012 г., объединившего результаты 2984 публикаций и включившего в итоговый анализ 28 сообщений об оценке гастробезопасности НПВП (рис. 3) [27]. Согласно полученным данным, минимальный риск развития НР со стороны ЖКТ наблюдается на фоне приема целекоксиба и ибупрофена, тогда как максимальный риск сопряжен с приемом пироксикама и кеторолака.
Факторами, повышающими риск развития НР со стороны ЖКТ, являются возраст старше 65 лет, язвенный анамнез, одновременное применение антикоагулянтов и глюкокортикоидов, клинически значимая коморбидность, курение, злоупотребление алкоголем, сопутствующая инфекция Helycobacter pylori, в то время как использование высокоселективных НПВП и прием гастропротективных препаратов (ингибиторы протонной помпы, мизопростол) способны снизить этот риск [14].
Основными кардиоваскулярными осложнениями приема НПВП являются развитие инфаркта миокарда и нарушение мозгового кровообращения за счет дозозависимого увеличения риска тромбоэмболических осложнений и повышения артериального давления [28]. При этом, чем выше ЦОГ-2 селективность препарата, тем более вероятно развитие данных НР, что предопределило создание рекомендации FDA (Управление по контролю качества пищевых продуктов и медикаментов в США) избегать назначения специфических ингибиторов ЦОГ-2 пациентам с ишемической болезнью сердца или инсультом в анамнезе [29]. Кардиоваскулярные осложнения приема высокоселективных коксибов объясняются их связыванием с боковым карманом канала ЦОГ-2, тогда как другие селективные НПВП связываются с верхней частью канала ЦОГ-2, сильнее ингибируя тромбоксан, участвующий в агрегации тромбоцитов [30].
Нарушение водно-солевого обмена, артериальная гипертензия, развитие застойной сердечной недостаточности на фоне применения НПВП обусловлены их ингибирующим влиянием на простагландины. Среди отдельных НПВП, способствующих увеличению систолического давления и повышению риска развития ишемического инсульта, фигурируют ибупрофен, рофекоксиб и эторикоксиб [31]. Согласно данным G. Singh, проанализировавшего 3,1 млн случаев, подавляющее большинство из которых представляли случаи приема НПВП по различным показаниям, нарушения мозгового крово-обращения были зарегистрированы у 15 659 человек; при этом относительный риск ишемического инсульта для рофекоксиба и индометацина составил 1,26, для ибупрофена – 1,19, диклофенака – 0,98, целекоксиба – 0,97 и мелоксикама – 0,88 [32]. Отмечено, что риск для лиц, принимавших мелоксикам, был сопоставим с таковым в группе пациентов, не принимавших НПВП [32]. Систематический обзор W. Asghar и F. Jamali [33] продемонстрировал самый низкий прирост общего риска кардиальных осложнений на фоне приема мелоксикама более 90 дней (в 1,14 раза), в то время как прием ибупрофена, напроксена, целекоксиба, диклофенака, индометацина, рофекоксиба был сопряжен с таковым и возрастал с увеличением дозы (препараты перечислены в порядке возрастания общего риска). В связи с этим ряд коксибов (в частности, рофекоксиб) были отозваны с рынка [14]. G. Gislason et al. проанализировали истории наблюдений за 58 432 пациентами после первого инфаркта миокарда в период с 1995 по 2002 г. и продемонстрировали, что прием любого НПВП приводит к повышению риска смерти. Так, ибупрофен увеличивал риск смерти в 1,5 раза, диклофенак – в 2,4, целекоксиб – в 2,57 раза [17].
Таким образом, для профилактики сердечно-сосудистых осложнений целесообразно контролировать артериальное давление на протяжении всего времени приема НПВП и при необходимости корректировать гипотензивную терапию [14] либо вовсе отказаться от назначения НПВП, выбрав альтернативные способы обез-боливания в случае исходно высокого кардиального риска [34].
Препаратом, обладающим лучшей переносимостью по сравнению с неселективными НПВП и не вызывающим значительного повышения кардиоваскулярного риска, можно считать амтолметин гуацил [35]. Наряду с выраженным анальгетическим и противовоспалительным потенциалом, реализуемым посредством угнетения активности ЦОГ-1 и-2, амтолметин гуацил обеспечивает существенное повышение концентрации оксида азота в слизистой оболочке ЖКТ, снижает секрецию соляной кислоты и ускоряет репарацию клеток слизистой желудка благодаря стимуляции рецепторов капсаицина [36, 37]. Клиническая эффективность и относительная безопасность препарата показана в ряде клинических исследований [38, 39] и мета-анализе [40].
Как представлено выше, результаты многочисленных исследований убеждают в необходимости осознанного выбора препарата группы НПВП с учетом коморбидного фона и индивидуальных рисков пациента. В случае противопоказаний к системному применению возможно назначение локальных форм НПВП, альтернативных лекарственных средств и нефармакологических методов снижения боли. К последним относят физические упражнения, доказавшие свою эффективность применительно к остеоартриту коленных суставов, фибромиалгии, неспецифической боли нижней части спины [41, 42, 43]; физиотерапевтическое воздействие; когнитивно-поведенческая терапия и образовательные программы для пациентов.
Выбор альтернативных анальгетиков
При недостаточной анальгетической эффективности НПВП осуществляется т.н. эскалация терапии, предусматривающая назначение опиоидных анальгетиков (см. рис. 1), способных обеспечить выраженный стойкий анальгетический эффект, торможение эмоциональной реакции больного и его седацию. Однако широкое применение опиоидов ограничено выраженным влиянием на систему дыхания, сердечную деятельность, желудочно-кишечный тракт и мочевыводящую систему, развитием толерантности и физической зависимости. К опиоидам первой линии относят трамадол, эффективный при умеренном ХБС, имеющий различные формы выпуска, а также входящий в состав комбинированных анальгетиков наряду с парацетамолом. В исследовании анальгетической эффективности комбинаций обезболивающих препаратов при острой боли показано, что добавление трамадола приводит к отчетливому пиковому снижению боли длительностью свыше 6 часов с незначительными побочными явлениями [44]. Опиоиды второй линии представлены следующими лекарственными средствами, доступными для перорального приема: бупренорфин, просидол, промедол, морфин, кодеин (последний доступен также в комбинации с парацетамолом и кофеином; в комбинации с парацетамолом и дротаверином; в комбинации с ибупрофеном); для парентерального введения: промедол, омнопон, морфин; а также для накожных аппликаций: бупренорфин, фентанил. Следует отметить, что парентеральные формы опиоидов оправданны для купирования эпизодов усиления, «прорывов» боли при ХБС, тогда как трансдермальные терапевтические системы являются удобной альтернативой пероральному приему и способны обеспечить выраженную анальгезию при меньшем количестве системных НР за счет поддержания оптимальной концентрации действующих веществ в крови.
Выбор адъювантных анальгетиков
К адъювантным анальгетикам относят препараты, рекомендованные для терапии расстройств, не связанных с болевым синдромом. Данная группа представлена противоэпилептическими препаратами и антидепрессантами. Несмотря на широкий спектр трициклических антидепрессантов, для лечения нейропатической боли на территории России зарегистрирован лишь амитриптилин, ингибирующий обратный захват серотонина и норадреналина с последующим усилением нисходящей активности норадренергических и серотонинергических систем, оказывающих тормозящее влияние на проведение болевых импульсов по ноцицептивным путям в ЦНС. Существенным недостатком амитриптилина является обширный список ограничений к применению, обусловленный не только его влиянием на вышеназванные системы, но и блокадой натриевых каналов, α1-адренергических, Н1-гистаминовых и М-холинергических рецепторов, обусловливающих побочные эффекты. Таким образом, амитриптилин противопоказан больным острым и подострым инфарктом миокарда, с нарушением внутрижелудочковой проводимости, закрытоугольной глаукомой; его с осторожностью следует применять пациентам с ишемической болезнью сердца, аритмией, артериальной гипертонией; постинсультным больным, лицам, имеющим задержку мочи или вегетативную недостаточность [45]. Селективные ингибиторы обратного захвата серотонина имеют меньше побочных эффектов, но обладают и меньшим анальгетическим потенциалом, недостаточным для эффективной терапии ХБС [46], что предопределило создание нового класса препаратов – антидепрессантов «двойного действия», избирательно увеличивающих в мозге содержание как серотонина, так и норадреналина. Данная группа представлена венлафаксином, дулоксетином и милнаципраном, однако и они не лишены недостатков: малый анальгетический потенциал, побочные действия [47].
Лекарственным средством с хорошей переносимостью и широким профилем безопасности, эффективным в отношении и депрессии, и ХБС, является пипофезин [47]. Отсутствие у пипофезина кардиотоксичности и холинолитического действий позволяет назначать препарат больным соматическими заболеваниями и лицам пожилого возраста, прежде всего в амбулаторных условиях. Таким образом, остановить свой выбор на антидепрессантах наиболее целесообразно в случае ХБС, сопровождающегося астено-депрессивными состояниями невротического характера, что позволит не только уменьшить боль, но и улучшить психологическое благополучие пациента.
Эффективность противоэпилептических средств при нейропатической боли объясняется уменьшением патологической импульсации нейронов за счет блокирования кальциевых и натриевых каналов, стимуляции ГАМКергической активности, и до настоящего времени представители данной группы являются препаратами выбора в лечении нейропатической боли. В связи с обширным перечнем нежелательных явлений и недостаточной степенью обезболивания противоэпилептические препараты первого поколения (фенитоин, фенобарбитал, примидон, этосуксимид, карбамазепин, вальпроевая кислота, диазепам, лоразепам, клоназепам) практически не рассматриваются в качестве первой линии терапии и следует избегать их назначения, пока не использованы все другие доступные лекарственные средства [8]. К противоэпилептическим препаратам второго поколения относят прегабалин, габапентин, ламотриджин, окскабазепин, топирамат, леветирацетам, тиагабин, зонисамид, вигабатрин, фелбамат. Указанные лекарственные средства имеют более благоприятный профиль безопасности, а также низкий риск лекарственных взаимодействий по сравнению с препаратами первого поколения [48, 49]. Габапентин и прегабалин являются единственными препаратами, зарегистрированными в России для лечения всех видов нейропатической боли у взрослых.
Заключение
Для повышения эффективности анальгетической терапии клиницисту необходимо составлять детальный портрет пациента, обращая внимание на вербальные дескрипторы нейропатической боли («жжение», «онемение», «прострел», «покалывание») и психогенной боли («мучительная», «давящая» боль у тревожного, мнительного, ранимого человека, склонного к ипохондрии) в рамках дифференцированного терапевтического подхода. Важна объективная оценка интенсивности болевых ощущений исходно и в процессе лечения, позволяющая контролировать эффективность терапии и выявлять необходимость ее ступенчатой коррекции. В своей ежедневной практике врачу важно помнить, что в случае хронических заболеваний именно боль определяет качество жизни пациентов, а искусство подбора безопасного и действенного анальгетика в каждой клинической ситуации и есть эталон врачебного мастерства.



