Вдревности на заре изучения хирургии Гиппократ указывал на то, что, если воспаление легких не разрешается в течение 14–18 дней, оно заканчивается формированием абсцесса. В 1930-е гг. абсцедирующие формы пневмонии были связаны с туберкулезом и стафилококком. История изучения тяжелых форм пневмоний принадлежит основоположнику детской хирургии С.Д. Терновскому, который в 1938 г. описал клинику гнойных плевритов у детей. В последующие годы (1970–1990) данная проблема разрабатывалась академиком Ю.Ф. Исаковым, профессорами В.И. Гераськиным, Э.А. Степановым (1978), С.Я. Долецким, Г.А. Баировым, Л.М. Рошалем [1–3].
Основные направления хирургии в этой области на протяжении последних десятилетий были сосредоточены на разработке методов видеоторакоскопии. Торакоскопические операции в 1970-е гг. были основаны на применении жестких эндоскопов без использования волоконного освещения и видеотехники. В последующие годы видеотехника торакосопических операций была усовершенствована [4–8]. Подробно была описана техника торакоскопии с использованием троакара диаметром 5 мм, которая позволяет определять дальнейшую тактику хирургического лечения больного. Точка для введения первого торакопорта – в области угла лопатки при отведенной вверх руке на уровне 4–5-го межреберья по заднеподмышечной линии. Инструментальный торакопорт диаметром 3 мм необходимо вводить под визуальным контролем. Детям раннего возраста санация плевральных полостей производится из двух доступов, что позволяет уменьшать операционную рану. При санации плевральных полостей проводится разъединение спаек, абсцесс дренируется. При гангренозной деструкции проводится удаление некротических масс с помощью мягких эндохирургических зажимов. В конце операции – промывание антисептическими растворами от 300 до 1000 мл. Операция заканчивается раздуванием легкого до его полного расправления [9].
При лечении деструктивной пневмонии всегда возникает вопрос о необходимости проведения повторных санаций плевры. В работе А.С. Кашина и соавт. (2009) были разработаны показания к повторным вмешательствам с оценкой состояния плевры, легочной ткани, внутриплеврального содержимого [9]. При оценке состояния париетальной (костальной) плевры принимается во внимание диффузное ее утолщение от 2 мм и более; при инструментальной пальпации имеет место деревянистая плотность. Визуально сосудистый рисунок не прослеживается, плевра серо-белесого цвета, при удалении фибрина возникает диффузная кровоточивость. Висцеральная плевра плотная, имеет плотные сращения с фибрином в виде шварт. При оценке состояния легочной ткани наблюдаются диффузные или локальные уплотнения, внутрилегочные абсцессы (исключение составляют субплевральные абсцессы без глубокого повреждения легочной ткани, участки гангренозно-некротизированной ткани). При оценке внутриплеврального содержимого возможно выявление плотного фибринозного слоя с множественными отграниченными полостями, содержащими гнойный выпот и фибрин на разных стадиях разной плотности; плотных фибринозных шварт в междолевых бороздах. Средняя продолжительность видеоторакоскопической санации плевральной полости при эмпиеме плевры у детей равна 64,4±15,3 минуты. Срок пребывания в реанимации – 1–2 дня, в постреанимационных отделениях – 32,2±2,46 дня [9]. Таким образом, на сегодняшний день хирургами предложены органосохраняющие методы эндоскопической хирургии.
Деструктивная пневмония на сегодняшний день относится к междисциплинарной проблеме, т.к. в ее лечении помимо хирургов принимают участие специалисты других медицинских профессий: педиатры, инфекционисты, пульмонологи. От тесного взаимодействия хирургов и педиатров во многом зависит исход заболевания. Не случайно на протяжении более 60 лет педиатрами также активно разрабатывается настоящая тема [10, 11]. Основные усилия педиатров были сосредоточены на изучении характера микрофлоры и выборе антибактериальной терапии, исследовании микроциркуляторного гемостаза, иммунной системы – для проведения иммунокоррекции, а также других методов лечения, например энзимотерапии.
Благодаря развитию антибиотикотерапии многие тяжелые формы внебольничной пневмонии в отсутствие показаний к оперативному вмешательству лечатся уже не в хирургических, а в педиатрических отделениях. Однако летальность от деструктивной пневмонии, по литературным данным, колеблется от 3 до 15%. По данным Морозовской детской городской клинической больницы, за последние годы количество деструктивных форм значительно увеличилось – с 2,6 (2010) до 14% (2014).
Для внебольничных пневмоний (ВП) существует следующая классификация.
В соответствии с МКБ-10 (1992) и Классификацией клинических форм бронхолегочных заболеваний у детей выделяют следующие формы пневмоний [12]:
- по этиологии: бактериальная, вирусная, грибковая, паразитарная, хламидийная, микоплазменная, смешанная (J12–J18);
- по морфологическим формам: очаговая, очагово-сливная, сегментарная, полисегментарная, лобарная (долевая), интерстициальная;
- по течению: острая (длительность до 6 недель), затяжная (длительность более 6 недель); хронический вариант течения пневмонии не включен в классификацию и не рассматривается;
- по тяжести: средней тяжести, тяжелая.
- по развившимся осложнениям: плевральные (плеврит), легочные (полостные образования, абсцесс), легочно-плевральные (пневмоторакс, пиопневмоторакс), инфекционно-токсические (бактериальный шок).
Как видно из данной классификации, деструктивной пневмонии в МКБ-10 нет. Однако она представлена в МКБ-10 в качестве различных осложнений.
Существует классификация деструктивной пневмонии, используемая в хирургической практике.
I. Внутрилегочные:
А. Абсцессы (дренирующиеся, недренирующиеся, гигантские («провисающие»).
Б. Буллы.
II. Прогрессирующая эмфизема средостения, которая может сочетаться с пневмотораксом и пиопневмотораксом.
III. Легочно-плевральные:
А. Эмпиема плевры:
• пиоторакс;
• пиопневмоторакс:
а) ненапряженный,
б) напряженный.
Абсцессы возникают на месте сливных или очагово-сливных инфильтратов в 1,5% случаев при деструктивной пневмонии. Эвакуация экссудата происходит через бронх (частично). При широком просвете последнего абсцесс практически полностью дренируется. При узком – эвакуация затруднена. Тяжело протекают «провисающие» абсцессы, особенно у детей первых месяцев жизни.
Буллы (полостные образования) возникают в период разрешения пневмонии и через 1–4 недели спонтанно исчезают. Реже может происходить нарастание пневмоторакса.
Пиопневмоторакс развивается на 7–15-й день заболевания в результате прорыва абсцесса или буллы в полость плевры. Известно, что летальные исходы при развитии деструктивной пневмонии связаны с развитием сепсиса, синдрома диссеминированного внутрисосудистого свертывания, легочной и сердечно-сосудистой недостаточности.
Сложность лечения детей с тяжелыми формами пневмоний объясняется многими проблемами и трудностями, возникающими на разных этапах маршрутизации больного, начиная с амбулаторного периода: недооценки тяжести состояния, позднего назначения антибактериальной и противовирусной терапии, несвоевременно проведенного рентгенологического обследования. На госпитальном этапе необходимо комплексное обследование, которое бы включало экспресс-методы диагностики (пневмококк, легионелла, вирусы респираторной и герпес-группы), серологию крови на внутриклеточные инфекции (хламидии и микоплазмы) и герпесвирусы, а также посевы на бактериальные возбудители (кровь, если выделяется мокрота – трахеальный аспират, плевральная жидкость). Зачастую в стационаре врачи традиционно ориентированы на результаты бактериологических посевов, недооценивая возможную другую этиологию – вирусную или совместное их течение. Отсутствие своевременной этиологической диагностики, неадекватно выбранное стартовое лечение, неправильная смена препаратов без учета основных возбудителей – все эти факторы определяют меру ответственности врача, в т.ч. и правовую, за неэффективное лечение ребенка. Уровень диагностических ошибок при тяжелых формах ВП достигает 40% [14].
С нашей точки зрения, этиология ВП и деструктивной пневмонии должна анализироваться и пересматриваться регулярно, т.к. наряду с хорошо известными возбудителями, колонизирующими верхние отделы дыхательных путей, немаловажную роль на сегодняшний день будут играть внутриклеточные возбудители, а также вирусы респираторной группы, герпесвирусы, формирующие смешанные формы.
В аналитическом обзоре Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека в 2013 г. были даны эпидемиологические диагностические критерии ВП [15]. К сожалению, к пневмониям часто относятся не как к инфекционным заболеваниям, вызываемым широким спектром возбудителей, а как к синдромному заболеванию без этиологической расшифровки.
Известно, что от своевременно поставленного этиологического диагноза нередко зависит течение заболевания и развитие осложнений. В МКБ-10 классификация пневмоний предусматривает этиологический принцип. Данные этиологии у разных авторов значительно варьируются: Streptococcus pneumonia (1,3–86,3%), Сhlamydophila pneumoniae (2,5–8,0%), Mycoplasma pneumonia (8–30%), Hаemophilus influenza (0,1–41,2%), Staphylococcus spp. (0–10,5%), Klebsiella pneumonia (0–10,3%), Pseudomonas aeruginosa (0–10,5%), грибы рода Candida (0–23,8%) [16–19].
До 2013 г. в РФ не существовало нормативных документов по эпидемиологическому надзору и контролю за ВП. В 2013 г. впервые были разработаны, утверждены и введены в действие главным санитарным врачом РФ Г.Г. Онищенко методические указания 3.1.2. 30047-12 «Эпидемиологический надзор за внебольничными пневмониями».
Современные классификации пневмонии предусматривают обязательное установление этиологии, пневмонии, которое производится на основании следующего перечня обследований [15]:
а) выделение гемокультуры микроорганизма;
б) выделение патогенного микроорганизма из пробы транстрахеального аспирата, бронхиального смыва или биоптата;
в) выделение вируса или обнаружение вирусного антигена в респираторном секрете;
г) диагностический однократный титр антител (IgM) или четырехкратное увеличение титра антител (IgG) к патогенному микроорганизму в парных пробах сывороток;
д) патогистологические признаки пневмонии.
Буквально в последние годы важным достижением в развитии и совершенствовании полимеразной цепной реакции (ПЦР) стала разработка технологии в реальном времени (Real-time PCR). Технология «ПЦР в реальном времени» имеет следующие преимущества: возможна количественная оценка возбудителя в анализируемом материале; сводится к нулю возможность контаминации продуктами ПЦР; возможно проведение мультиплексного анализа (в одной пробирке можно исследовать 5–6 специфических нуклеотидных последовательностей возбудителей пневмонии). Ответ может быть получен в течение 4 часов.
До настоящего времени сохраняется мнение о доминирующей роли S. pneumoniae, однако удельный вес его значительно колеблется. Деструктивные пневмонии, как правило, служат результатом взаимодействия нескольких возбудителей. Ассоциации возбудителей, описанные в литературе разными исследователями, могут быть самыми различными. В данных ассоциациях возбудители находятся в сложных взаимоотношениях (аддитивное, синергизм, антагонизм). Приводятся данные о цитопатогенетическом действии Mycoplasma pneumoniae на мерцательный эпителий слизистой бронхов и способность Chlamydia spp. блокировать двигательную активность ресничек респираторного тракта. Для микоплазмы мишенью служат клетки реснитчатого эпителия, что позволяет возбудителю атаковать респираторный тракт на всем протяжении – от носовых ходов до бронхиол. В опытах на добровольцах установлено, что для развития инфекционного процесса достаточно всего 10–100 бактерий (КОЕ) наиболее вирулентных штаммов микоплазм [20].
Респираторные вирусы (гриппов А, В, парагриппа, аденовирусы, респираторно-синтициальный вирус) являются своеобразными «проводниками» бактериальной инфекции.
К новым возбудителям ВП относятся корона-, метапневмовирус.
Герпетические пневмонии возникают вследствие распространения герпетического трахеобронхита на легочную паренхиму либо гематогенным путем. Летальность от герпетической пневмонии у пациентов с иммуносупрессивным состоянием высокая – более 80% [20]. Цитомегаловирусная пневмония может развиваться во внутриутробном периоде и далее – в первые 3 месяца жизни ребенка. Цитомегаловирусная пневмония возникает и в более старшем возрасте у иммуноослабленного контингента больных.
По данным А.С. Левиной и соавт. (2014), вирусные возбудители у детей с ВП определялись в 2/3 случаев у детей от 1 месяца до 4 лет, тогда как бактериальные агенты – у 36–41% детей. В данной работе из вирусов респираторной группы чаще выявлялся респираторно-синтициальный вирус, а из группы герпесвирусов – цитомегаловирус. У детей старше 4 лет наблюдалось уменьшение роли вирусов и возрастание роли бактериальных возбудителей. У 48% детей пневмония была вызвана атипичными возбудителями – хламидиями и микоплазмами [21]. В работе С.С. Ким и соавт. (2012) проведена диагностика смешанных инфекций методом ПЦР при ВП. За 2008–2011 гг. были исследованы фаринго-трахеальные аспираты у 56 детей в возрасте от 1 до 18 лет. Было установлено, что вирусные пневмонии характерны для детей раннего возраста.
Наиболее часто обнаруживались респираторно-синтициальные вирусы. В ассоциации выявлены вирусы в сочетании с пневмококком [22].
Относительно деструктивной пневмонии, по данным Европейского респираторного общества (ERS), у детей наиболее частой этиологической причиной эмпиемы плевры считается S. pneumoniae, чуть реже – M. pneumonia и S. aureus, в т.ч. метициллин-резистентный. Другие возбудители встречались реже: S. pyogenes, S. viridans, Pseudomonas aeruginosa и анаэробы. Только 50% случаев деструктивной пневмонии идентифицируются микробиологическими методами [23].
Таким образом, на сегодняшний день эффективность лечения детей с тяжелыми, в т.ч. деструктивными, формами пневмонии будет зависеть от слаженной работы специалистов – хирургов и педиатров, своевременной этиологической диагностики и правильно выбранного лечения. Существует ряд документов по лечению ВП, созданных как у нас в стране, так и за рубежом на основании доказательной медицины.
Принципы лечения ВП представлены в научно-практической программе «Внебольничная пневмония у детей: распространенность, диагностика, лечение, профилактика», напечатанной в 2010 г., затем практически ежегодно пересматривается и дополняется [24], а также в Стандарте специализированной медицинской помощи при пневмонии тяжелой степени тяжести с осложнениями (приказ МЗ РФ № 741 от 09.11.2012), в Протоколе лечения внебольничной пневмонии у детей (протокол МЗ РФ от 25.12.2012). Лечение ВП включает выбор антибиотика, противовирусного препарата, муколитиков, откашливающих, обезболивающих, симптоматических средств и т.д. Однако в отношении деструктивной пневмонии необходим принцип индивидуальной этиопатогенетической терапии.
Антибактериальная терапия занимает ведущую роль в лечении тяжелых форм пневмоний. В связи с этим в отношении детей применяются «защищенные» аминопенициллины, цефалоспорины III–IV поколений, карбапенемы, макролиды, линезолиды, противогрибковые препараты. Рекомендуется комбинация антибиотиков, особенно если лечение было начато амбулаторно (например, в качестве стартовой терапии цефалоспорин III поколения+кларитромицин). Из всей группы макролидов для лечения пневмоний было рекомендовано всего два: азитромицин и кларитромицин, и этому обстоятельству есть свое объяснение. Макролиды в основном оказывают бактериостатическое действие и преимущественно активны в отношении грамположительных, ряда грамотрицательных и внутриклеточных возбудителей. Высокую чувствительность к макролидам проявляют стрептококки, пневмококки, стафилококки, гонококки, хламидии, микоплазмы, легионеллы. Умеренной чувствительностью обладают макролиды в отношении Helicobacter pylori, боррелий, микобактерии (не всех видов), токсоплазм, анаэробов, гемофильной палочки. Устойчивы к ним метициллин-резистентные штаммы стафилококков, Enterococcus faecium, грамотрицательные микроорганизмы семейства Enterobacteriaceae, Pseudomonas aeruginosa, Acinetobacter, Mycobacterium tиberculosis. Кларитромицин выгодно отличается от других макролидов.
Нами было проведено исследование по лечению пневмоний микоплазменной этиологии в период эпидемического подъема данной инфекции в 2012–2013 гг. Результат лечения зависел от схемы назначения антибиотиков и был лучше у детей при назначении цефалоспорина III поколения одновременно с макролидом [25].
Известно, что кларитромицин представляет собой метилированное производное эритромицина. Данная химическая структура позволила кларитромицину быть наиболее устойчивым макролидом к гидролизу в кислой среде, снизить нежелательные осложнения со стороны желудочно-кишечного тракта и сделало его не зависимым от приема пищи [26]. Кларитромицин рекомендован специалистами в качестве препарата первого выбора при лечении острого среднего отита, синусита, бронхитов, ВП, поскольку хорошо проникает в очаги воспаления [27]. Кларитромицин в форме суспензии не менее безопасен и эффективен, чем амоксициллин при лечении заболеваний нижних дыхательных путей [28].
В отделениях реанимации цефалоспориновые антибиотики III–IV поколений или карбапенемы назначают одновременно с макродидами (перорально или также внутривенно). Возможен «ступенчатый» подход к назначению антибиотиков: 2–3 дня парентерально, затем переход аналогичного препарата на пероральный прием [29].
Оценка эффективности лечения проводится через 48 часов, и в случае отсутствия положительного эффекта рекомендуется замена антибиотика или присоединение другого. Продолжительность лечения ВП составляет 7–10 дней, тяжелые формы пневмонии требуют более продолжительного курса лечения (более 14 дней) [29]. Критерием отмены антибиотика служит регресс клинических симптомов, при этом сохранение отдельных лабораторных и рентгенологических изменений не является основанием к продолжению антибактериальной терапии [30].
В качестве примера своевременной диагностики, выбора тактики индивидуализированной этиопатогенетической терапии приводим историю болезни ребенка 6 лет, поступившего в Морозовскую детскую городскую клиническую больницу (МДКБ) 30.12.2013 (выписан 14.01.2014) с основным клиническим диагнозом: левосторонняя деструктивная пневмония. Осложнения: пиофибриноторакс слева. Пневмоторакс. Состояние после плеврального дренирования. Сопутствующий диагноз: ожирение, мочекаменная болезнь, дисметаболическая нефропатия.
Ребенок был доставлен в отделение реанимации и интенсивной терапии (ОРИТ) МДГКБ бригадой «скорой» помощи на спонтанном дыхании с инфузией 10%-ной глюкозы через периферическую вену. Из анамнеза жизни известно, что ребенок от 3-й беременности, протекавшей физиологически, роды срочные, оперативные, оценка по Апгар – 9/9, масса – 4110 г, длина – 54 см. Привит по графику. Ребенок относится к группе часто болеющих детей, 6 раз переносил пневмонию. Мочекаменная болезнь – наследственная форма.
Из анамнеза заболевания: болен с 9.12.2013, поставлен диагноз «острая респираторная вирусная инфекция» (получал симптоматическую терапию, Гексорал). Через 5 дней (13.12.2013) отмечена отрицательная динамика, высокая лихорадка, появились жалобы на боли в левом боку, на рентгенограмме – картина левосторонней пневмонии. Был госпитализирован в Нарофоминскую районную больницу № 1, где назначена антибактериальная терапия, на фоне которой через 3 суток отмечена положительная динамика (стал более активным, появился аппетит), но продолжал лихорадить. К терапии добавлен амикацин, метронидазол, проведена компьютерная томография (КТ), произведена плевральная пункция (получено 20 мл мутной жидкости, состоящей на 84% из нейтрофилов). Улучшения состояния не наблюдалось, лихорадка достигла до 39°С. Дренаж в левую плевральную полость был установлен 20.12.2013. В связи с отсутствием положительного результата лечения ребенок переведен в отделение реанимации МБГКБ.
При поступлении 20.12.2013: состояние тяжелое, вялый, капризен, кожа бледная, одышка до 36 в минуту. Аускультативно в легких дыхание проводится во все отделы, слева ослаблено, там же притупление перкуторного звука. Тоны сердца приглушены, ритмичны. Перистальтика сохранена, явлений дизурии, диспепсии нет. В общем анализе крови лейкоцитоз 13,5×109/л тыс. со сдвигом лейкоцитарной формулы «влево», анемия легкой степени тяжести.
В биохимическом анализе крови выраженных изменений показателей выявлено не было, антистрептолизин-О (взят трижды в течение заболевания) не превышал нормальных значений. Прокальцитониновый тест отрицательный. Умеренно выражена гиперфибриногенемия (5,55 г/л).
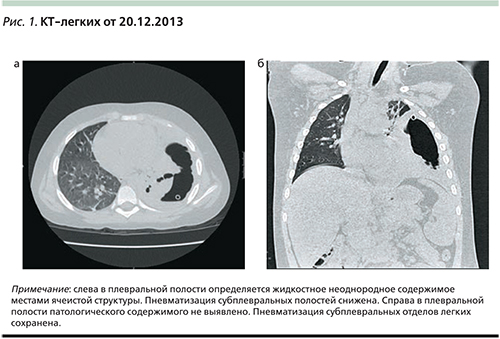
В срочном порядке проведено ультразвуковое исследование плевральных полостей, при котором слева определено жидкостное неоднородное содержимое, местами ячеистой структуры. На КТ-легких отмечается смещение трахеи и органов средостения вправо, левое легкое поджато (пневмоторакс?), дренажная трубка визуализируется в проекции воздушной полости. Выполнено подтягивание дренажа, получено до 400 мл воздуха без конца и около 30 мл гнойно-геморрагического отделяемого. Дренаж функционирует удовлетворительно, подключена активная аспирация, по дренажу сброс воздуха. Начата инфузионная терапия с назначением Меронема, метронидазола, в связи с гипоальбуминемией начато введение альбумина.
При поступлении в тот же день показана санация плевральной полости с учетом течения процесса, в связи с чем была выполнена срочная видеоторакоскопия. При торакоскопии установлен троакар 5 мм в V межреберье по среднеподмышечной линии. В плевральной полости отмечен выраженный воспалительный процесс с массивным наложением фибрина. Из левой плевральной полости взят посев. Выполнен адгезиолизис левого легкого. При разделении спаек у верхушки левого легкого в области стояния дренажа выявлено краевое ранение легкого с поддуванием воздуха и незначительным кровотечением. Старый дренаж удален. Ранение легкого не требовало ушивания. Фибрин удален частично отсосом и диссекторами. Общий объем промывной жидкости составил 300 мл теплого физраствора с диоксидином, объем выпота из плевральной полости и фибрина составил около 200 мл.
По совокупности клинических, а также данных КТ-легких (рис. 1а, б), торакоскопии 21.12.2013 был установлен диагноз тяжелой левосторонней деструктивной пневмонии с плевральными осложнениями. На совместном консилиуме были приняты во внимание результаты серологических анализов крови – микоплазменная инфекция (IgM 0,8 EД/мл отрицательно, IgG – 37,6 ЕД/мл положительно [0–22]) и обострение герпетической (ВПГ 1 – IgM – 1,7 EД/мл положительно (0,0–1,1), IgG – 138,2 EД/мл положительно (0–22), к терапии добавлен Клацид в/в из расчета 15 мг/кг/сут в два приема, ацикловир 0,4 г×3 раза в сутки, Вобэнзим. Через 7 дней ребенок был переведен на пероральный прием Клацида (всего 14 дней). Поскольку пневмония развилась у ребенка в шестой раз, было высказано предположение о вторичном иммунодефиците и проведении иммунокоррекции, назначенной в виде Имунорикса на 2 последующих месяца. На фоне скорригированной терапии (Меронем, Клацид, метронидазол, флуконазол в/в) на 9-е сутки пребывания в ОРИТ была отмечена положительная динамика в виде снижения интенсивности затемнения в левом легочном поле, ребенка перевели из ОРИТ в боксированно-хирургическое отделение 05.01.2014, была проведена замена карбопенема на Инванз. Дренаж был перекрыт через 9 дней, отменены внутривенные инфузии. В левом легком сохранялись массивные плевральные наложения в нижних отделах слева за счет воспалительной инфильтрации. Ребенок был выписан 14.01.2014 под наблюдение педиатра и пульмонолога по месту жительства с рекомендацией контроля серологических анализов и КТ-легких.
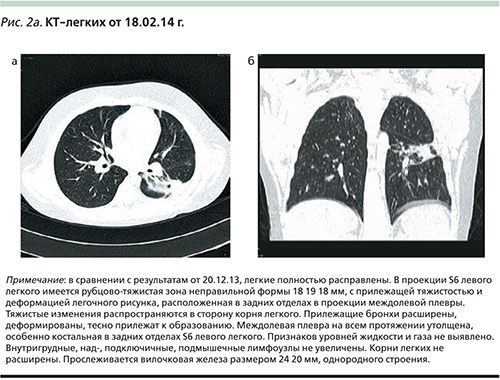
Полученные результаты КТ-легких от 18.02.2014 (рис. 2а, б) можно оценить как состояние после перенесенной деструктивной пневмонии.
В течение года ребенок находился под нашим наблюдением, проводился контроль серологических анализов крови на герпес и микоплазму (до полного излечения и получения отрицательных результатов). По функции внешнего дыхания после выписки из стационара от 24.11.2014 и в дальнейшем в динамике были выявлены явления обструкции, снижение жизненной емкости легких. В результате на медкомиссии была установлена бронхиальная астма и инвалидность.
Деструктивные пневмонии у детей относятся к междисциплинарной проблеме, успех лечения которых зависит от слаженной работы команды хирургов, педиатров и врачей других специальностей. Для диагностики деструктивной пневмонии наряду с хорошо известными традиционными лабораторными и рентгенологическими методами исследования должны быть включены ультразвуковое исследование плевральных полостей, КТ-легких, микробиологическое и серологическое исследование крови, посевы и ПЦР-диагностика – пневмопанель (плевральной жидкости, мочи, слюны), включение экспесс-методов, латекс-тестов. Огромную роль для положительного исхода заболевания будет иметь индивидуальная этиопатогенетическая терапия, проведенная с учетом выделенных основных патогенов, назначенная в ранние сроки заболевания, что позволит избежать тяжелых осложнений. После выписки из стационара в зависимости от особенностей течения деструктивной пневмонии следует период амбулаторного наблюдения, а также профилактики возможных осложнений.



