Введение
Основной целью лечения сахарного диабета (СД) является достижение удовлетворительного контроля гликемии с целью снижения риска его поздних осложнений. Интенсивная инсулинотерапия хорошо зарекомендовала себя как оптимальный способ улучшения гликемического контроля. Базис-болюсная инсулинотерапия наиболее точно воспроизводит физиологический инсулиновый ответ и позволяет достигать и поддерживать состояние, наиболее близкое к нормогликемии. В свою очередь крупное длительное популяционное Исследование по Контролю Диабета и его Осложнений (Diabetes Control and Complications Trial, DCCT) подтвердило, что интенсивная терапия может снижать распространенность поздних осложнений СД и замедлять прогрессирование уже имеющихся осложнений у пациентов с СД 1 типа [1]. DCCT также показало, что постпрандиальная гипергликемия является независимым фактором риска развития неблагоприятных микрососудистых осложнений СД [2].
Инсулин аспарт (ИАсп) (НовоРапид, Ново Нордиск, Дания) – аналог человеческого инсулина ультра-короткого действия, позволяет достигать более эффективного, чем человеческий инсулин (ЧИ), контроля постпрандиальной гликемии. В молекуле ИАсп аминокислота пролин в положении B28 заменена на аспарагиновую кислоту. Это приводит к уменьшению самоассоциации молекул инсулина, и, следовательно, к более быстрому всасыванию препарата после подкожного введения, а также меньшей, чем ЧИ, продолжительности действия [3]. Такой способ действия позволяет наиболее эффективно снижать прирост глюкозы крови (ГК) непосредственно после еды, а также уменьшает риск развития гипогликемии между приемами пищи по сравнению с ЧИ [4]. Эффективность применения ИАсп при СД доказана многочисленными исследованиями у разных категорий пациентов: взрослых, детей (с 2 лет), подростков, беременных женщин, пожилых людей и лиц с нарушениями функции печени и почек. Ни одно из крупных исследований ИАсп не выявило проблем с безопасностью этого препарата [5–7]. Однако большинство клинических исследований имеет относительно небольшую продолжительность наблюдения, следовательно, не позволяют оценить устойчивость достигнутого гликемического контроля и безопасность инсулинотерапии в долгосрочной перспективе.
Результаты исходного 12-недельного сравнительного исследования ИАсп и ЧИ в комбинации с инсулином НПХ в базис-болюсной терапии пациентов с СД 1 типа показали, что терапия ИАсп сопровождалась значительным улучшением гликемического контроля без увеличения частоты гипогликемий [8]. Целью данного дополнительного (пролонгированного) исследования была оценка безопасности и эффективности длительного применения ИАсп в базис-болюсном режиме у пациентов с СД 1 типа.
Дизайн исследования
Исходное исследование (исследование 1) было рандомизированным 64-недельным сравнительным изучением эффективности и безопасности оптимизации дозы прандиального ИАсп и ЧИ при использовании с инсулином НПХ в качестве базального компонента [8]. Дополнительное пролонгированное исследование было открытым многоцентровым многонациональным исследованием, в котором приняли участие 12 центров: Слове-ния – 1, Израиль – 1, Хорватия – 2, Чехия – 2, Россия – 6. Максимальная продолжительность этой фазы исследования составила 2,5 года.
В исходном исследовании в течение минимум 2 лет приняли участие 423 взрослых пациента с СД 1 типа в возрасте 18–65 лет; в пролонгированном – 72 пациента.

Последний визит в исходном исследовании был первым визитом пролонгированного исследования. Пациенты продолжали принимать терапию, назначенную им во время исходного исследования. ИАсп вводили за 0–5 минут до завтрака, обеда и ужина. Дополнительно пациенты применяли инсулин НПХ во время завтрака, обеда, ужина или перед сном, но не реже 1 раза в день. ИАсп рекомендовалось вводить подкожно непосредственно перед приемом пищи.
Во время исходного исследования оптимизация доз болюсного и базального инсулинов проводилась с использованием алгоритма титрации по уровню ГК с учетом времени приема пищи до достижения уровня препрандиальной гликемии 5–7 ммоль/л и постпрандиальной гликемии < 9,0 ммоль/л [8].
В пролонгированном исследовании пациенты продолжали применять ранее используемый режим терапии, имея возможность проводить коррекцию доз инсулина для улучшения гликемического контроля.
Первичными конечными точками безопасности была частота гипогликемии и неблагоприятных явлений. Вторичные конечные точки безопасности включали индекс массы тела (ИМТ), артериальное давление (АД). АД и масса тела измерялись на каждом визите.
Пациенты регистрировали в дневниках эпизоды гипогликемии с указанием даты и времени эпизода, типа инсулина, времени последней инъекции, времени последнего приема пищи и значения ГК (при наличии). Тяжелым эпизодом гипогликемии считалось состояние, при которой пациент был не в состоянии самостоятельно оказать себе помощь, а также при уровне ГК < 2,8 ммоль/л или в случае, если для купирования симптомов гипогликемии потребовалось введение глюкагона или глюкозы (в/в). Легкий эпизод гипогликемии определен как симптоматический или бессимптомный при уровне ГК < 2,8 ммоль/л, купированный пациентом самостоятельно. Симптоматической гипогликемией считали эпизод, не подтвержденный данными измерения уровня ГК.
Конечными точками эффективности были уровень HbA1c, а также профиль ГК в девяти точках, измеренный пациентом самостоятельно до и через 90 минут после трех основных приемов пищи, перед сном, в 2 часа ночи и перед завтраком на следующий день. Рассчитывали среднее значение профиля ГК, средний уровень ГК в каждой точке, колебания уровня ГК в девяти точках суточного профиля от минимального до максимального (с указанием экскурсии глюкозы в течение дня), средний прандиальный прирост ГК (увеличение уровня ГК от пре- до постпрандиального) для трех основных приемов пищи.
Анализ конечных точек эффективности и безопасности проведен с использованием непараметрических статистических тестов. Все данные анализировались с помощью статистического пакета SAS® (версия 8.01).
Результаты
Характеристики пациентов в начале пролонгированного исследования представлены в табл. 1. Из 72 участников, включенных в исследование, в общей сложности 65 (90 %) завершили исследование. Семь участников были выведены из исследования: одна пациентка – из-за планируемой беременности, один пациент отказался продолжать участие и пять – предпочли перейти на инсулиновую помпу. Более половины пациентов продолжали терапию ИАсп в течение 100–200 недель (1,9–3,8 года), а 19 % принимали этот инсулин более 200 недель (более 3,8 года).
На протяжении всего дополнительного исследования средние суточные дозы инсулина оставались без изменений. Для ИАсп средняя суточная доза (СО) составила 0,41 (0,17) ЕД/кг в начале пролонгированного исследования и 0,39 (0,16) ЕД/кг – в конце исследования. Доза инсулина НПХ составила 0,38 (0,14) и 0,38 (0,13) ЕД/кг соответственно.
Во время пролонгированного исследования всего один пациент перенес тяжелую гипогликемию; соответственно, частота эпизодов тяжелой гипогликемии составила 0,1 эпизода/год. В общей сложности 74 % пациентов перенесли минимум один эпизод легкой гипогликемии, что соответствует 15,9 эпизода легкой гипогликемии/год. В исходном исследовании частота тяжелых и легких гипогликемий составила 0,2 и 22,4 эпизода/год, соответственно (табл. 2).
Всего было зарегистрировано 132 нежелательных явления у 41(57 %) участника исследования, из которых шесть были серьезными (синусит, боли в спине, гепатит, новообразование, неизвестная инфекция, гипогликемия). Из них только один случай расценен как, возможно, имеющий связь с исследуемым препаратом и один случай (гипогликемия) – как, вероятно, связанный с исследуемым препаратом. При этом ни один участник не выбыл из исследования из-за развития нежелательных явлений.
На протяжении всего пролонгированного исследования ИМТ, а также систолическое и диастолическое АД не изменялись (средние значения в начале и в конце дополнительного исследования составили: ИМТ – 24,3 и 24,5 кг/м2; систолическое АД – 120,3 и 123,3 мм рт. ст., диастолическое АД – 74,3 и 75,4 мм рт. ст. соответственно). У пяти пациентов во время пролонгированного исследования были выявлены клинически значимые отклонения биохимических и гематологических показателей, связанные с развитием нежелательных явлений, которые полностью прошли (2 пациента) или стабилизировались (3 больных) самостоятельно и не требовали коррекции терапии.
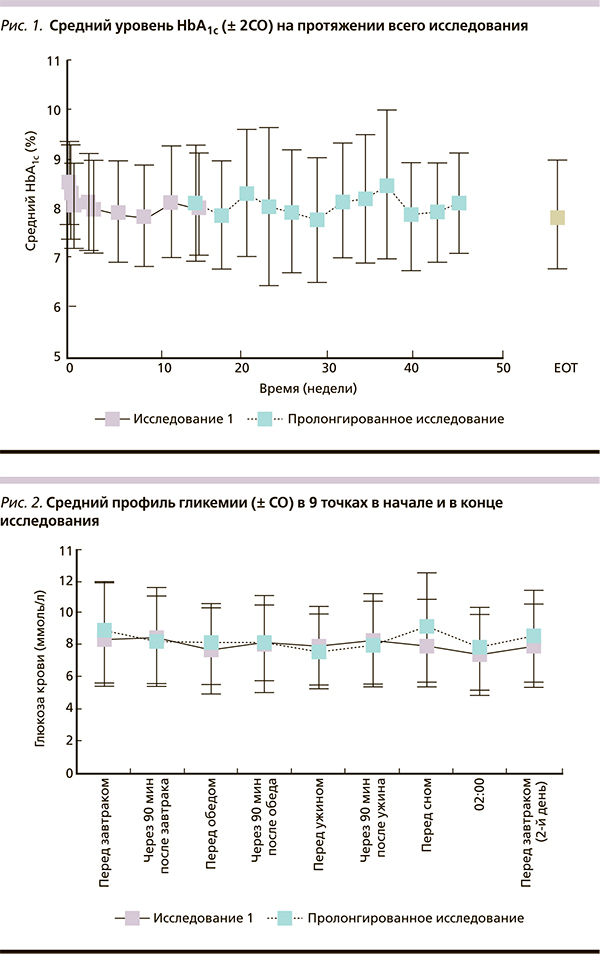
На протяжении всего исследования отмечалось улучшение гликемического контроля, что проявлялось дальнейшим снижением уровня HbA1c в период продления исследования (с 8,11 до 7,87 %) [рис. 1].
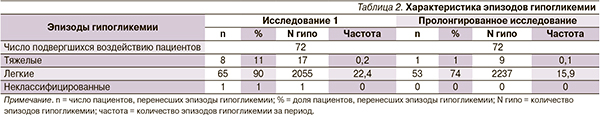
Суточный профиль ГК и средний уровень ГК (СО) во время пролонгированной стадии не изменились (8,09 [1,67] и 8,10 [1,52] ммоль/л соответственно). Средний прандиальный прирост гликемии снизился с 0,30 (2,16) до 0,19 (1,81) ммоль/л. Диапазон колебаний ГК (рассчитанный по профилю в 9 точках) также снизился с 6,85 (3,0) до 5,91 (2,97) ммоль/л. Средний профиль ГК в 9 точках в начале и в конце пролонгированного исследования представлен на рис. 2.
Обсуждение
Данное пролонгированное исследование проведено для оценки профиля безопасности ИАсп при длительном применении у 72 пациентов с СД 1 типа. Дополнительной целью была оценка возможности улучшения или поддержания на протяжении длительного времени параметров гликемии, достигнутых за 12 недель исходного исследования [8]. Весь период наблюдения составил 3,8 года, а у некоторых пациентов даже более. Такое длительное применение ИАсп является достаточным для оценки результатов.
Частота легких и тяжелых гипогликемий, а также доля пациентов, перенесших легкие и тяжелые эпизоды гипогликемии, во время пролонгированного исследования были меньше, чем во время исходного исследования. Доля пациентов, перенесших тяжелую гипогликемию, снизилась с 11 % (в исследовании 1) до 1 % в пролонгированном исследовании. Предыдущие сравнительные исследования ИАсп и ЧИ также выявили снижение частоты тяжелой гипогликемии на фоне применения ИАсп до 0,91 по сравнению с 1,13 эпизода/год на ЧИ [7], и 0,85 по сравнению с 1,12 эпизода/год [9] соответственно. У большинства пациентов изменений лабораторных показателей не наблюдалось. Всего было зарегистрировано шесть серьезных неблагоприятных явлений, но все они, за исключением одного, были расценены как не имеющие никакого отношения к применяемым препаратам. Данная работа подтверждает долгосрочную безопасность базис-болюсной терапии ИАсп (в качестве прандиального инсулина) у пациентов с СД 1 типа.
Улучшение гликемического контроля в отношении HbA1c, среднего уровня ГК, суточных колебаний ГК, а также среднего прандиального прироста ГК, достигнутое в исследовании 1, сохранялось на протяжении всего пролонгированного исследования.
В конце исследования уровень HbA1c составил 7,87 ± 1,09 % и был сопоставим с уровнем HbA1c (7,78 ± 0,03 %), достигнутым через год терапии ИАсп (Raskin et al.) [7].
Очень важно, что при длительном применении эффективность ИАсп полностью сохраняется без снижения уровня безопасности. Вероятность дневной и ночной гиперинсулинемии уменьшается, а следовательно, уменьшается и риск развития гипогликемии. В сравнительных исследованиях ИАсп и ЧИ было показано улучшение контроля прандиальной гликемии и гликемического контроля в целом (HbA1c), а также сокращение частоты эпизодов гипогликемии [5, 7–9] при использовании ИАсп. При этом результаты одного из исследований также показали, что терапия ИАсп сопровождается снижением относительного риска развития ночной гипогликемии на 72 % по сравнению с ЧИ [9].
Заключение
Длительная базис-болюсная терапия инсулином аспарт (с инсулином НПХ) пациентов с СД 1 типа отличается хорошей переносимостью и имеет стойкую эффективность и безопасность.



