Введение
В настоящее время можно считать общепризнанной позицию о предпочтительности длительных курсов антидепрессивной терапии. Традиционная схема подразумевает этапность применения антидепрессантов (АДП): 8–12 недель активного лечения с последующим переходом к поддерживающей терапии длительностью 3–9 месяцев, за которой следует продолжительный этап профилактической терапии. На всех этих этапах может возникать необходимость комбинирования АДП с другими психо- и соматотропными препаратами. Применение комбинированных схем лечения требует от врача тщательного подхода к выбору АДП с точки зрения эффективности, переносимости и безопасности с учетом возможности нежелательного лекарственного взаимодействия. Понимание этого особенно важно, поскольку в настоящее время примерно 30 % пациентов прекращают терапию через месяц после ее начала, а еще 15 % – в течение последующих 3 месяцев [18, 27, 32]. Часто возникающая необходимость изменения терапии предъявляет свои требования к выбору препарата и тактики смены лечения.
С начала 1990-х гг. в качестве АДП “первой линии”, назначаемых при первичном обращении пациента, начинают использоваться препараты группы селективных ингибиторов обратного захвата серотонина (СИОЗС), постепенно заменившие в этом качестве трициклические антидепрессанты (ТЦА). Основные преимущества СИОЗС (лучшая по сравнению с ТЦА переносимость при существенно меньшей выраженности побочных эффектов, независимость терапевтического эффекта от дозы) обусловили их широкое распространение при проведении антидепрессивной терапии как в условиях стационара, так и (в значительно большей степени) при амбулаторном назначении. К 2000 г. доля назначений СИОЗС стабилизируется на уровне примерно 70 % [29].
Первоначальный выбор препарата
Выбор АДП может быть обоснован следующими обстоятельствами: постановка диагноза с учетом особенностей клиники (выраженность, коморбидные состояния) и динамики заболевания; исключение сопутствующих серьезных психических расстройств (шизофрения, злоупотребление психоактивных веществами, органическая патология); определение профиля соматической отягощенности.
Важную роль в построении основанных на комплаенсе отношений с пациентом играют его предупреждение о возможных побочных эффектах, равно как и регулярный мониторинг переносимости препарата в первое время после его назначения. В отдельных случаях целесообразно назначение АДП в дозе, более низкой, чем терапевтическая, на первые дни приема с последующим ее увеличением до минимально эффективной. По прошествии четырех недель терапии выносится заключение о ее эффективностии необходимости в противном случае смены препарата.
До настоящего времени эталонными средствами на интенсивном этапе терапии являются ТЦА (амитриптилин, имипрамин, кломипрамин). Уровень лекарственного ответа при их назначении в течение 3–4 недель терапии достигает 55–70 % [2]. Эффективность АДП других групп, оцененная в сравнительных исследованиях, лишь приближается к таковой ТЦА и практически никогда не превосходит их. Несмотря на это, существует ряд ограничений, мешающих использованию ТЦА в течение длительного времени. Среди них стоит упомянуть поведенческую токсичность, опасность при передозировке, нежелательность использования у соматически отягощенных пациентов (например, с сердечно-сосудистой патологией), особенно пожилого возраста.
Сохраняются следующие показания к назначению ТЦА: необходимость использования инъекционных форм препаратов, положительный ответ на терапию препаратами этой группы в предыдущих случаях при хорошей их переносимости. Они также предпочтительны, когда свойственный им седативный эффект является приемлемым или желательным, а также в случаях, когда возникает необходимость повышения дозы при сохраняющейся переносимости.
Несмотря на то что оцененная активность большинства современных АДП считается достаточной для широкого спектра нарушений – от психотических депрессий до пограничных аффективных и тревожных расстройств невротического уровня [5, 20], исследования показывают, что в число нонреспондеров, нуждающихся в смене первично назначенной АДП-терапии, по разным данным, попадает от 20 до 45 % пациентов [10]. При этом вероятность положительного ответа после смены терапии снижается до 20 % [23]. Тактика врачей в этих случаях бывает различной и нередко в большей степени определяется неформализованными и базирующимися на относительно небольших выборках больных собственным опытом или мнением коллег, чем доказательными данными клинических исследований. Так, интервьюирование 432 практических психиатров показало, что в случае отсутствия терапевтического эффекта большинство из них предпочитают сменить первоначально назначенный СИОЗС на препарат другого класса, при недостаточной выраженности ответа на терапию – увеличить дозу СИОЗС (несмотря на отсутствие линейной зависимости терапевтического эффекта от дозы для этих АДП), а при непереносимости – чаще всего заменить один СИОЗС на другой [13].
Сравнительная эффективность различных АДП
Очевидно, что эффективность средств, необходимость использования которых может возникать “на второй линии терапии”, должна как минимум не уступать эффективности первоначального АДП. В свете этого представляет интерес дискуссия о сравнении новых препаратов “двойного” действия СИОЗСН (селективных ингибиторов обратного захвата серотонина и норадреналина) с “моновалентными” антидепрессантами (СИОЗС). Сразу отметим, что предположение, будто поливалентность АДП в отношении различных систем нейротрансмиссии напрямую определяет выраженность его терапевтического действия, до настоящего времени не нашло полного подтверждения. Первоначально предполагалось, что двойной эффект препарата позволяет добиваться быстрого наступления более выраженного клинического эффекта либо преодолевать лекарственную резистентность, возникшую при первичном назначении СИОЗС. Исходно моделью препарата “двойного действия”, для которого потенциал блокады обратного захвата серотонина был сравним с таковым для норадреналина, служил кломипрамин, позднее – препараты более селективного действия: венлафаксин и дулоксетин. Систематические исследования, проведенные на различных выборках пациентов с использованием различных методик, дают достаточно противоречивые результаты. С целью обобщения этих данных предпринимаются работы, предлагающие суммарную оценку всей совокупности данных клинических исследований при помощи мета-аналитического подхода. Примером такой работы является мета-регрессионный анализ, осуществленный Freemantle N. и соавт. (2000), который подвел итог более чем 100 клинических исследований. Согласно оценке автора, статистически значимых различий в эффективности основных представителей большинства классов АДП (ТЦА, СИОЗС, селективные АДП “двойного действия”) не выявлено. В то же время в некоторых других работах, как правило, подводящих итоги сравнительных исследований конкретных представителей различных классов АДП, могут приводиться и иные данные, свидетельствующие о более выраженном тимолептическом действии препаратов “двойного действия” [28].
Сравнение СИОЗС с ТЦА
Мета-анализ исследований, сравнивающих эффективность циталопрама и ТЦА, таких как амитриптилин, кломипрамин и имипрамин, показал, что выявляемые различия в скорости и выраженности наступления терапевтического эффекта не являются статистически значимыми (p = 0,83). Несмотря на то что выраженность терапевтического эффекта при приеме ТЦА первоначально несколько выше, примерно к 10–14-му дню терапии это различие полностью нивелируется. Во всех сравнительных исследованиях частота и выраженность побочных эффектов, нередко являющихся причиной отмены проводимой терапии, при приеме ТЦА в 2–5 раз превосходили аналогичные показатели для таких СИОЗС, как циталопрам: сухость во рту (34 и 7 % соответственно), седация (16 и 8 % соответственно). С увеличением возраста пациентов этот разрыв в частоте побочных эффектов имеет тенденцию к существенному увеличению [3, 16].
Определение эффективной дозы препарата
В качестве одной из особенностей СИОЗС в сравнении с ТЦА нередко называется необходимость применения препарата в фиксированной дозе (20–40 мг/сут для флуокосетина, 50– 100 мг/сут для сертралина, 20–40 мг/сут для циталопрама). Необходимость ееповышения обычно возникает лишь у пациентов с затяжными или хроническими тревожными расстройствами (генерализованный подтип социальной фобии или генерализованное тревожное расстройство). Аффективные симптомы в меньшей мере отвечают на увеличение дозы. Таким образом, дальнейшее наращивание дозы препарата обычно не приводит к изменению доли пациентов-респондеров, увеличивая, однако, количество клинически значимых нежелательных явлений.
В этих условиях важно определение минимально эффективной дозы препарата, поскольку выход за ее пределы может отрицательно сказаться на результатах терапии. Эта величина может быть определена одним из двух способов: а) оценкой динамики изменения клинических симптомов и б) учетом пациентов, досрочно выбывающих из курса терапии в связи с ее неэффективностью. Сравнение оценок эффективности, полученных этими способами, у одних и тех же пациентов может продемонстрировать определенные расхождения.
Так, при сравнительной оценке эффективности циталопрама в дозах 10, 20, 40 и 60 мг/сут, назначаемого для лечения депрессивного эпизода в течение 6 недель, было показано, что в любой из указанных дозировок эффективность препарата в отношении клинических симптомов (оцененная посредством шкал HAMD и MADRS) достоверно превосходила таковую плацебо (p < 0,05). При этом показатели для четырех групп больных, получавших циталопрам в разных дозах, между собой различались незначительно. В то же время показатели досрочной выбываемости пациентов, получавших 10 мг циталопрама в сутки, из-за недостаточности терапевтического эффекта были ближе к таковым для пациентов, получавших плацебо (7 и 9 % соответственно), чем в случаях более высоких дозировок (2, 2 и 3 % для 20, 40 и 60 мг/сут соответственно) [11]. Таким образом, только сопоставление различных методик оценки позволяет с достаточной точностью определить оптимальную клинически эффективную дозу препарата.
Терапевтический эффект в период активной терапии
В ряде исследований установлено, что оптимальный эффект при назначении циталопрама в качестве препарата краткосрочной терапии (4–6 недель) достигается уже при его назначении в дозе 20 мг в сутки, при этом дальнейшее ее увеличение до 40–80 мг в сутки обычно не оказывает существенного влияния на клиническое улучшение [22].
Эффективность различных дозировок при последующем длительном приеме
В дозировке 20–40 мг/сут циталопрам является эффективным средством длительной терапии, направленной на предотвращение ухудшения или профилактику рецидива. Плацебо-контролируемые исследования показали, что при профилактической терапии в течение 24 недель доля рецидивов находится на уровне 0,1 при приеме циталопрама в сравнении 0,3 в контрольной группе [21, 25]. Продление сроков поддерживающей терапии до 1,5 лет увеличивает это различие между группами больных: 0,2 – у пациентов, принимающих циталопрам, и 0,5 – в группе плацебо [33].
Длительная поддерживающая и противорецидивная терапия АДП
Как показывают данные катамнеза, большинство первичных обращений по поводу аффективных нарушений оказываются лишь “начальным звеном” в цепи рецидивирующих аффективных эпизодов или отправной точкой для последующего континуального течения. Это справедливо и в отношении течения тревожных расстройств.
По разным данным, у 37–50 % пациентов с первичными эпизодами после года ремиссии развиваются повторные обострения. В течение последующих 2 лет этот показатель возрастает до 80 % [12]. У более молодых пациентов большинство повторных ухудшений приходится на первые полгода, у больных старшей возрастной группы – на вторые [4, 19]. С учетом нередкого выбывания пациентов на всех этапах терапии из-за ряда причин (формирование лекарственной резистентности, нежелание или невозможность продолжать прием терапии после завершения активного этапа лечения и др.) итоговая доля пациентов, у которых удается достигнуть стабильной ремиссии, может оказаться весьма незначительной – менее 20 % (рис. 1).

Суммирование данных сравнительных исследований эффективности продолжительной поддерживающей терапии показывает, что применение АДП снижает риск рецидива примерно в 2 раза: с 50 до 20–25 % [24]. На этом основаны современные рекомендации о необходимости проведения профилактической терапии в течение минимум полугода после наступления ремиссии даже у первичных пациентов. При наличии в анамнезе более 3 предшествующих рецидивов за последние 5 или более лет 5 эпизодов в целом длительность рекомендуемых сроков проведения профилактической терапии возрастает до 5 и более лет [2].
Выбор препарата для длительной терапии
В современных руководствах указывается, что выбор АДП должен осуществляться “по мере возможности, с учетом как индивидуальных требований пациента, так и непосредственных и отдаленных эффектов препарата; в отсутствие особых указаний должен быть выбран АДП в эффективной дозе с наилучшей переносимостью и безопасностью при передозировке” [2]. Таким образом, уже в этой вводной формулировке отмечается существенная роль факторов, выходящих на передний план при длительной поддерживающей или профилактической терапии.
Разберем их подробнее.
Существенную роль при выборе АДП играют его фармакокинетические характеристики, такие как время полувыведения, наличие активных метаболитов, биодоступность и ряд других (см. таблицу).
Таблица.Фармакокинетические параметры различных АДП.
Так, длительный период полувыведения флуоксетина (включая аналогичный показатель его активного метаболита норфлуоксетина) позволяет с большей свободой относиться к уже установленному режиму приема препарата: эпизодические перерывы в приеме в 1–3 дня лишь в минимальной степени снижают его концентрации в крови. С другой стороны, длительный период полувыведения препарата требует осторожности при его назначении пациентам со сниженной способностью ферментативных систем печени из-за риска кумуляции. Более предпочтительными в этом плане выглядят такие серотонинергические АДП, как циталопрам и сертралин, в наибольшей степени подходящие для долговременной терапии благодаря уникальному сочетанию фармакокинетических параметров (близкий к 24 часам период полувыведения в отсутствие долгоживущих высокоактивных метаболитов), клинических эффектов (сбалансированное анксиолитическое и антидепрессивное действие в отсутствие выраженного стимулирующего эффекта, доказанная эффективность в отношении коморбидных тревожных расстройств) и положительного профиля безопасности (включая более низкий риск развития серотонинового синдрома и синдрома отмены) [31].
Проблема лекарственного взаимодействия
Для большинства АДП и других лекарственных средств основным путем метаболизма является печеночный. Эти препараты метаболизируются с участием различных изоэнзимов системы цитохрома P450, активность которых зачастую ингибируется самим препаратом или его метаболитами. Это может стать причиной развития токсических реакций, риск которых повышается низкой активностью энзимных систем и неблагоприятными лекарственными взаимодействиями. Из всех СИОЗС минимальным потенциалом лекарственного взаимодействия характеризуются сертралин и циталопрам, максимальным – флуоксетин и флувоксамин (рис. 2).
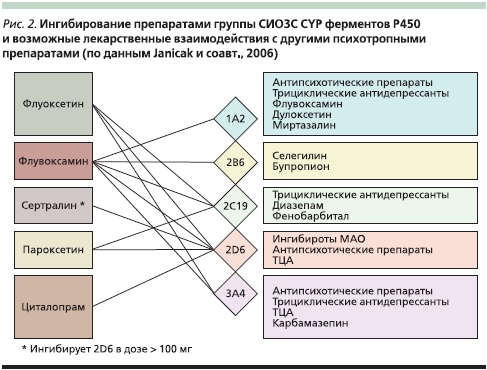
Эти особенности антидепрессивных средств необходимо учитывать и при назначении комбинированной терапии, и при замене одного препарата другим, поскольку ингибирование ими активности изоэнзимов CYP450 может проявляться в течение достаточно длительного времени из-за протрагированной фармакокинетики. Таким образом, может происходить 1,5–3,0-кратное возрастание максимальной концентрации ассоциированных с данным метаболическим путем препаратов в плазме, а период их полувыведения многократно удлиняется.
Хорошей моделью для рассмотрения этого явления может служить флуоксетин. С учетом длительного периода полувыведения этого препарата (до 6 суток при регулярном применении) и наличия долгоживущих активных метаболитов (норфлуоксетин с периодом полувыведения до 16 суток при регулярном применении) внимание врача должно быть обращено на возможность лекарственного взаимодействия не только с препаратами, принимаемыми пациентом в настоящее время, но и с назначаемыми вслед за отменой флуоксетина.
Особую осторожность следует проявлять при назначении АДП пациентам с нарушением функции печени, что может привести к значительному превышению ожидаемой концентрации препарата в крови и появлению побочных эффектов даже при минимальных дозировках.
Суицидальный риск
Суицид является наиболее серьезным осложнением течения аффективного расстройства. По разным оценкам, среди всех суицидентов доля пациентов с депрессией составляет от 50 до 85 %. Факторами риска в отношении суицидальных попыток обычно называются: пожилой возраст, мужской пол, семейное положение (одинокие), личностные расстройства, агрессивное и суицидальное поведение в анамнезе, социальную изоляцию, наличие физического заболевания и злоупотребление алкоголем.
Наибольшую суицидальную опасность представляют лица с суицидальными попытками в анамнезе (этот риск максимален в течение первого года после уже совершенной попытки и, по ряду оценок, может достигать 10 % в отношении реализации завершенного суицида), а также пациенты, недавно выписанные из психиатрического стационара. Существуют данные о том, что до 9 % суицидентов совершают суицид в течение суток после выписки [7].
Значительное число суицидальных попыток совершается путем самоотравления АДП, наибольший риск при этом приходится на ТЦА. Согласно статистическим данным, доля самоотравлений с их применением уступает таковой лишь двух веществ: героина и парацетамола (Deaths related to drug poisoning in England and Wales, 2008).
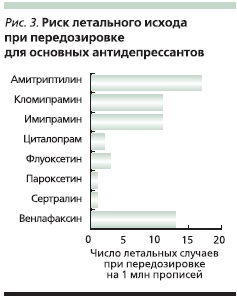 Необходимость назначения АДП пациентам с суицидальным риском требует оценки возможности летального исхода при их передозировке. Традиционно этот показатель оценивается в виде соотношения летальных случаев из-за передозировки и общего количества назначений данного препарата. В зависимости от этой величины выделяются препараты с высокой, умеренной или низкой степенью риска летального исхода при передозировке. Основные представители группы СИОЗС принадлежат к последней группе, в то время как ТЦА и некоторые селективные препараты “двойного действия” – к первым двум (рис. 3) [6].
Необходимость назначения АДП пациентам с суицидальным риском требует оценки возможности летального исхода при их передозировке. Традиционно этот показатель оценивается в виде соотношения летальных случаев из-за передозировки и общего количества назначений данного препарата. В зависимости от этой величины выделяются препараты с высокой, умеренной или низкой степенью риска летального исхода при передозировке. Основные представители группы СИОЗС принадлежат к последней группе, в то время как ТЦА и некоторые селективные препараты “двойного действия” – к первым двум (рис. 3) [6].
Другой величиной, требующей прогностической оценки при выборке АДП, является уровень суицидального риска. Этот показатель позволяет оценить соотношение рисков совершения пациентами суицидальных попыток при приеме различных АДП. Данные мета-анализа показывают, что уровень суицидального риска для таких препаратов, как пароксетин, сертралин и венлафаксин, значительно превышает таковой для циталопрама и флуоксетина [9].
Отмена АДП
Нарушения, ассоциированные с отменой антидепрессивной терапии, были подробно рассмотрены нами в отдельной публикации, целиком посвященной этому вопросу [35]. Здесь отметим, что показатели частоты развития и выраженность симптомов отмены АДП для циталопрама аналогичны таковым для сертралина и лишь незначительно превышают показатели флуоксетина. Таким образом, вопрос о необходимости применения специальных терапевтических схем при отмене циталопрама для минимизации симптомов отмены, как правило, не поднимается.
Результаты использования циталопрама в клинике пограничных состояний
В отделении новых средств и методов терапии (руководитель – профессор Аведисова А.С.) ГНЦ ССП им. В.П. Сербского на базе ПБ № 12 Москвы нами было проведено пилотное исследование эффективности курсов монотерапии препаратом Прам (циталопрам) производства компании “Ланнахер” (Австрия) при назначении его пациентам с затяжными тревожнофобическими расстройствами. Нами была предусмотрена возможность использования гибкого режима дозирования: начальная доза препарата составила 20 мг в сутки и при необходимости могла быть увеличена до 60 мг в сутки. Длительность курса терапии составила 12 недель.
Были пролечены 30 амбулаторных пациентов (18 женщин и 12 мужчин) в возрасте от 18 лет, у которых выявлялись симптомы генерализованного тревожного или социально-тревожного расстройства (СТР) в соответствии с критериями МКБ-10.
Динамика состояния оценивалась с помощью шкалы общего клинического впечатления (CGI). Кроме того, регистрировались все нежелательные явления, возникшие в ходе лечения. Обследование пациентов проводилось до начала приема циталопрама, на 7-й, 14, 28, 42, 56 и 84-й дни. Средний возраст пациентов составил 29,5 ± 4,9 года; средняя длительность заболевания –4,1 ± 2,3 года.
Двенадцать (40 %) пациентов ранее уже проходили лечение по поводу СТР, не приведшее к стойкому улучшению состояния. Большинство из них получали препараты группы СИОЗС (пароксетин, сертралин и флуоксетин) или бензодиазепиновые транквилизаторы (альпразолам, клоназепам, феназепам). Все эти препараты были отменены до начала курса лечения циталопрамом.
Результаты
Все пациенты, включенные в настоящее исследование, успешно завершили участие в нем. Случаев досрочного выбывания как из-за неэффективности терапии, так и в связи с нежелательными явлениями зарегистрировано не было. Все пациенты получали препарат в дозе не менее 20 мг/сут. Из-за недостаточной эффективности начальной дозы препарата (20 мг/сут) в 14 случаях она была повышена до 40 мг/сут, а двум из этих пациентов –до 60 мг/сут впоследствии. У ряда больных, которым это увеличение было проведено, удалось достичь адекватного ответа на терапию, благодаря чему они в итоге были квалифицированы как респондеры (четыре пациента) или частичные респондеры (шесть пациентов). Средняя дозировка препарата в исследовании составила 30 мг/сут.
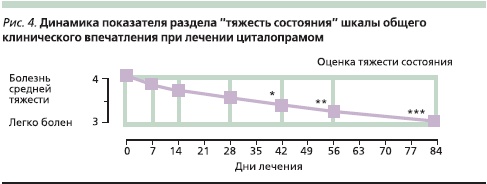
Динамику показателей раздела “тяжесть состояния” шкалы CGI можно было оценить как близкую к линейной, причем уровень достоверности различия с базовым показателем достигался к 6-й неделе лечения (р ис 4).
Достижение достоверных положительных изменений только на 6–-й неделе, на наш взгляд, говорит о целесообразности длительных (не менее 3 месяцев) курсов терапии СТР.
Анализ различных вариантов ответа на терапию показал, что более половины всех пациентов (63 %) к моменту завершения терапии соответствовали критериям полного ответа (показатели “выраженное улучшение” [1] или “заметное улучшение” [2] раздела “общее улучшение” шкалы CGI). Еще 17 % были квалифицированы как частичные респондеры (показатель “незначительное улучшение” [3] шкалы CGI) и 20 % –как нонреспондеры (показатель “отсутствие улучшения” [4] шкалы CGI). Вариантов с отрицательной динамикой состояния зарегистрировано не было. Различия по полу, возрасту и остальным демографическим показателям между респондерами, частичными респондерами и нонреспондерами отсутствовали.
Сравнение полученных результатов с данными литературы об эффективности терапии в смешанных группах больных с СТР или генерализованным тревожным расстройством (первичные–повторные курсы терапии; генерализованные– негенерализованные формы СТР) позволяет оценить их как сопоставимые [1, 17, 30].
Оценка нежелательных явлений
Общее количество нежелательных явлений (9 наблюдений) при назначении циталопрама в настоящем исследовании не превосходит таковое, отмечающееся при применении других АДП группы СИОЗС; его можно оценить как сравнимое с собственными наблюдениями [34] и результатами других авторов [17]. Основным симптомом, возникающим при назначении препарата, были чувство тошноты в первые 3–6 дней терапии (4 наблюдения), инсомния или сонливость в дневные часы (1 и 2 наблюдения соответственно), сухость во рту (2 наблюдения). Ни в одном случае возникновение перечисленных симптомов не стало причиной досрочного завершения терапии, а сами они к 14–28-му дню лечения подвергались произвольному обратному развитию.
Заключение
Полученные результаты подтверждают оправданность выбора циталопрама (на примере препарата Прам) в качестве средства длительной терапии в силу его эффективности и хорошей переносимости. Обладая выраженным терапевтическим действием в дозировке порядка 20–40 мг в сутки, препарат эффективно воздействует на основные проявления генерализованной и социальной тревоги. Сказанное позволяет рекомендовать применение препарата Прам пациентам с указанными расстройствами для назначения в качестве монотерапии уже на начальном этапе лечения.
Информация об авторе:
Ястребов Денис Васильевич – старший научный сотрудник, отделение новых средств и методов терапии отделапограничной психиатрии ГНЦ социальной и судебной психиатрии им. В.П. Сербского.
Тел.8 (495) 193-10-84



