Введение
Вакцины против вируса папилломы человека (ВПЧ) – одни из наиболее эффективных и доступных профилактических вакцин, установивших несколько важных ориентиров в вакцинологии человека. Это первые вакцины, предотвращающие заражение мукозатропным инфекционным агентом, передающимся половым путем, и делающие это без специфической индукции иммунитета слизистой оболочки. Они также являются первыми субъединичными вакцинами, которые последовательно индуцируют долгосрочные (более 10 лет) стабильные реакции сывороточных антител. Высокая эффективность, выявленная в ходе предварительных клинических испытаний, подтверждена значительным воздействием и эффективностью, наблюдаемыми в национальных программах иммунизации за последние десятилетия [2]. В настоящее время существуют амбициозные цели по снижению заболеваемости, связанной с ВПЧ.
Однако использование вакцины против ВПЧ остается низким во многих странах, хотя двух- и четырехвалентная вакцины, вводимые в виде двух и трех доз, эффективны для профилактики предраковых поражений шейки матки у женщин.
Профилактическая вакцинация против ВПЧ тремя дозами, вводимыми по схеме в течение 6-месячного периода одной из двух имеющихся в продаже вакцин (вакцина против ВПЧ 16/18 Церварикс® [группа компаний GSK, Риксенсарт, Бельгия] и ВПЧ 6/11/16/18 Гардасил® [Merck & Co., Whitehouse Station, NJ]), высокоэффективна в профилактике цервикальной ВПЧ-инфекции и связанных с ними заболеваний [1]. Данные вакцины против ВПЧ были лицензированы и рекомендованы много лет назад [2] для снижения индивидуальной и популяционной распространенности ВПЧ как причины канцерогенеза шейки матки [3]. Эти вакцины были первоначально испытаны и одобрены для трехдозовых схем [1]. Уровень внедрения вакцины во многих регионах мира был низким [4], что, вероятно, является следствием высокой стоимости и интенсивной инфраструктуры, необходимой для введения трех доз вакцины в течение 6-месячного периода.
Со временем серологические данные предоставили убедительные доказательства того, что две дозы, введенные подросткам (9–14 лет) с интервалом не менее 6 месяцев, вызывали иммунологические реакции, схожие с таковыми при введении трех доз вакцины женщинам в возрасте от 16 до 26 лет [5, 6]. После предоставленных данных в 2014 г. европейские рекомендательные органы в сфере здравоохранения сократили рекомендуемую дозировку для подростков до 2 доз [7], США сделали параллельную рекомендацию в 2016 г. [8]. Испытания вакцины в Коста-Рике (CVT) [9] и испытание PATRICIA [10], в ходе которых тестировалась бивалентная вакцина против ВПЧ, показали одинаковую эффективность вакцины в течение 4 лет в постфактум-анализе даже среди женщин, получавших однократную дозу вакцины против ВПЧ.
Следует отметить, что в вышеприведенных исследованиях были задокументированы стабильные гуморальные ответы на уровне в 5–9 раз выше для ВПЧ-16 и -18, чем уровни, индуцированные естественным иммунитетом [11, 12].
Московская область (МО) стала первым регионом РФ, где была принята Областная программа иммунизации против рака шейки матки впервые в 2007 г. «Вакцинопрофилактика онкологических заболеваний, вызываемых вирусом папилломы человека». В настоящее время привиты около 30 тыс. девочек-подростков, проживающих в 30 муниципальных районах МО. В рамках областной программы использовалась в основном квадривалентная вакцина (Гардасил), согласно схеме инструкции. В результате проведенной вакцинальной программы в регионе получены первые положительные результаты по снижению заболеваемости аногенитальными кондиломами как от девочек-подростков, так и от всего населения МО, а также установлено снижение заболеваемости раком шейки матки у молодых женщин 15–24 лет [13–15].
Цель исследования: сравнить клиническую эффективность разных схем иммунизации против ВПЧ для молодых женщин, которые 5–14 лет назад начали курс вакцинации, но в силу каких-то причин ее не продолжили, и для пациенток, получивших полный курс вакцинации.
Методы
В рамках областной программы вакцинопрофилактики ВПЧ-ассоциированных заболеваний в МО проведено ретроспективное исследование пациенток в возрасте 18–31 года, которые с 2008 г. в подростковом возрасте (12–17 лет) вакцинированы квадривалентной вакциной (Гардасил). Всего были вакцинированы около 30 тыс. девочек-подростков. По прошествии времени был сделан вывод: часть из них по разным причинам не провели полный курс вакцинации, в связи с чем было принято решение о проведении исследования по оценке эффективности таких схем вакцинации. Пациентки были разделены на 3 группы: I группу составили 30 пациенток, получавших полный курс вакцинации, состоявший из 3 доз вакцин по схеме 0–2–6месяцев, II группу – 30 пациенток, которые получали 2 дозы вакцины с интервалом 0–2 месяца, III группу составили 30 пациенток, которые по тем или иным причинам (покинули регион сразу после введения первой дозы, медотвод от последущей вакцинации в течение года, отказ от введения 2 и 3 доз) получали только 1 дозу квадривалентной вакцины.
Все пациентки на момент обследования были сексуально активными. В рамках обследования проведены ПЦР (полимеразная цепная реакция)-диагностика ВПЧ высокого канцерогенного риска, ВПЧ 6-го и 11-го типов; цитологическое обследование мазков с поверхности шейки матки методом жидкостной онкоцитологии, а также кольпоскопия.
Результаты
Большинство пациенток, а именно 58 (64,4%) из всех обследованных, отметили в анамнезе беременность в естественном цикле с положительным исходом с рождением здоровых детей. Статистических различий по числу беременных и родов в группах обнаружено не было (63,3%, 73,3 и 56,7% соответственно) (рис. 1).
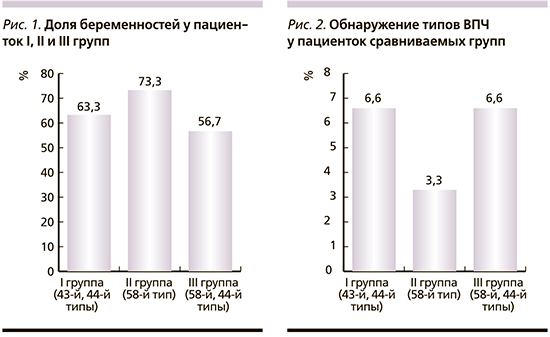
По результатам ПЦР-диагностики ВПЧ обнаружен во всех группах у единиц пациенток, причем были обнаружены невакцинные типы вирусов: у 2 (6,6%) пациенток I группы выявлены 43-й и 44-й типы вируса, у 1 (3,3%) пациентки II группы обнаружен 58-й тип вируса и у 2 (6,6%) пациенток III группы – 58-й и 44-й типы вируса (рис. 2). Стоит отметить, что вакцинные типы вируса, а именно 6-й, 11, 16 и 18-й типы, а также те типы вируса, к которому вырабатывается перекрестный иммунный ответ на вакцинацию, на момент исследования не были выявлены ни у одной из пациенток.
По результатам цитологического исследования мазков с поверхности шейки матки методом жидкостной цитологии установлено: в I группе у одной пациентки с ВПЧ – ASC-US, у второй пациентки – L-SIL, у пациенток II группы патологии выявлено не было, а у ВПЧ-позитивных пациенток III группы – ASC-US. При более детальном обследовании пациенток с аномальной цитологической картиной обнаружены сопутствовавшие инфекции, передаваемые половым путем (хламидийная и микоплазменная инфекции), бактериальный вагиноз, признаки кольпита, после лечения которых цитологическая картина с ASC-US нормализовалась, а за пациенткой с L-SIL с учетом молодого возраста (19 лет), отрицательного результата онкопротеина (p16) и нормальной кольпоскопической картины продолжено наблюдение в динамике.
По результатам кольпоскопического исследования у пациенток I группы выявлено: ovuli naboti – у 4 (13,3%), эктопия шейки матки – у 17 (56,7%), эндометриоидная гетеротопия – у 1 (3,3%), признаки цервицита – у 3 (10%), аномальная кольпоскопическая картина – у 5 (16,7%) пациенток.
Кольпоскопическая картина у пациенток II группы представлена следующим образом: эктопия шейки матки – у 21 (70%), признаки цервицита – у 4 (13,3%), полип цервикального канала – у 1 (3,3%), аномальная кольпоскопическая картина – у 4 (13,3%).
У пациенток III группы обнаружены эктопия шейки матки – у 22 (73,3%), признаки цервицита – у 2 (6,7%), рубцовая деформация шейки матки – у 4 (13,3%), аномальная кольпоскопическая картина – у 2 (6,7%).
Заключение
С учетом данных проведенного исследования можно сделать следующий вывод: независимо от числа полученных доз вакцин в юном возрасте по прошествии времени вакцинные типы ВПЧ не обнаружены ни у одной из пациенток.
В группах сравнения не обнаружено статистической разницы в показателях цитологического и кольпоскопического обследований.
У большинства пациенток, получавших от одной до трех доз вакцинного препарата в юном возрасте, в дальнейшем отмечены беременности в естественном цикле с положительным исходом и с рождением здоровых детей.
Причем не выявлено статитической разницы в сравниваемых группах в наступлении и результатах беременности.
Несмотря на проводимую вакцинацию, все девушки и женщины требуют регулярных профилактических осмотров с целью ранней диагностики любой гинекологической патологии.
В декабре 2022 г. ВОЗ выпустила обновленные рекомендации по вакцинации от ВПЧ. Официально указано, что однократная вакцинация по эффе-ктивности и иммуногенности сопоставима с двукратной. Сокращение числа вакцинаций должно повысить доступность вакцины и снизить экономические затраты. Рекомендации ВОЗ таковы: девочки в возрасте 9–14 лет и девушки 15–20 лет могут прививаться одно- или двукратно с интервалом 6 месяцев и более, женщины с 21 года – двукратно с интервалом 6 месяцев и более. Эксперты подчеркивают, что схема с однократной вакцинацией пока принадлежит к категории off-label-вмешательств [16].
Дополнительная информация
Публикация статьи осуществляется в рамках диссертационной работы на соискание ученой степени докт. мед. наук: «Вакцинопрофилактика ВПЧ и ее роль в улучшении репродуктивного здоровья девочек-подростков и молодых женщин».



