Введение
В 2016 г. в Российской Федерации был зарегистрирован новый антимикробный препарат класса оксазолидинонов – тедизолида фосфат, показанием к назначению которого являются осложненные инфекции кожи и мягких тканей (оИКМТ), вызванные чувствительными грамположительными микроорганизмами. Данный антибиотик в течение нескольких лет уже применяется в США (2014) и в странах ЕС (2015).
ИКМТ как самостоятельное заболевание или как следствие механических повреждений, хирургических манипуляций (нозологические, травматические и хирургические инфекции) вызываются широким кругом патогенных микроорганизмов, преимущественно грамположительных, в т.ч. устойчивых к антибиотикам различных групп. Среди них наиболее актуальны стафилококки, главным образом Staphylococcus aureus, устойчивые к метициллину, оксациллину и другим беталактамам, объединенные общим термином «метициллинорезистентные S. aureus» (MRSA). Штаммы MRSA довольно широко распространены в стационарах, особенно в отделениях интенсивной терапии и реанимации, частота их выявления может достигать 59,5–64,4% [15]. Важнейшей особенностью MRSA-штаммов является перекрестная (ассоциированная) устойчивость к большинству антибиотиков других химических групп, т.е. полирезистентность.
В отношении штаммов MRSA обычно проявляют активность in vitro гликопептиды (ванкомицин, тейкопланин) или липогликопептиды (телаванцин), липопептиды (даптомицин), глицилциклины (тигециклин), β-лактамы (цефтаролин), оксазолидиноны (линезолид, тедизолид), линкозамиды (линкомицин, клиндамицин), тетрациклины (миноциклин), частично – фузидиевая кислота и ко-тримоксазол. Большинство препаратов уже включено в перечень рекомендаций Американского общества по инфекционным заболеваниям (IDSA) по лечению ИКМТ или инфекций кожи и кожных структур (ИККС) у пациентов с подозрением или подтвержденным диагнозом инфекции, вызванной MRSA или бета-гемолитическим стрептококком. Однако применение этих препаратов в лечебной практике в современных условиях сталкивается с рядом ограничений.
Группа оксазолидинонов занимает важное место в терапии полирезистентной грамположительной бактериальной инфекции. Первый представитель оксазолидинонов – линезолид – применяется в клинической практике с начала 2000-х гг. [5], постепенно вытесняя ванкомицин в связи с нарастающим распространением ванкомициноустойчивых штаммов MRSA, а также плохим внутриклеточным проникновением ванкомицина и наличием у него нефротоксичности. Линезолид характеризуется хорошей тканевой фармакокинетикой, в т.ч. предсказуемой для больных в критическом состоянии и в случаях развития острой почечной недостаточности; простотой дозирования и очень редким выделением резистентных к нему штаммов. Однако у линезолида тоже имеются факторы, лимитирующие его применение, среди них: межлекарственные взаимодействия, риск миелосупрессии с развитием тромбоцитопении и лейкопении (что требует контроля лечения). Кроме того, за последние 5–7 лет появились сообщения о выделении стафилококков, устойчивых к линезолиду [27].
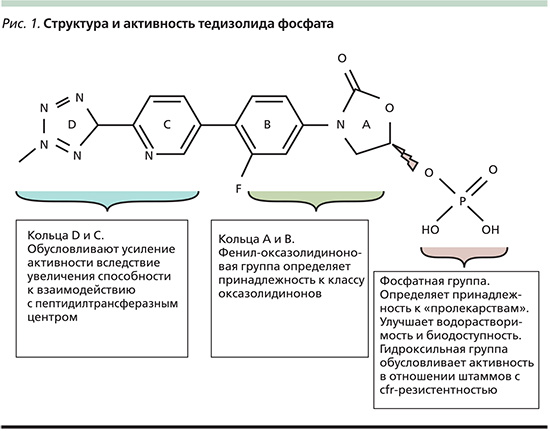
Механизм действия тедизолида
Тедизолида фосфат – новый представитель группы оксазолидинонов с улучшенными микробиологическими и клиническими свойствами по сравнению с линезолидом, характеризуется доказанной эффективностью при лечении осложненных бактериальных ИКМТ, что показали результаты III фазы клинического исследования двух лекарственных форм: инъекционной (для внутривенного введения) и таблеток (для приема внутрь) этого антибиотика, получившего название «Сивекстро» (Байер Фарма АГ, Германия). В структуру молекулы тедизолида были внесены значительные изменения по сравнению с линезолидом. Благодаря этому активность тедизолида повысилась в 4–32 раза, потенциал к развитию резистентности снизился в 16 раз и препарат приобрел более широкий спектр действия по сравнению с линезолидом [20, 21, 40].
Активным компонентом препарата Сивекстро является тедизолид [14]. Тедизолида фосфат является пролекарством, которое при поступлении в организм преобразуется под действием эндогенных неспецифических фосфатаз в тедизолид – микробиологически активное вещество [39, 40]. Тедизолид связывается с 23S-рибосомной РНК (рРНК) пептидилтрансферазного центра, входящего в состав 50S-рибосомной субъединицы, блокирует процесс синтеза белка. Противомикробная активность оксазолидинонов коррелирует с их аффинностью к участку связывания на рибосоме. Более высокая активность тедизолида по сравнению с линезолидом обусловлена лучшей взаимосвязью тедизолида с рибосомой. С точки зрения химического строения тедизолид отличается от других оксазолидинонов наличием принципиально нового D-кольца, содержащего дополнительную метилтетразольную группу (рис. 1). Эти структурные особенности обеспечивают повышение активности препарата и снижение потенциала развития природной резистентности микроорганизмов. D-кольцо обеспечивает повышенную аффинность тедизолида (за счет прочных водородных связей) к 50S-рибосомной субъединице, что усиливает его противомикробную активность [39, 40].
Тедизолид относится к антибиотикам с бактериостатическим типом действия. Тедизолид ингибирует синтез белка бактерий через механизм действия, отличный от такового для антибиотиков, не относящихся к классу оксазолидинонов, что делает маловероятной перекрестную резистентность между тедизолидом и другими классами антибактериальных препаратов (пенициллины, цефалоспорины, аминогликозиды, гликопептиды, липопептиды, стрептограмины, хинолоны, макролиды и тетрациклины).
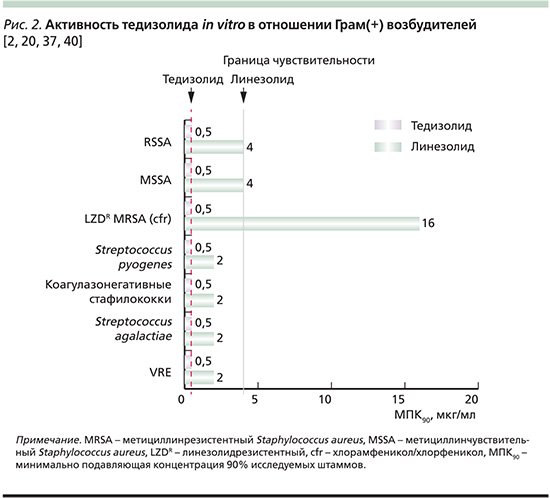
В спектр действия in vitro-активности тедизолида входят следующие грамположительные возбудители (табл. 1, рис. 2): Staphylococcus aureus (включая MRSA и MSSA), S. haemolyticus, S. lugdunensis, Str. pyogenes, Str. agalactiae, группа Str. anginosus (включая Str. anginosus, Str. intermedius и Str. constellatus), а также Enterococcus faecalis и E. faecium, включая ванкомицинрезистентные энтерококки (VRE) [2, 20, 40]. Согласно данным этих авторов, минимальная подавляющая концентрация (МПК) тедизолида в 4–32 раза ниже, чем МПК линезолида.
Тедизолид, как и линезолид, как правило, не активен в отношении грамотрицательных микроорганизмов. Пограничное значение МПК тедизолида, принятое Европейским комитетом по определению чувствительности (EUCAST) для Staphylococcus spp. и бета-гемолитических стрептококков (A-, B-, C-, G-группы) ≤0,5 мкг/мл, для группы Streptococcus anginosus – 0,25 мкг/мл и менее [2]. Активность in vitro усиливается благодаря высокой внутриклеточной кумуляции препарата в гранулоцитах, макрофагах, что способствует более быстрой эрадикации бактерий (например, S. aureus) по сравнению с действием линезолида [6, 13, 20].
На степень чувствительности бактерий к оксазолидинонам влияют два типа хромосомных мутаций: точечные мутации в 23S-рибосомной РНК или специфических рибосомных белках L3 и L4, кодируемых, соответственно, генами rplC и rplD в хромосоме [21, 22]. Тедизолид сохраняет активность in vitro в отношении бактерий (например, S. aureus), несущих на плазмиде cfr-ген/фермент (хлорамфеникол/флорфеникол. При наличии мутаций в рибосомной РНК или белках МПК тедизолида в 4–8 раз ниже, чем у линезолида [20]. Частота развития природной резистентности к тедизолиду у S. aureus и других грамположительных кокков в 16 раз ниже по сравнению с линезолидом [21].

Таким образом, тедизолид демонстрирует высокую антимикробную активность в широком диапазоне грамположительных кокковых микроорганизмов, в т.ч. характеризующихся полирезистентностью. Такие свойства препарата служат достаточно серьезным основанием для рассмотрения нового представителя оксазолидинонов в качестве альтернативы линезолиду или препарата первоочередного выбора при развитии оИКМТ, вызванных полирезистентными грамположительными кокковыми микроорганизмами [23].
Эпидемиологическая ситуация с распространением устойчивости к оксазолидинонам среди возбудителей при оИКМТ
Спектр действия и активность in vitro тедизолида и других сравниваемых препаратов были изучены на 6884 грамположительных патогенах, выделенных в медицинских учреждениях США и странах ЕС в 2011 и 2012 гг.
Среди выделенных бактерий 4499 составили S. aureus, 537 – коагулазонегативные стафилококки (CoNS), 873 – энтерококки и 975 – β-гемолитические стрептококки. Значения МПК для 90% изолятов (МПК90) в каждой группе составили 0,25 мкг/мл для S. epidermidis и β-гемолитических стрептококков и 0,5 мкг/мл для S. aureus, других CoNS и энтерококков. Результаты изучения чувствительности довольно большого количества штаммов возбудителей ИКМТ показали, что тедизолид проявляет более высокую по сравнению с линезолидом природную активность в отношении 1770 штаммов MRSA (МПК 0,5 и 2 мкг/мл соответственно), а также в отношении 729 штаммов метициллинчувствительных стафилококков (MSSA) – МПК 0,5 и 2 мкг/мл, 537 коагулазонегативных стафилококков (MSSE) и Str. pyogenes (0,25 и 1 мкг/мл), 221 штамма E. faecalis (0,5 и 2 мкг/мл) и ванкомицинорезистентных E. faecium (0,5 и 2 мкг/мл). В целом тедизолид демонстрировал отличную активность в отношении грамположительных бактерий, которая оказалась по крайней мере в 4 раза выше по сравнению с таковой, наблюдаемой у линезолида, в отношении штаммов «дикого типа» и резистентных к линезолиду штаммов. Полученные данные позволяют рассматривать тедизолид в качестве препарата выбора в случаях инфекций, вызванных грамположительными кокковыми патогенами [36].
Практически сходные данные были получены при изучении чувствительности (методом диффузии в агар с оценкой критериев CLSI) более 500 штаммов S. aureus, выделенных от больных в госпиталях Кореи в 2011–2014 гг., в т.ч. у 356 больных ИКМТ. МПК тедизолида для грамположительных изолятов составила ≤1 мкг/мл, МПК90 для MRSA – 0,5 мкг/мл, она была во всех случаях в 4 раза ниже по сравнению с МПК линезолида [42]. Аналогичным данным по чувствительности грамположительных возбудителей ИКМТ посвящена публикация тайванских исследователей из Университетского госпиталя, изучавших чувствительность 425 изолятов, выделенных от больных в 2013–2014 гг. [16].
Фармакодинамика и фармакокинетика тидезолида
После приема внутрь тедизолида фосфат при помощи фосфатаз преобразуется в тедизолид – вещество, которое непосредственно обладает антимикробной активностью. Наиболее подробно изучен его фармакокинетический профиль [7, 12, 29]. Расширенная программа изучения тедизолида состояла из экспериментальной части исследований на животных и у здоровых добровольцев разных возрастных групп, весовых категорий и клинической части, в которую были включены рандомизированные исследования, в т.ч. у пациентов групп риска (с почечной и печеночной недостаточностью). Авторы исследований оценивали фармакокинетические параметры препарата после однократных и многократных доз тедизолида фосфата при приеме внутрь и внутривенном введении. Применялся метод жидкостной хроматографии в совокупности с методом тандемной масс-спектрометрии. Антибактериальная активность тедизолида in vivo определяется отношением площади под фармакокинетической кривой к минимальной подавляющей концентрации (ПФК/МПК) и проникновением в инфицированные ткани, а также обеспечивается его внутриклеточной кумуляцией [19].
После приема тедизолида фосфата внутрь пиковая (максимальная) концентрация в плазме крови достигалась приблизительно в течение 3 часов [7]. Период полувыведения тедизолида составляет примерно 10–11 часов. Такая продолжительность периода полувыведения позволяет вводить препарат в организм 1 раз в сутки. Биодоступность тедизолида при приеме per os составляет 91,5%, что позволяет проводить ступенчатую терапию и коррекции дозы не требуется при переводе пациента на другую лекарственную форму (с внутривенного введения на прием внутрь) [7]. Из организма тедизолид выводится в основном через печень. С калом и мочой выделяется 82 и 18% соответственно. Пролонгированная фармакокинетика объясняет возможность применения тедизолида 1 раз в сутки.
В случаях почечной недостаточности, в т.ч. у пациентов, которым проводится программный гемодиализ, коррекции дозы не требуется [9, 29]. При совместном применении тедизолида с пищей такие фармакокинетические параметры, как ПФК «концентрация–время», оставались неизменными, в связи с чем тедизолида фосфат может приниматься независимо от приема пищи [12].
Фармакокинетические исследования, проведенные S.D. Flanagan и соавт. в 2014–2015 гг. в разных популяциях (здоровые взрослые, пациенты с ИКМТ и пациенты с различной степенью органной дисфункции, включенные в I–III фазы исследования), продемонстрировали, что возраст, пол, раса, а также наличие определенной степени почечной или печеночной недостаточности не оказывали существенного влияния на фармакокинетические свойства тедизолида [11]. Согласно результатам исследования, фармакокинетические параметры пациентов как без ожирения, так и с ожирением (класс II, ИМТ>35 кг/м2) были схожими, поэтому для этой популяции корректировки дозы не требуется [10].
У пациентов в терминальной стадии почечной недостаточности, которым проводился программный гемодиализ, снижения концентрации тедизолида в плазме крови не наблюдалось. Таким образом, у пациентов с почечной недостаточностью или у больных, находящихся на программном гемодиализе, коррекции дозы не требуется [9]. Те же авторы изучили фармакокинетику тедизолида после введения однократной дозы 200 мг тедизолида фосфата пациентам с умеренной или тяжелой печеночной недостаточностью по классификации Child–Pugh [9]. Наблюдались минимальные различия в фармакокинетических показателях как у пациентов с умеренной и тяжелой печеночной недостаточностью, так и между этими пациентами и группой контроля.

У пациентов с нейтропенией (<1000 клеток/мм3) эффективность и безопасность применения тедизолида изучены недостаточно. На экспериментальной модели животных, у которых гранулоциты отсутствовали, антибактериальная активность тедизолида была снижена. Поэтому нейтропеническим пациентам с ИКМТ рекомендуется использовать альтернативные схемы лечения [6].
Клинические аспекты изучения эффективности и безопасности применения тедизолида фосфата
Частота хирургических инфекций мягких тканей (послеоперационные нагноения и проч.) в структуре нозокомиальных инфекций составляет около 36% в Европе [34], 24% – в России [17], а среди первичных обращений к врачам хирургам доля ИКМТ достигает 70% [4]. В странах Европы ежегодно регистрируется до 4 млн новых случаев длительно незаживающих ран [30].
В Российской Федерации, по экспертным оценкам, эта патология ежегодно наблюдается примерно у 700 тыс. пациентов [1].
Инфекции кожи, вызванные внебольничными (community-acquired) MRSA-штаммами (CA-MRSA), наиболее часто встречаются в США и Латинской Америке в отличие от других регионов [35]. Исследования в области молекулярной эпидемиологии S. aureus свидетельствуют о том, что для Российской Федерации характерно распространение во внебольничных условиях не CA-MRSA, а типичных нозокомиальных штаммов MRSA [3].
Клинические исследования тедизолида: II фаза
Эффективность тедизолида фосфата изучали в рандомизированном двойном слепом исследовании, препарат назначали пациентам с осложненными инфекциями кожи и кожных структур в дозах 200, 300 и 400 мг 1 раз в сутки в течение 5–7 дней. Наряду с оценкой клинической эффективности для данной категории больных проведено сравнительное изучение антимикробной активности тедизолида и линезолида. После рандомизации 192 пациента были включены в исследование, среди которых 188 получили лечение тедизолидом (не менее 1 таблетки). Эффективность терапии тедизодидом в дозе 200 мг составила 98,2%, в дозах 300 и 400 мг – 94,4%. S. aureus выделен у 139 (90,3%) из 154 больных. Метициллинустойчивые штаммы выявлены у 80,6% пациентов [31]. Положительный микробиологический эффект (полная эрадикация штамма S. aureus) по окончании исследования достигнут всеми больными, принимавшими тедизолид. Успешное клиническое излечение больных с выделением только одного штамма (MSSA или MRSA) зафиксировано в 96,6% случаев S. aureus в целом и 96,8% случаев MRSA. Авторы сделали заключение: тедизолида фосфат – безопасный и хорошо переносимый препарат при назначении больным оИКМТ в дозах 200, 300 или 400 мг 1 раз в сутки и длительностью терапии 5–7 дней. Фармакокинетическая кривая для тедизолида в исследуемых дозах носит линейный характер. Результаты изучения эффективности и безопасности, а также фармакокинетические и фармакодинамические данные подтверждают целесообразность выбора тедизолида фосфата по 200 мг (для приема внутрь) 1 раз в сутки при лечении оИКМТ.
Клинические исследования: III фаза
Исследование эффективности и безопасности применения тедизолида проведено на пациентах с острыми бактериальными инфекциями кожи и кожных структур (ОБИККС). ОБИККС – вид осложненной ИКМТ, который включает целлюлит/рожистое воспаление, раневую инфекцию и обширный абсцесс кожи с площадью поражения не менее 75 см2 [28, 33].
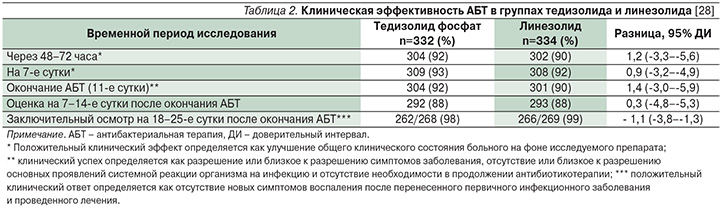
Оценка эффективности и безопасности тедизолида проведена в двух международных рандомизированных слепых контролируемых исследованиях: ESTABLISH-1 [33] и ESTABLISH-2 [28]. В каждом из исследований тедизолида фосфат в дозе 200 мг (1 раз в сутки) сравнивали с линезолидом в дозе 600 мг (2 раза в сутки) при длительности лечения больных ОБИККС 6 и 10 дней соответственно. В исследовании ESTABLISH-1 одним из показателей эффективности тедизолида и линезолида авторами регистрировался ранний клинический ответ, который характеризовался отсутствием увеличения площади поражения и снижением проявлений воспалительных симптомов через 48–72 часа после начала антибактериальной терапии. Ранние клинические показатели ответа на лечение были зафиксированы у 79,5% (95% ДИ от 74,8 до 83,7%) из 332 пациентов группы тедизолида и у 79,4% (95% ДИ от 74,7 до 83,6 %) 335 – в группе линезолида. Устойчивый положительный клинический ответ на лечение (11 суток) тедизолидом и линезолидом регистрировался в 69,3 и 71,9% случаев соответственно. В целом клиническая оценка исследователем частоты достижения эффективной терапии составила 85,5% в группе тедизолида фосфата и 86% линезолида. Аналогичные данные по эффективности получены при сравнении препаратов, применявшихся 178 пациентами с MRSA-штаммами. На основании полученных данных P. Prokocimer и соавт. (2013) делают заключение: для пациентов с ОБИККС применение тедизолида оказалось не менее успешным, чем в группе сравнения с использованием линезолида (statistically noninferior treatment). Таким образом, тедизолид можно рассматривать в качестве обоснованной альтернативы линезолиду в лечении бактериальных ИКМТ.
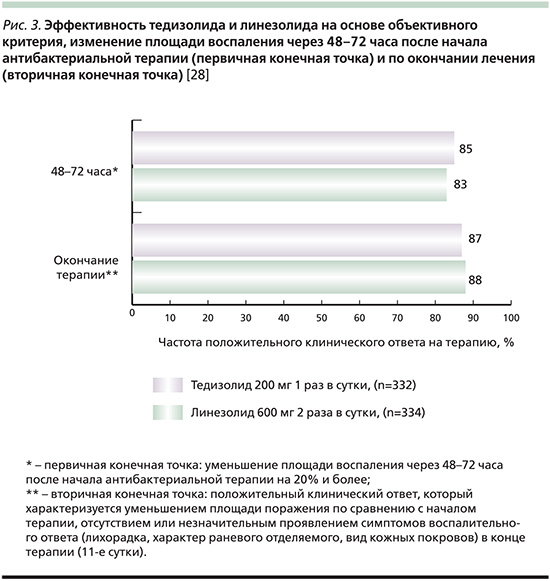
В другое рандомизированное двойное слепое исследование ESTABLISH-2, проведенное в 2011–2013 гг. в 58 центрах 9 стран, были включены в исследование 666 пациентов (возраст ≥12 лет) с ОБИККС (целлюлит/рожа, обширный подкожный абсцесс или раневая инфекция) с площадью поражения не менее 75 см2 с подтвержденным или предполагаемым результатом роста грамположительных микроорганизмов [28]. Антибактериальная терапия включала назначение тедизолида (200 мг 1 раз в сутки в течение 6 дней) или линезолида (600 мг 2 раза в сутки в течение 10 дней) в виде внутривенных инфузий с возможностью перехода на прием внутрь. Первичной конечной точкой считался ранний клинический ответ – уменьшение площади поражения на ≥20% через 48–72 часа от начала терапии. Как представлено на рис. 3, положительная клиническая динамика (clinical response) зарегистрирована через 48–72 часа от начала лечения у 283 (85%) пациентов группы тедизолида и у 276 (83%) группы линезолида. Данное исследование демонстрирует эффективность лечения тедизолидом, которое не уступает таковой при сравнении с терапией линезолидом при более коротком курсе терапии (6 и 10 дней соответственно) пациентов с ОБИККС. В табл. 2 приводятся объединенные результаты оценки клинической эффективности тедизолида фосфата и линезолида, полученные при сравнительном анализе.
В качестве вывода по результатам клинических исследований авторами предлагается рассматривать назначение тедизолида в качестве обоснованного варианта терапии пациентов с ОБИККС как в условиях стационарного лечения, так и в амбулаторной практике.
В настоящее время проводится рандомизированное двойное слепое исследование сравнения эффективности и безопасности тедизолида и линезолида для пациентов с нозокомиальной пневмонией, в т.ч. обусловленной проведением искусственной вентиляции легких. Результаты ожидаются в 2018 г. (СlinicalTrials.gov: NCT02019420).
Безопасность и переносимость тедизолида
Сравнительная оценка частоты появления тромбоцитопении у больных, которым проведена терапия тедизолидом и линезолидом, представлена в работе T.P. Lodise et al. [24]. На основе данных, полученных в исследованиях ESTABLISH-1 и ESTABLISH-2, авторы продемонстрировали более благоприятный профиль тедизолида по сравнению с наблюдаемым на фоне приема линезолида. Тедизолид обладал меньшим риском развития тромбоцитопении по сравнению с линезолидом (4,2 против 7,7%, относительный риск – 0,55; 95% ДИ – 0,33–0,90).
В исследовании K.L. Leach и соавт. (2007) [18] выявлена возможность перекрестного взаимодействия оксазолидинонов с пептидилтрансферазным центром митохондриальных рибосом наряду с рибосомами цитоплазмы [18]. Такой эффект вызывает угнетение синтеза белка в митохондриях и развитие широкого спектра нежелательных явлений, таких как миелосупрессия, лактатацидоз, периферическая нейропатия. С учетом этих данных S. Flanagan, E.E. McKee, D. Das и соавт. (2015), изучая фармакокинетику тедизолида, исследовали его способность вызывать митохондриальную токсичность на модели мышей [8]. In vitro у тедизолида продемонстрировано более сильное по сравнению с таковым, выявленным у линезолида, ингибирование синтеза белка в митохондриях. Эффект зависел от дозы и длительности действия оксазолидинона. В исследованиях на крысах изучено влияние одновременного введения нескольких доз тедизолида, в результате которого регистрировалось повышение концентрации препарата в плазме крови в 8 раз по сравнению с таковым при назначении его терапевтических дозировок. Однако после тщательного изучения состояния мозга, глаз, зрительного нерва, спинного мозга и периферической нервной ткани при сравнении с плацебо не было выявлено никаких симптомов или проявлений нарушений в поведении, обусловленных нейропатическим повреждением или гистопатологическими изменениями центральной или периферической нервной системы, вызванными оксазолидиноном [38].
К одному из основных проявлений митохондриальной токсичности относится способность препарата вызывать миелосупрессию. Гематологическая токсичность тедизолида была детально проанализирована в исследовании A. Shorr и соавт. (2015), в котором приняли участие 1333 пациента, участвовавших в исследованиях III фазы [28; 33; 41]. При исследовании сравнивали не только эффективность, но и безопасность тедизолида (n=664) и линезолида (n=669), оценивали неблагоприятные явления, возникающие при лечении, и динамику лабораторно-клинических показателей крови. Изучена динамика количества тромбоцитов, нейтрофилов и гемоглобина. Согласно результатам, количество тромбоцитов менее 150 тыс./мм3 регистрировали на 7–9-й день лечения у 3,7% пациентов в группе тедизолида против 5,8% получавших линезолид. В дальнейшем по окончании терапии снижение тромбоцитов отмечено в группе с тедизолидом и линезолидом у 4,9 и 10,8% пациентов соответственно (рис. 4). По мнению авторов, такое различие между тедизолидом и линезолидом весьма существенно (p<0,05). Эти результаты согласуются с данными исследований фазы I, в которых гематологическая токсичность не зарегистрирована ни в одной клеточной линии на фоне введения тедизолида 200 мг в течение 3 недель [32]. Однако эти результаты требуют дальнейшего изучения.
К побочным эффектам тедизолида относили дисфункцию желудочно-кишечного тракта (16%) в виде тошноты (8,2%), рвоты (2,9%) и диареи (3,9%). В целом частота нежелательных явлений со стороны желудочно-кишечного тракта была достоверно ниже в группе тедизолида по сравнению с линезолидом – 16 и 23% соответственно (р<0,05). Сообщалось о головной боли в 6,2% случаев при приеме тедизолида и 5,9% – линезолида. Нежелательные явления, приведшие к прекращению приема исследуемого препарата, отмечены у 0,5% пациентов группы тедизолида и у 0,9% группы линезолида [41]. В целом тедизолида фосфат хорошо переносился пациентами, серьезные нежелательные явления зарегистрированы только в 2% случаев.
К противопоказаниям к данному препарату можно отнести только непереносимость к препаратам группы оксазолидинонов, а также возраст до 18 лет (безопасность и эффективность для данной возрастной группы не установлены) [2].
Заключение
Тедизолида фосфат обладает высокой активностью в отношении грамположительных микроорганизмов, в основном являющихся возбудителями ИКМТ, таких как S. aureus (штаммы S. aureus, в т.ч. устойчивые к метициллину), Str. pyogenes, Str. agalactiae, Str. anginosus и E. faecalis, включая штаммы, вырабатывающие механизмы устойчивости и ограничивающие применение линезолида.
Согласно систематическому обзору и мета-анализу, оценивавшему сравнительную эффективность тедизолида и других анти-MRSA-препаратов для лечения ИКМТ, вызванной MRSA, клинический ответ от тедизолида был выше, чем от ванкомицина, и не уступал линезолиду, даптомицину, тигециклину, цефтаролину и телаванцину [26]. Авторы аналитического обзора приходят к заключению: тедизолид может рассматриваться в качестве альтернативного варианта лечения серьезных инфекций кожи, вызванных MRSA-микроорганизмами [26].
Назначение данного антибактериального препарата по 200 мг (внутривенно или per os) 1 раз в сутки в течение 6 дней показало неменьшую эффективность по сравнению с 10-дневным курсом назначения линезолида (600 мг 2 раза в сутки) пациентам с ИКМТ, включенным в два исследования III фазы (ESTABLISH-1 и ESTABLISH-2).
Наряду с высокой клинической и микробиологической эффективностью новый представитель оксазолидинонов – тедизолида фосфат – демонстрирует хороший профиль безопасности и переносимости, в связи с чем может рассматриваться в качестве варианта лечения пациентов с оИКМТ в условиях амбулаторной практики или стационарного лечения.



