Введение
Рак желудка является одной из наиболее распространенных опухолей и занимает в России четвертое место в структуре онкологической заболеваемости и второе – в структуре онкологической смертности [1].
Преимущественным путем распространения рака желудка является лимфогенный, но возможны также и гематогенный, и имплантационный пути метастазирования. При классическом течении болезни первыми, как правило, поражаются регионарные (парагастральные) лимфатические узлы, затем лимфоузлы, сопровождающие крупные артерии, питающие желудок, затем забрюшинные лимфоузлы и органы брюшной полости. Гематогенные метастазы чаще всего реализовываются в печени, легких, реже в надпочечниках, костях, коже, еще реже в головном мозге.
Характерными отдаленными считаются метастазы Вирхова, располагающиеся в лимфатических узлах левой надключичной области, метастазы сестры Марии Жозеф (ретроградное лимфогенное метастазирование в пупок), метастазы Шницлера, определяющиеся в параректальной клетчатке тазового дна, метастазы Крукенберга – метастазирование в яичники, которые рассматривают не как гематогенные или имплантационные, а как лимфогенные, свидетельствующие о массивном поражении парааортального лимфатического коллектора. Помимо указанных локализаций метастазов рака желудка встречаются и другие – более редкие.
Метастазы в половой член – крайне редкая зона метастазирования злокачественных опухолей различных локализаций. Впервые метастазы в половой член были описаны C.J. Eberth в 1870 г. [2]. Первичная опухоль располагалась в прямой кишке. В настоящее время статистических данных о частоте встречаемости метастатического поражения полового члена нет, в мировой литературе представлено немногим более 500 клинических наблюдений, при этом более чем в двух третях случаев первичная опухоль локализовывалась в органах мочеполовой системы – преимущественно в предстательной железе и мочевом пузыре. Клинические проявления могут быть различными, но чаще наблюдаются пальпируемые опухолевые узлы, боль, вторичный приапизм. Обычно опухолевые узлы расположены глубоко в тканях полового члена и в отличие от рака полового члена не нарушают поверхностные слои кожи. По данным литературы, наличие метастазов в половом члене связано с агрессивным течением заболевания и плохим прогнозом для больного.
Приводим выписку из истории болезни пациента, страдавшего диссеминированным раком желудка, одной из локализаций метастазов у которого был половой член.
Клинический случай
Больной Ф. 71 года. В августе 2014 г. появились жалобы на общую слабость, снижение аппетита и снижение массы тела (на 27 кг за 4 месяца).
В ноябре 2014 г. присоединились боли в мезогастрии и впервые появление черного стула. Выполненная по месту жительства эзофагогастродуоденоскопия (ЭГДС) показала наличие опухоли в желудке. В декабре 2014 г. появились жалобы на непостоянные боли в половом члене, спустя неделю самостоятельно обнаружил уплотнения в головке, корне и теле полового члена, по поводу чего обратился к урологу по месту жительства, была диагностирована болезнь Пейрони.
При обследовании в РОНЦ, куда был направлен больной по поводу выявленной опухоли желудка, в январе 2015 г. при ЭГДС в желудке на уровне субкардиального отдела и тела определялось контактно кровоточащее циркулярное экзофитное образование плотной консистенции. Дистальная граница опухоли визуализировалась в нижней трети тела желудка. При гистологическом исследовании биоптата из опухоли выявлены комплексы низкодифференцированной аденокарциномы.
По данным рентгеновской компьютерной томографии (РКТ) выявлено утолщение стенок желудка до 1 см, а в области выходного отдела – до 2,5 см с распространением на парагастральную клетчатку. В брюшной полости визуализировались множественные лимфатические узлы: вдоль малой кривизны желудка – до 2,5 см, в области выходного отдела желудка – до 1,5–2,5 см, по ходу общей и собственно печеночной артерии – от 1,2 до 3,5 см, в панкреатодуоденальной зоне – 1,0–1,5 см.
В паренхиме печени контрастировались множественные метастазы от 0,5 до 2,5 см, наибольшие в субкапсулярных отделах S5 – 3,7 см, в S4b – 5,7×4,5 см. Также визуализировались забрюшинные лимфатические узлы до 1 см.
При ультразвуковом исследовании (УЗИ) в паховой области слева определен сóлидный лимфатический узел размером 2×1,4 см. В области корня полового члена с распространением на тело обнаружен инфильтрат размером до 7×2 см с активным кровотоком.
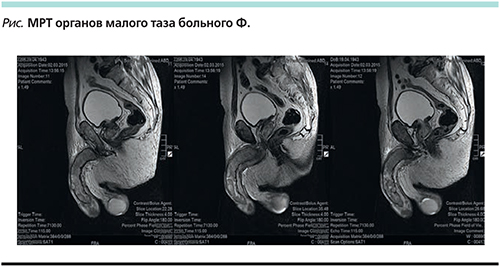
При магнитно-резонансной томографии (МРТ) органов малого таза и полового члена в мягких тканях полового члена визуализировались множественные узлы сливного характера. Опухолевой патологии других органов малого таза выявлено не было (см. рисунок).
При пальпации в толще тела полового члена определено несколько болезненных образований каменистой плотности диаметром от 5 до 20 мм, тесно прилегавших друг к другу. Кожа над ними была не изменена, за исключение очага в головке полового члена, над которым отмечена умеренная гиперемия кожи.
При пальцевом ректальном исследовании опухолевые образования в предстательной железе не пальпировались. Уровень маркера общего простатического специфического антигена не превышал допустимых значений и составил 0,76 нг/мл.
Для верификации образований в половом члене была выполнена их пункции, а в последующем – биопсия. При цитологическом исследовании пунктата получено заключение: аденокарцинома преимущественно папиллярного строения, при гистологическом исследовании – мелкие фрагменты тела полового члена с метастазом умеренно дифференцированной аденокарциномы желудка.
При иммуногистохимическом исследовании биоптата полового члена на HER2-статус получен положительный результат: 3+.
Таким образом, у больного была диагностирована HER2-позитивная низкодифференцированная аденокарцинома желудка с метастазами в печень, забрюшинные лимфатические узлы, половой член.
Сопутствующие заболевания: ишемическая болезнь сердца: атеросклеротический кардиосклероз. Атеросклероз коронарных артерий, сосудов головного мозга. Гипертоническая болезнь 3-й степени, 2-й стадии, риск 3. Варикозное расширение вен нижних конечностей. Хроническая железодефицитная анемия.
С учетом диссеминации опухолевого процесса с 02.02.2015 по 06.03.2015 больному провели 3 курса химиотерапии по схеме: оксалиплатин 85 мг/м2 внутривенно (в/в) капельно в 1-й день, лейковорин 200 мг/м2 в/в капельно в 1-й день, 5-фторурацил (5-ФУ) 2000 мг/м2 в/в в виде 48-часовой инфузии (доза 5-ФУ была исходно редуцирована с учетом возраста пациента и соматического статуса по шкале ECOG2 – Eastern Cooperative Oncology Group на момент начала лечения). Инфузии трастузумаба не были осуществлены в связи с отсутствием препарата. Лечение сопровождалось тошнотой и рвотой 2-й ст., несмотря на антиэметическую терапию.
На фоне проводимого лечения болевой синдром в области полового члена нарастал. Наряду с нестероидными противовоспалительными средствами пациенту был назначен трамадол по 100 мг до 3–4 раз в сутки внутримышечно. Однако болевой синдром не купировался, и с 10.03.2015 по 25.03.2015 с паллиативной целью был проведен курс дистанционной лучевой терапии на область полового члена (РОД 2,5–3 Гр, СОД 45 Гр), на фоне чего наблюдалось лишь незначительное уменьшение боли.
При контрольном обследовании после трех курсов химиотерапии первой линии выявлена отрицательная динамика в виде увеличения размеров метастазов в S4 печени с 5,7×4,5 до 7×5,2 см, в S5 – с 3,7 до 4,3 см, в забрюшинных лимфатических узлах до 3 см, а также появление очагов в легких размером до 0,7см, подозрительных на метастазы.
В связи c прогрессированием болезни 20.03.2015 проведен 1 курс химиотерапии второй линии иринотеканом в монорежиме в дозе 165 мг/м2. Лечение осложнилось выраженной астенией 3-й ст. в течение 1 недели, тошнотой и рвотой 2-й ст. Несмотря на проводимую терапию, пациент продолжал прогрессивно худеть: с начала химиотерапии отмечено снижение массы тела на 19%. В связи с подозрением на стеноз выходного отдела желудка была выполнена ЭГДС, при которой данных за стеноз желудка не получено, а клинические проявления (обильная рвота застойным содержимым) были, вероятно, обусловлены ригидностью стенок желудка и отсутствием нормальной перистальтики.
С учетом тяжелой переносимости иринотекана 9.04.2015 начата терапия паклитакселом в дозе 80 мг/м2 в 1-й, 8, 1-й дни каждые 28 дней, однако после одного введения пациент вновь отметил усиление слабости до 3-й ст., тошноту 2-й ст.
Терапия трастузумабом в нагрузочной дозе 8 мг/кг начата 15.04.2015, на фоне чего уже через неделю пациент отметил значительное уменьшение болевого синдрома, снижение потребности в обезболивающих препаратах, снижение частоты рвоты, улучшение аппетита и стабилизацию массы тела. Пальпируемые очаги в теле полового члена уменьшились, стали менее плотными, гиперемия над очагом в головке полового члена почти полностью исчезла.
Однако с 01.05.2015 появились жалобы на выраженную слабость, тошноту и обильную рвоту съеденной пищей. В связи с выявленным декомпенсированным стенозом выходного отдела желудка 10.05.2015 по месту жительства выполнена паллиативная операция – наложение гастро-энтеро- и энтеро-энтероанастомозов. Питание восстановилось, но сохранились жалобы на выраженную слабость, отсутствие аппетита, снижение массы тела, возобновились боли в паху. По данным УЗИ подтверждено прогрессирование болезни в виде увеличения размеров паховых лимфатических узлов слева до 2,2×2,1 и 1,5×1,1 см, а также метастазов в печени. Была рекомендована симптоматическая терапия. При осмотре пациента 13.07.2015: ECOG 3, жалобы на выраженную слабость, отсутствие аппетита, боли в эпигастрии и паховой областях.
28.07.2915 пациент умер от прогрессирования заболевания.
В данном случае ни один из проведенных режимов химиотерапии не оказал лечебного эффекта. Только после введения трастузумаба клинически наблюдалась кратковременная положительная динамика в виде уменьшения боли. Продолжительность жизни пациента от момента начала лечения составила 6 месяцев. Неэффективность химиотерапии в нашем клиническом наблюдении подтверждает данные мировой литературы о крайне неблагоприятном прогнозе для пациентов с метастазами в половой член.
Обсуждение
Как упоминалось выше, половой член является крайне редкой зоной метастазирования злокачественных новообразований. Как правило, источником метастазирования служат опухоли мочеполовой системы, в первую очередь предстательной железы [3–5], мочевого пузыря [6–8], реже почки (7% от описанных случаев) [9–11]. Описаны также случаи метастазирования в половой член злокачественных опухолей яичка, рака ректосигмоидного отдела толстой кишки [12–14], легкого [15–17], при гемобластозах [18, 19] и пр. В отдельных случаях злокачественная опухоль может манифестировать этим редким и иногда единственным проявлением болезни, приводя пациента к врачу. Наиболее часто метастазы в половой член встречаются среди мужчин 60–80 лет, сопровождая наиболее распространенные в этом возрасте опухолевые заболевания, такие как рак предстательной железы, прямой кишки, мочевого пузыря, а также могут быть и проявлением прогрессирования злокачественного процесса, по поводу которого пациент получал лечение несколько лет назад.
Для клинициста важно знать особенности проявления метастазов в половой член, чтобы своевременно проводить дифференциальный диагноз с другими заболеваниями как опухолевой, так и неопухолевой природы со сходными проявлениями.
При метастатическом поражении полового члена, как правило, отмечают глубокое расположение метастазов в обоих кавернозных телах (в 70% случаев), одностороннее поражение встречается намного реже. Губчатые тела и головка полового члена вовлекаются у 10% пациентов [20], а крайняя плоть – только у 5% больных [21–23]. Приапизм, также называемый злокачественным приапизмом, встречается, согласно наблюдениям, в 20–53% случаев [24–27].
Кожа над опухолевыми узлами в основном бывает неизмененной, смещаемой, отсутствует нарушение целостности кожных покровов. Наличие подобных симптомов и жалоб от больного требует проведения дифференциальной диагностики с некоторыми инфекционными заболеваниями, такими как туберкулез, сифилис, а также с болезнью Пейрони, незлокачественным приапизмом и первичным опухолевым процессом (рак полового члена, меланома, саркома).
Клинически метастатическое поражение полового члена проявляется различными вариантами дизурии. Наиболее часто встречается выраженный болевой синдром, плохо купирующийся в т.ч. и наркотическими анальгетиками, что и наблюдалось у нашего пациента.
С целью уточнения диагноза могут быть использованы УЗИ, МРТ органов малого таза. Окончательным этапом, безусловно, является биопсия образований полового члена с последующим гистологическим исследованием.
На сегодняшний день неясно, с чем связано достаточно редкое появление метастазов в половом члене. Теоретически с учетом хорошо развитой сети кровообращения органа имеются предпосылки для более частого его поражения. Существует несколько предположений, почему этого не происходит. По-видимому, ткани полового члена не являются подходящей «почвой» для фиксации и развития опухолевой клетки. Более того, хорошее сообщение между артериальным притоком и венозным оттоком может объяснять трудность фиксации опухолевой клетки в нормальных условиях. Однако при затруднении оттока при венозной или лимфатической окклюзии (например, при опухолях органов мочеполовой системы) процесс фиксации микрометастазов может быть облегчен. Венозный кровоток, по-видимому, является основным путем распространения метастазов в половой член.
Заключение
Метастазы злокачественных опухолей в половой член являются крайне редким проявлением онкологических заболеваний. Бóльшая часть описанных случаев относится к метастазам из опухолей органов малого таза, в первую очередь предстательной железы, мочевого пузыря и ректосигмоидного отдела толстой кишки.
Необходимо помнить, что появление плотных каменистой плотности узлов в тканях полового члена у лиц с онкологическими заболеваниями в анамнезе может указывать на прогрессирование опухоли.
Окончательный диагноз устанавливается по результатам гистологического исследования биоптата. Прогноз для больных с метастазами в половой член остается неблагоприятным. Локальные методы лечения, как правило, малоэффективны. При наличии молекулярно-генетических маркеров перспективно изучение таргетной терапии.



