Ежегодный рост распространенности саркоидоза среди лиц прежде всего трудоспособного возраста определяет актуальность дальнейшего совершенствования диагностики этого заболевания [1–5]. Клинической особенностью саркоидоза является высокая частота его хронического прогрессирующего течения, трудность диагностики. Являясь одной из форм интерстициальных болезней легких (ИБЛ), саркоидоз относится к нозологиям с неустановленной этиологией. Его морфологический субстрат представлен гранулематозным неказеозным воспалением, охватывающим различные структурные элементы респираторного тракта, легочного интерстиция, что в итоге приводит к формированию легочного фиброза и дыхательной недостаточности [1, 2, 6].
Сложность оценки активности саркоидоза обусловлена скудностью клинической картины в начальной стадии заболевания, на которой отсутствуют патогномоничные клинические признаки активности процесса.
В настоящее время стандарт диагностики ИБЛ предусматривает учет совокупности результатов основных методов исследования, к которым относятся рентгенологические, морфологические и лабораторные [1, 3, 7–11]. Несмотря на важность каждого из указанных направлений именно лабораторное звено привлекает сейчас особое внимание ученых и клиницистов. По-видимому, впервые в истории внутренних болезней в один ряд, а в определенной степени и наравне с морфологическими, в т.ч. иммуногистохимическими, методами может встать серологическое определение альвеолярных протеинов, концентрации разновидностей которых в сыворотке крови предположительно могут дать ответ на вопрос о наличии неспецифического легочного воспаления.
Кроме того, поиск именно лабораторных методов исследования занимает особое место в комплексной диагностике ИЛФ, саркоидоза, т.к. именно биологические маркеры отражают параметры, которыми оперирует медицина, основанная на доказательствах, требуют малоинвазивного забора биологических жидкостей (например, крови, мокроты), могут служить основой для проведения таргетной терапии [12, 13]. В настоящее время с этой целью определяют активность ангиотензинпревращающего фермента (АПФ), т.к. его продуцирует саркоидозная гранулема, хотя он не может в полной мере рассматриваться в качестве показателя активности альвеолита в силу низкой специфичности [14–16]. Ряд исследователей показали способность сурфактантных белков отражать процессы легочного повреждения при легочном фиброзе, в т.ч. при системных заболеваниях. Однако до сих пор не было работ, посвященных исследованию этих протеинов на больных саркоидозом. Вместе с тем наиболее изучаемыми в настоящее время представляются муцины – производные альвеолоцитов второго порядка, которые, по данным разных авторов, отражают активность воспаления в легочном интерстиции, на территории альвеоло-капиллярного барьера, а также выраженность процессов формирования фиброза [17, 18]. В качестве одних из наиболее перспективных обсуждаются сурфактантные протеины SP-A и SP-D [19].
В связи с вышеизложенным была сформулирована цель данного исследования – изучить клиническое значение SP-A и SP-D в оценке активности саркоидоза легких, для решения которой были поставлены следующие задачи:
- Определить уровни SP-A, SP-D и активность АПФ в сыворотке больных хроническим саркоидозом легких.
- Провести сравнение показателей SP-A, SP-D и АПФ.
- Сопоставить полученные результаты с рентгенологическими данными.
Материал и методы
В исследование был включен 41 пациент (13 мужчин и 28 женщин) с морфологически подтвержденным саркоидозом хронического течения в возрасте от 24 до 68 лет, средний возраст больных составил 48,5±14,6 года.
Критерии включения в исследование:
- возраст пациента 18–70 лет;
- наличие добровольного информированного согласия;
- морфологическое подтверждение диагноза саркоидоза;
- клинико-рентгенологическая фаза активности заболевания;
- статус некурящего;
- отсутствие медикаментозного лечения, в т.ч. глюкокортикостероидами и цитостатическими препаратами.
Критерии исключения:
- саркоидоз с изолированным поражением внутригрудных лимфатических узлов;
- сопутствующая патология органов дыхания (хроническая обструктивная болезнь легких, бронхиальная астма), бронхолегочные инфекции;
- артериальная гипертензия;
- онкологические заболевания;
- врожденные или приобретенные пороки сердца;
- хроническая левожелудочковая сердечная недостаточность;
- нарушение мозгового кровообращения;
- статус курящего.
Саркоидоз (в т.ч. фазу его активности) диагностировали согласно федеральным согласительным клиническим рекомендациям [1]. Больные саркоидозом с признаками активности в виде альвеолита (рентгенологический симптом «матового стекла») составили группу I (n=21), больные саркоидозом в фазе активности в виде прогрессирующего фиброза были включены в группу II (n=20). В контрольную группу вошли 20 человек, сопоставимых по возрасту с обследованными пациентами, проходившими диспансерное обследование и признанные здоровыми.
Всем больным проведено стандартное клинико-лабораторное и инструментальное обследования, включившее сбор анамнеза, физическое обследование, клинический и биохимический анализы крови, мультиспиральную компьютерную томографию (КТ) органов грудной клетки в режиме высокого разрешения, легочные функциональные тесты (спирография, диффузионная способность легких – Dlco, сатурация кислорода методом пульсоксиметрии).
КТ-проявления активности ИБЛ в виде альвеолита оценивали по наличию рентгенологического феномена «матового стекла», а прогрессирование легочного фиброза – по увеличению площади фиброза (с 20 до 50%) за год наблюдения. В группе I наряду с феноменом «матового стекла» регистрировали минимально выраженный легочный фиброз, составлявший менее 20% площади легких.
В сыворотке крови определено содержание сурфактантных протеинов SP-A и SP-D методом иммуноферментного твердофазного анализа (ELISA), активность АПФ – калориметрическим методом.
Статистическая обработка данных проведена в программе STATIATICA Advanced [20]. Параметры, характеризующие все группы обследованных лиц, имели ненормальное распределение, в связи с чем описывались непараметрическими методами. Нормальность распределения определена по критериям Колмогорова–Смирнова и по критериям Лиллиефорса [21].
Методы сравнения независимых групп проведены по методам Колмогорова–Смирнова и Манна–Уитни, достоверными считались результаты при p<0,05. Сочетание качественных и количественных показателей определило необходимость использования обоих методов статистического анализа.
Результаты
Среди основных клинических проявлений кашель и одышка преобладали с достоверно более высокой частотой в группе II – у пациентов с прогрессирующим фиброзом легких. В то же время крепитация достоверно чаще регистрировалась в группе I – у больных с альвеолитом. У большинства пациентов в обеих группах отмечены внелегочные проявления, самым частым из которых был суставной синдром, достоверное увеличение частоты которого наблюдали в группе I (табл. 1).
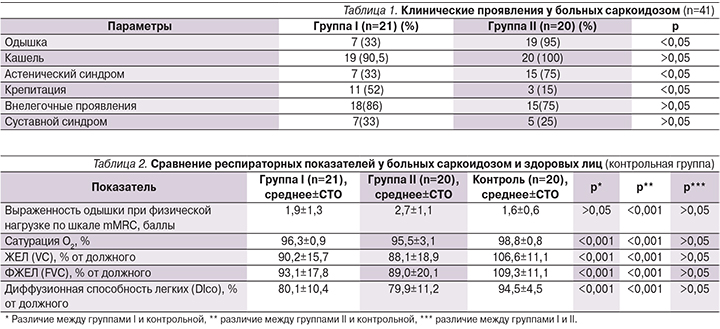
Респираторные показатели больных обеих групп были достоверно ниже, чем в контрольной группе (p<0,001), за исключением выраженности одышки в группе I (p>0,05). Однако при сравнении респираторных показателей у обследованных пациентов не было получено достоверных различий между группами больных саркоидозом (p>0,05, табл. 2).
У всех больных саркоидозом выявлено достоверное повышение уровней SP-A, SP-D и активности АПФ по сравнению с контрольной группой. Наибольшее повышение уровня SP-A отмечено в группе I (активный альвеолит), в группе II (прогрессирование легочного фиброза) регистрировали максимальное повышение содержания SP-D. Активность АПФ была одинаково повышенной в обеих группах больных саркоидозом, при этом сывороточный уровень креатинина оставался в нормальных пределах у всех обследованных пациентов (табл. 3). Различия между повышением уровней SP-A и SP-D в группах больных были также достоверныии (p<0,05); так, в группе I отмечены максимально высокие показатели SP-A, тогда как самые высокие значения SP-D имели место во II группе (табл. 4).
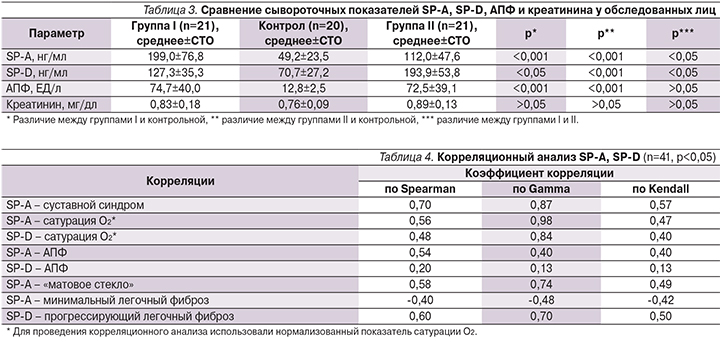
Корреляционный анализ подтвердил полученные результаты, показав сильные прямые связи сурфактантных белков SP-A и SP-D с рентгенологическим проявлением альвеолита – феноменом «матового стекла» (SP-A), нормализованным показателем сатурации кислорода (SP-A и SP-D), суставным синдромом (SP-A), прогрессирующим легочным фиброзом (SP-D). Отмечены тенденции к формированию прямой зависимости между SP-A и АПФ, обратной связи между SP-A и минимальным легочным фиброзом.
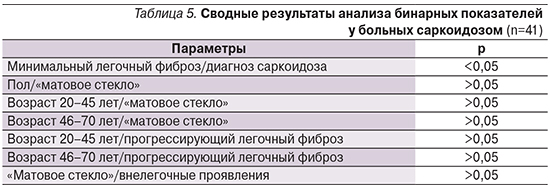
Методом анализа таблиц сопряженности характеризовали качественные параметры, исследованные в группах больных. Для оценки взаимосвязи были выбраны бинарные показатели, по каждой паре проведен статистический анализ по методу Пирсона (табл. 5). Анализ бинарных показателей выявил зависимость между наличием саркоидоза и формированием минимального легочного фиброза, при этом связи с возрастом, в т.ч. при распределении по возрастным категориям, выявлено не было.
Обсуждение
Полученные результаты позволяют обсуждать вполне определенное диагностическое значение сурфактантных протеинов SP-A и SP-D у больных хроническим саркоидозом легких, в т.ч. имеющих внелегочные проявления заболевания. Так, повышение уровня SP-A в большей степени ассоциировалось со стадией альвеолита, а умеренное прогрессирование легочного фиброза, характерное для саркоидоза, имело прямую связь с повышением концентрации SP-D.
Важно отметить, что содержание SP-A повышается до того, как начинают снижаться спирометрические показатели, а увеличение уровня SP-D коррелировало с прогрессированием легочного фиброза. Клинически значимым оказалось формирование легочного фиброза (>0,05).
Диагностика саркоидоза и оценка его активности традиционно проводятся путем сопоставления комплекса клинических, морфологических, ренгенологических и лабораторных показателей. Это объясняется отсутствием типичных, характерных только для саркоидоза диагностических критериев [1, 3].
Вместе с тем лабораторные методы исследования рассматриваются как важнейшее звено в верификации саркоидоза, его активности, т.к. именно биологические маркеры отражают «совокупное бремя» гранулематозного воспаления, могут быть исследованы в динамике, требуют малоинвазивного забора биологических жидкостей (например, крови). Их целевые назначения могут быть диагностическими, мониторинговыми, стратификационными. Они, как правило, коррелируют с другими лучевыми, морфологическими, а главное – клиническими методами, что, несомненно, придает биомаркерам особое значение [12, 13].
Диагностически и прогностически при саркоидозе важно определить наличие и выраженность воспаления на уровне терминальных респираторных отделов, легочного интерстиция, что представляет сегодня диагностическую трудность, т.к. рентгенологические и спирометрические методы позволяют лишь предположить их наличие уже на клинически развернутых стадиях [22]. В связи с этим полученные результаты в отношении сурфактантных белков SP-A и SP-D, повышение концентрации которых прямо коррелирует с клиническими, морфологическими и рентгенологическими признаками активности и прогрессирования хронического саркоидоза, позволят оптимизировать патогенетическую терапию глюкокортикостероидами и антифибротическими препаратами.
Выводы
- У больных хроническим саркоидозом легких в фазе активности отмечено достоверное повышение уровней SP-A, SP-D и активности АПФ по сравнению с контрольной группой (p<0,001).
- Повышение уровня SP-A коррелирует с рентгенологическим симптомом «матового стекла», отражающим стадию альвеолита (p<0,05).
- При прогрессировании легочного фиброза до более 20% от площади легочной ткани отмечается повышение уровня SP-D (p<0,05).
- Активность АПФ не коррелирует с рентгенологическими феноменами, отражающими альвеолит (p>0,05) и прогрессирующий легочный фиброз (p>0,05).



