В 2009 г. исполняется ровно 25 лет с момента открытия белковой структуры, названной поверхностным антигеном (HBsAg) вируса, ответственного за развитие острого сывороточного гепатита, впоследствии названного вирусным гепатитом В [1, 2]. Вирус (HBV), содержащий ДНК и покрытый нуклеокапсидной оболочкой, оказался причиной большинства случаев хронических форм гепатита В, цирроза печени и гепатоцеллюлярной карциномы в странах Юго-Восточной Азии и Дальнего Востока, некоторых регионах Африки и Латинской Америки [3, 4]. С точки зрения медико-социальных последствий этот вирус весьма значим и для некоторых территорий России (Приамурье, Республики Саха – Якутия, Бурятия, Тыва, районы Дальнего Востока, некоторые республики Северного Кавказа), где его персистенция среди коренного населения значительно превышает среднепопуляционые российские показатели [5]. И хотя внедрение массовой вакцинации населения во многих регионах России позволило существенно снизить регистрацию случаев острого гепатита, число ежегодно регистрируемых хронических форм вирусного гепатита В достоверно не уменьшается, что говорит о некоем “постоянном” резервуаре хронической HBV-инфекции, являющемся основным популяционным субстратом пополнения новых случаев заражения, формирования таких продвинутых стадий заболевания, как цирроз печени и гепатоцеллюлярная карцинома.
Двадцатипятилетний опыт изучения HBV-инфекции позволил достаточно детально охарактеризовать его тонкую биологию; уже достаточно известно о механизмах его репликации и интеграции в ядерные структуры клетки, накоплены определенные подходы к лечению.
Современные представления об HBV-инфекции позволили сформулировать несколько постулатов:
- Характер естественного течения HBV-инфекции во многом зависит от возраста на момент инфицирования и механизмов инфицирования (формирование большего числа хронических форм гепатита В и выраженное прогрессирование заболевание в цирроз и гепатоцеллюлярную карциному, если инфицирование происходит перинатально или в раннем детском возрасте).
- Прогрессирование хронического гепатита В (ХГВ) ассоциировано с уровнем вирусной нагрузки.
- В ядре инфицированной клетки вирус существует в виде универсальной кольцевидной структуры – кольцевидной ДНК; для постоянно поддерживаемой репликации вирусу в принципе не требуется большой массы инфицированных гепатоцитов – репликация HBV может поддерживаться даже одной инфицированной клеткой.
- Уровень вирусной репликации, а значит, и темпы прогрессирования хронического гепатита существенно выше у пациентов с носительством HBeAg.
- Результаты противовирусного лечения ХГВ в настоящее время можно в целом назвать эффективными лишь в отношении контроля репликации вируса, но не его элиминации.
- По-видимому, самым важным критерием эффективности проводимого противовирусного лечения является исчезновение HBsAg и появление anti-HBs, состояние, ассоциированное если не с полной элиминацией вируса, то уж точно со стойким и длительным подавлением репликации HBV и минимизацией морфологического прогрессирования ХГВ.
- Принципиальной и важной характеристикой естественного течения ХГВ является возможность спонтанной потери HBsAg: приблизительно 3–5 % в популяции за период пятилетнего наблюдения.
 Отдельного внимания заслуживает освещение проблемы эволюции противовирусного лечения HBV-инфекции и ее современное состояние. Одними из первых противовирусных препаратов, использованных в лечении ХГВ, были “короткие” интерфероны альфа. К настоящему моменту достаточно хорошо изучен профиль их безопасности и эффективности как при HBeAg-позитивном, так и при HBeAg-негативном вариантах ХГВ. В целом исследование клинической эффективности лечения ХГВ характеризовалось возможностью достижения исчезновения HBeAg при его позитивных вариантах приблизительно в 35–45 % случаев; состоявшаяся сероконверсия к концу терапии составляла приблизительно 28–30 % [6]. Основными критериями эффективности лечения HBeAg-негативного варианта ХГВ при лечении “короткими” интерферонами альфа были и остаются уровни HBV DNA и аланиновой трансаминазы (АЛТ). При этом отмечена чрезвычайно высокая вероятность развития рецидива после окончания курса интерферонотерапии. При этом следует подчеркнуть, что терапия “короткими” интерферонами осуществляется фиксированным курсом в течение 24–48 недель в дозе 5–6 млн МЕ подкожно в ежедневном режиме.
Отдельного внимания заслуживает освещение проблемы эволюции противовирусного лечения HBV-инфекции и ее современное состояние. Одними из первых противовирусных препаратов, использованных в лечении ХГВ, были “короткие” интерфероны альфа. К настоящему моменту достаточно хорошо изучен профиль их безопасности и эффективности как при HBeAg-позитивном, так и при HBeAg-негативном вариантах ХГВ. В целом исследование клинической эффективности лечения ХГВ характеризовалось возможностью достижения исчезновения HBeAg при его позитивных вариантах приблизительно в 35–45 % случаев; состоявшаяся сероконверсия к концу терапии составляла приблизительно 28–30 % [6]. Основными критериями эффективности лечения HBeAg-негативного варианта ХГВ при лечении “короткими” интерферонами альфа были и остаются уровни HBV DNA и аланиновой трансаминазы (АЛТ). При этом отмечена чрезвычайно высокая вероятность развития рецидива после окончания курса интерферонотерапии. При этом следует подчеркнуть, что терапия “короткими” интерферонами осуществляется фиксированным курсом в течение 24–48 недель в дозе 5–6 млн МЕ подкожно в ежедневном режиме.
Следующим этапом в эволюции противовирусного лечения гепатита В явилось использование нуклеоз(т)идных аналогов. Эти препараты достаточно быстро и эффективно подавляли репликацию HBV DNA in vitro, однако их использование на практике ассоциировано с одной весьма важной для гепатита В ситуацией – формированием генетической устойчивости (мутации), связанной с более или менее длительным их использованием у пациентов с ХГВ. Кроме того, эффективность этих препаратов может быть охарактеризована как таковая текущего момента: они эффективны пока назначаются, их отмена (равно как и развитие резистентности) может быть ассоциирована с развитием обострения гепатита, что может быть чрезвычайно опасным, например, на стадии цирроза печени. С другой стороны, это препараты с достаточно хорошим профилем переносимости, удобной формой применения, быстрым противовирусным действием, что делает их практически незаменимыми у пациентов с циррозом печени.
 Еще одним из принципиально новых подходов в процессе эволюции противовирусного лечения ХГВ было использование пегилированных интерферонов альфа. Наиболее изученным и апробированным среди наибольшего количества пациентов является пегилированный интерферон альфа-2а (40 кДа; Пегасис). Использование Пегасиса во всех клинических исследованиях было ассоциировано с достоверно большей частотой сероконверсии по HBeAg в сравнении с “короткими” интерферонами у позитивных пациентов и меньшей частотой рецидива гепатита после окончания курса терапии у HBeAg-негативных больных [7, 8]. Кроме того, было продемонстрировано, что комбинированное использование Пегасиса с нуклеозидным аналогом ламивудином в стандартной дозировке не имело никакого преимущества ни с точки зрения клинической эффективности, ни в плане безопасности перед монотерапией Пегасисом, используемой в стандартной дозировке 180 мкг один раз в неделю в течение 48 недель.
Еще одним из принципиально новых подходов в процессе эволюции противовирусного лечения ХГВ было использование пегилированных интерферонов альфа. Наиболее изученным и апробированным среди наибольшего количества пациентов является пегилированный интерферон альфа-2а (40 кДа; Пегасис). Использование Пегасиса во всех клинических исследованиях было ассоциировано с достоверно большей частотой сероконверсии по HBeAg в сравнении с “короткими” интерферонами у позитивных пациентов и меньшей частотой рецидива гепатита после окончания курса терапии у HBeAg-негативных больных [7, 8]. Кроме того, было продемонстрировано, что комбинированное использование Пегасиса с нуклеозидным аналогом ламивудином в стандартной дозировке не имело никакого преимущества ни с точки зрения клинической эффективности, ни в плане безопасности перед монотерапией Пегасисом, используемой в стандартной дозировке 180 мкг один раз в неделю в течение 48 недель.
Международный опыт противовирусного лечения ХГВ к настоящему времени суммирован в международных рекомендациях трех крупнейших медицинских сообществ, занимающихся проблемами изучения болезни печени (EASL 2009, AASLD 2009, APASL 2009).
Что является принципиально общим в этих нормативных документах?
- Решение о проведении противовирусного лечения должно приниматься в каждом конкретном случае с обязательным учетом таких параметров, как вирусная нагрузка (> 2000 МЕ/мл как при HBeAg-позитивных, так и при HBeAg-негативных формах ХГВ), уровень АЛТ, морфологическая характеристика гепатита (решение о начале противовирусной терапии больше определяется гистологической активностью, нежели фиброзом).
- Официально зарегистрированными препаратами “первой” линии в терапии ХГВ являются пегилированные интерфероны альфа и нуклеоз(т)идные аналоги энтекавир и тенофовир, как обладающие наибольшим противовирусным действием и характеризующиеся наименьшим риском развития специфических мутаций.
- Очевидно, что назначение нуклеоз(т)идных аналогов предпочтительнее у пациентов с продвинутыми стадиями заболевания, ожидающих трансплантации и в посттрансплантационном периоде. Нет альтернативы этим препаратам и в популяции пациентов, в которых высок риск реактивации ХГВ в процессе иммуносупрессивной или полихимиотерапии по поводу системных и онкологических заболеваний.
- Назначение пегилированных интерферонов показано молодым пациентам с невысокой степенью фиброза.
- И для нуклеоз(т)идных аналогов, и для пегилированных интерфернов альфа важными прогностическими критериями стойкого подавления HBV DNA как основного показателя эффективного лечения являются исходный уровень вирусной нагрузки (труднее и хуже поддаются лечению пациенты с высокой виремией) и уровень АЛТ (наилучшие результаты противовирусного лечения в группе пациентов с уровнем АЛТ от 2,5 до 5,0 норм).
При этом подчеркиваются значительные отличия в механизмах противовирусного действия пегилированных интерферонов альфа и нуклеоз(т)идных аналогов; и если первые из них обладают иммуномодулирующим и противовирусным действиями, то вторая группа лекарственных средств характеризуется только прямым противовирусным действием. Что может стоять за этими важными различиями? Вероятно, разный результат лечения. Особенно интересными оказались “отсроченные” результаты лечения ХГВ, проанализированные через несколько лет после окончания фиксированного курса использования пегилированного интерферона альфа-2а (Пегасис). Данные об отсроченной эффективности противовирусного лечения ХГВ Пегасисом базируются на больших многоцентровых плаце-бо-контролируемых международных исследованиях [9, 10]. Одним из важнейших результатов проанализированных исследований, касающихся использования Пегасиса у пациентов с ХГВ, стала оценка количественного содержания HBsAg в процессе проводимого противовирусного лечения. В самом деле, почему именно количественное определение HBsAg, по мнению ряда исследователей, может стать новым инструментом прогнозирования эффективного противовирусного лечения ХГВ, в частности при использовании пегилированных интерфернов альфа? Почему в этом смысле нас перестал устраивать такой уже ставший достаточно традиционным критерий, как уровень HBV DNA? И вообще, как соотносятся эти два параметра, что может отражать на самом деле каждый из них?
Как уже было показано ранее, особенность развития ХГВ состоит в том, что для репликации вирусу в принципе нет необходимости постоянно поддерживать некий пул все новых инфицируемых клеток. Генетический материал вируса гепатита В существует в виде интегрированной в ядро гепатоцита структуры, называемой кольцевидно закрученной ДНК (cccDNA). Именно эта структура является основным источником воспроизводства все новых копий вируса. И в принципе возможность ее количественного определения могла бы наиболее объективно отражать “степень инфицированности” гепатоцитов. Однако к настоящему времени у нас еще нет коммерческих тест-систем, позволяющих определять содержание cccDNA. Исследования репликации вируса гепатита В позволили констатировать, что именно HBsAg, а не HBV DNA наиболее тесно связан с сccDNA, поэтому именно количественное определение HBsAg могло бы теоретически отражать в т. ч. и эффективность проводимого противовирусного лечения, особенно при использовании интерферонов альфа, когда мы рассчитываем на иммуномодулирующий эффект и связанный с этим возможный клиренс вируса, по-видимому ассоциирующийся не только с исчезновением HBsAg, но и с появлением anti-HBs [3].
Одним из интереснейших исследований, характеризующих динамическое количественное определение HBsAg у пациентов с хроническим гепатитом В, стала работа Moucari и соавт., опубликованная в 2009 г. [10]. В исследование были включены 48 HBeAg-негативных пациентов, получавших терапию пегилированным интерфероном альфа-2а (Пегасис) в стандартной дозе 180 мкг один раз в неделю.

В качестве основного критерия эффективности оценивалось количественное содержание HBV DNA в конце терапии: пациент, продемонстрировавший вирусологический ответ к 48-й неделе лечения, должен был иметь неопределяемый уровень HBV DNA при оценке методом ПЦР. При этом, по мнению авторов исследования, устойчивый вирусологический ответ трактовался как неопределяемый уровень HBV DNA через 24 недели после окончания терапии. Хотя в этом отношении можно было бы и подискутировать, ведь, например, дефиниция “устойчивый вирусологический ответ” у пациента с хроническим гепатитом С фактически равнозначна термину “выздоровление”, поэтому дефиниция “устойчивый вирусологический ответ” у пациентов с ХГВ должна, на наш взгляд, включать не только стабильное исчезновение HBV DNA из биологических сред организма, но и появление anti-HBs. В ином варианте, вероятно, корректнее использовать термин “длительно сохраняющийся отрицательный результат определения HBV DNA”. Период последующего наблюдения за пациентами, включенными в данное исследование, составил 48 недель.
В качестве методов исследования использовались:
- HBV-генотипирование: TRUGENE HBV – genotype kit.
- Количественное определение HBV DNA сыворотки: TaqMan PCR (COBAS TaqMan, Roche Molecular System; нижний порог определения составил 70 копий/мл).
- Количественное определение HBsAg сыворотки: Abbot Architect HBsAg QT assay; порог определения составил 0,05–125000 МЕ/мл.
Все исследования выполнены на старте терапии, а также на 12-й, 24-й и 48-й неделях терапии; в периоде последующего наблюдения – на 72-й и 96-й неделях.
В табл. 1 представлена общая клиническая характеристика пациентов.
Как следует из данных таблицы, это были достаточно молодые больные, негативные по HBeAg; преобладали европейцы (что очень важно при оценке результативности терапии, поскольку основные исследования по лечению HBV-инфекции чаще экстраполируются на монголоидную, в частности китайскую, популяцию).
У всех этих пациентов был повышенный уровень АЛТ, составлявший в среднем 98 МЕ/мл. Среди определенных на старте лечения генотипов HBV преобладали генотипы А (27 %) и D (29 %). Количественное определение HBV DNA соответствовало достаточно высоким значениям и составило в среднем 7,0 log копий/мл.
Морфологическое исследование продемонстрировало довольно высокие показатели ИГА более чем у половины больных, а признаки формирующегося цирроза печени (индекс фиброза – F3–F4) были выявлены у половины пациентов. Таким образом, в исследование были включены пациенты с HBeAg-негативным вариантом ХГВ, имевшие все показания к проведению противовирусного лечения. Результаты проведенного противовирусного лечения обозначенной популяции лиц Пегасисом в дозировке 180 мкг однократно в неделю на протяжении 48 недель были следующими: неопределяемый уровень HBV DNA в конце лечения отмечен у 30 из 48 пациентов (62 %), через 24 недели после завершения лечения отрицательные значения HBV DNA имели место у 12 из 48 человек (25 %). Чрезвычайно интересными оказались результаты исследования HBV DNA среди пациентов со стойко отрицательными результатами определения этого показателя (устойчивый вирусологический ответ – УВО) и больных, не ответивших на лечение (НО), а также пациентов с рецидивом. Согласно данным, представленным на рис. 1, различие в уровне HBV DNA между группами УВО и НО начинает определяться только с 12-й недели лечения, и только к 24-й неделе терапии мы можем корректно выделить группу пациентов, не ответивших на терапию. На рис. 2 отражена динамика HBV DNA у пациентов с УВО и больных с рецидивом. Эти данные указывают на невозможность прогнозирования по этому показателю УВО и рецидива до 48-й недели терапии (до окончания лечения). И только в период последующего наблюдения, согласно результатам количественного определения HBV DNA, “формируется” группа пациентов, продемонстрировавших рецидив в виде возобновления репликации и возвращения к исходным показателям гистологической активности и фиброза.
 На рис. 3 и 4 отражена динамика количественного определения уровня HBsAg у пациентов в ранее обсуждавшихся группах. Согласно полученным результатам, количественное определение HBsAg позволило уже с первых дней терапии выявить существенную разницу в указанном показателе в группе УВО по сравнению с пациентами, не ответившими на терапию, и теми, у кого развился рецидив. Иными словами, именно количественное определение HBsAg может иметь прогностическую ценность в отношении эффективности противовирусной терапии ХГВ с использованием пегилированного интерферона альфа-2а (Пегасис).
На рис. 3 и 4 отражена динамика количественного определения уровня HBsAg у пациентов в ранее обсуждавшихся группах. Согласно полученным результатам, количественное определение HBsAg позволило уже с первых дней терапии выявить существенную разницу в указанном показателе в группе УВО по сравнению с пациентами, не ответившими на терапию, и теми, у кого развился рецидив. Иными словами, именно количественное определение HBsAg может иметь прогностическую ценность в отношении эффективности противовирусной терапии ХГВ с использованием пегилированного интерферона альфа-2а (Пегасис).
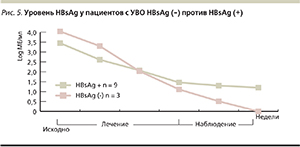
На основании полученных в исследовании результатов было установлено, что снижение уровня HBsAg к 12-й неделе лечения не менее чем на 0,5 log МЕ/мл обладает достоверно значимой прогностической значимостью в отношении эффективности противовирусного лечения ХГБ, равно как и снижение уровня HBsAg на 1 log МЕ/мл к 24-й неделе терапии. При этом, согласно данным, представленным на рис. 5, только количественное определение HBsAg на 24-й неделе терапии пегилированным интерфероном альфа-2а позволяет выделить группы с достоверно различной кинетикой HBsAg, а значит, предсказать возможность элиминации HBsAg. Аналогичные результаты были получены и в другом исследовании по оценке результатов противовирусного лечения ХГВ с использованием пегилированного интерферона альфа-2а [11]. Более того, в данной работе установлено, что уровень HBsAg к 48-й неделе лечения позволяет прогнозировать вероятность его дальнейшего исчезновения. Оказалось, что в группе пациентов, у которых уровень HBsAg к 48-й неделе лечения снизился по сравнению с исходным более чем на 2 log МЕ/мл, вероятность его исчезновения в течение последующих 3 лет составляет 42 %, а в группе больных с меньшими темпами снижения HBsAg – только 3 %. Абсолютный уровень HBsAg менее 10 МЕ/мл к 48-й неделе лечения – еще один важнейший критерий элиминации HBsAg в предстоящие 3 года: более половины (52 %) из таких пациентов станут негативными по HBsAg.
Еще один очень интересный результат получен в процессе изучения кинетики HBsAg на фоне лечения пегилированным интерфероном альфа-2а у пациентов с различными генотипами HBV. Вероятность стойкого исчезновения HBsAg при длительном наблюдении оказалась практически одинаковой у пациентов с генотипом D (традиционно широко распространенным в России и труднее поддающимся терапии интерферонами альфа) и больных, имеющих генотипы А и С.
Изучение предикторов исчезновения HBsAg после 3 лет наблюдения у пациентов с ХГВ на фоне терапии пегилированным интерфероном альфа-2а с использованием метода множественного регрессионного анализа позволили выявить очень важный параметр – снижение уровня HBsAg на 1 log МЕ/мл и более к 48-й неделе терапии по сравнению с исходным. Этот параметр обладает достоверной предсказуемостью в отношении исчезновения HBsAg – критерия, при ХГВ наиболее приближенного к понятию “выздоровление” (табл. 2).
Таким образом, на основании результатов в рассмотренных исследованиях становятся очевидными следующие важные позиции:
- Лечение ХГВ пегилированным интерфероном альфа-2а (Пегасис) должно рассматриваться как терапия первой линии у молодых пациентов без признаков декомпенсации заболевания.
- Терапия ХГВ Пегасисом характеризуется на сегодняшний день достоверно наибольшей частотой достижения элиминации HBsAg и появления anti-HBs, что связано не только с прямым противовирусным действием препарата, но и с его способностью влиять на иммунный ответ.
- Количественное определение HBsAg в процессе лечения ХГВ является новым инструментом прогнозирования эффективности противовирусной терапии с использованием пегилированного интерферона альфа-2а.



