Обоснование
Во всем мире сахарный диабет типа 2 (СД2) является значимой социально-экономической проблемой. Пациенты с СД2 составляют от 85 до 90% больных диабетом. Заболеваемость СД2 неуклонно растет и значительно опережает другие неинфекционные патологии [1, 2].
Кроме того, СД – это не только хроническое заболевание, но и риск смерти людей достаточно молодого возраста. Установлено, что смертность от СД занимает четвертое место среди причин ранней смертности.
Согласно данным исследования NATION, общее число больных СД в России составляет 5,4% от общей численности населения. У одной пятой населения выявлен преддиабет. Доказано, что уже на этом этапе нарушения углеводного обмена отмечается высокий сердечно-сосудистый риск [3].
Согласно этиологической классификации СД, предложенной экспертами Всемирной организации здравоохранения в 1999 г., СД2 может быть с преобладанием дефектов секреции инсулина или с выраженной инсулинорезистентностью (ИР), или без нее, а также с преобладанием ИР и относительной инсулиновой недостаточностью. Дефекты секреции инсулина часто обусловлены генетической предрасположенностью, диагностировать которую не всегда представляется возможным. Развитие периферической ИР в значительной мере обусловлено приобретенными факторами, хотя генетические маркеры также могут иметь влияние на развитие ИР или ее прогрессирование.
Большое значение в развитии СД2 отводится факторам рискам (ФР), которые подразделяют на модифицируемые и немодифицируемые [4].
К ним относят:
- • возраст старше 45 лет;
- • избыточная масса тела и ожирение (индекс массы тела ≥25 кг/м²);
- • отягощенный семейный анамнез (родители или сибсы с СД2);
- • низкая физическая активность;
- • нарушение толерантности к глюкозе или гликемии натощак;
- • гестационный СД или рождение крупного плода в анамнезе;
- • артериальная гипертензия (≥ 140/90 мм рт.ст. или медикаментозная антигипертензивная терапия);
- • холестерин липопротеинов высокой плотности ≤0,9 ммоль/л и/или уровень триглицеридов ≥2,82 ммоль/л;
- • синдром поликистозных яичников;
- • сердечно-сосудистые заболевания в анамнезе.
Среди ФР ведущими признаны избыточная масса тела и ожирение, особенно висцеральное [5, 6].
Нарушение углеводного обмена с развитием СД2 часто сочетается с ожирением. Жировые клетки висцеральной области обладают высокой метаболической активностью. Избыточное отложение жира в адипоцитах висцеральной области ведет к повышению уровня триглицеридов в портальной крови и развитию гепатоза, нарушению свертывающей системы, избыточной продукции ангио-тензина II, высокой цитокиновой активности. Избыток жировой ткани ассоциируется с повышенной секрецией адипоцитокинов, влияющих на метаболические процессы. По мере прогрессирования ожирения не только увеличивается размер и количество адипоцитов, но и изменяется их функциональная активность. Как следствие – развивается дисбаланс адипоцитокинов, регулирующих чувствительность рецепторов тканей к инсулину [6, 7]. Секреция адипокинов, повышающих чувствительность тканей к инсулину (в частности, адипонектина), снижается, в то же время секреция адипокинов, снижающих чувствительность тканей к инсулину (например, резистина, вистафина), повышается. Возрастание ИР происходит параллельно с увеличением жировой массы тела, особенно висцерального жира [8, 9].
ИР представляет собой один из фундаментальных дефектов, приводящих к нарушению углеводного обмена [10, 11]. Для коррекции ИР бесспорно необходимо изменение образа жизни. Пациентам следует пересмотреть пищевой рацион в отношении как количества принимаемой еды, так и ее качества. Этому необходимо уделять достаточное внимание при общении с пациентами или направлять их в школы диабета. Важное значение имеют и вопросы физической активности пациентов. Наряду с немедикаментозными подходами к лечению СД2 собрана большая доказательная база в отношении фармакологического терапевтического вмешательства, что нашло отражение в опубликованных клинических рекомендациях [11].
Как было описано ранее, СД2 развивается в результате ИР и нарушения секреции инсулина β-клетками. Современные представления о механизмах, в результате которых развивается СД2, стали шире. Среди них можно указать нарушение функции α-клеток, дефицит продукции и/или резистентность к инкретинам, вырабатываемым в желудочно-кишечном тракте, ускоренный липолиз в жировой ткани, повышение реабсорбции глюкозы в почках и резистентность к инсулину клеток мозга, нарушение кишечной микробиоты, хроническое воспаление [12].
СД2 – это гетерогенное заболевание с множеством патогенетических механизмов. Это затрудняет диагностику и представляет особую трудность при выборе терапии. Сложный патогенетический механизм обусловливает необходимость одновременного воздействия на различные нарушения, что способно обеспечивать хороший сахароснижающий эффект и его удержание по мере прогрессирования заболевания [13].
Сахароснижающая терапия
В настоящее время врачи-клиницисты имеют широкий выбор сахароснижающих препаратов с различными механизмами действия, с доказанной эффективностью и благоприятным профилем безопасности. Неинсулиновые сахароснижающие средства представлены несколькими группами лекарственных препаратов: бигуаниды (метформин), производные сульфонилмочевины, тиазолидиндионы, глиниды, агонисты рецепторов глюкагоноподобного пептида-1, ингибиторы дипептидилпептидазы-4, ингибиторы α-глюкозидазы.
Успехам в области диабетологии в значительной мере способствует внедрение в клиническую практику современных алгоритмов ведения пациентов с СД2. В частности, в алгоритмах Российской ассоциации эндокринологов (РАЭ) 2019 г. подчеркнуто, что индивидуальный подход к каждому пациенту приоритетен при выборе тактики лечения. Целевой уровень гликированного гемоглобина (HbA1с) определяется исходя из возраста пациента и его клинических характеристик (наличие атеросклеротических сердечно-сосудистых заболеваний и/или риск тяжелой гипогликемии и т.д.) [14] (см. таблицу).
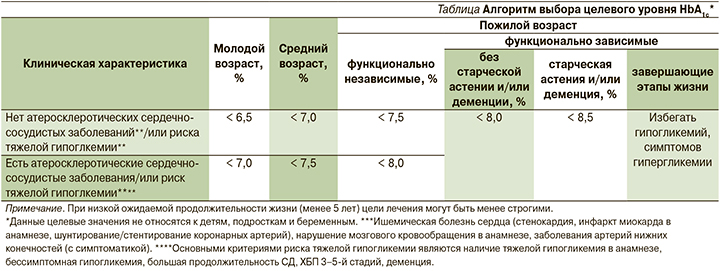
Подбирая сахароснижающую терапию, врач ориентируется на исходный уровень HbA1c и насколько он превышает индивидуальный целевой.
При инициации лечения может быть избрана монотерапия, если значение HbA1с находится в целевом диапазоне или превышает целевой уровень менее чем на 1,0%. Комбинированная терапия рекомендуется, если значение HbA1с превышает целевое на 1,0–2,5%. При исходном уровне HbA1c выше целевого более чем на 2,5% необходимо начинать инсулинотерапию (или комбинацию инсулина с пероральными сахароснижающими препаратами). При этом в дальнейшем возможна отмена инсулина [4]. Важно также учитывать, что в определенных клинических ситуациях (наличие атеросклеротических сердечно-сосудистых заболеваний и факторов их риска, хронической сердечной недостаточности, хронической болезни почек (ХБП), ожирения, риска гипогликемий) определенные классы сахароснижающих препаратов имеют доказанные преимущества.
Метформин
Лидирующую позицию занимает метформин. Он рекомендован пациентам уже на стадии преддиабета при неэффективности мероприятий по изменению образа жизни или высоком риске развития СД2 [15]. Для лечения СД2 с дополнительными факторами риска доза препарата составляет 2000–2500 мг/сут после или во время приема пищи в 2 приема. На первой неделе стартовая доза метформина обычного высвобождения должна составлять 500–850 мг/сут во время ужина, со второй – увеличивается до 500–850 мг 2 раза в сутки (во время завтрака и ужина). При плохой переносимости метформина обычного высвобождения или низкой приверженности пациентов терапии по причине кратности приема целесообразно рекомендовать применение метформина пролонгированного действия в дозе 750 мг (по две таблетки во время ужина). На фоне такой терапии следует учитывать возможность развития дефицита витамина В12.
Препараты сульфонилмочевины (ПСМ)
Данные препараты применяются в лечении больных СД2 с середины прошлого столетия. Это наиболее изученная группа сахароснижающих препаратов. ПСМ можно комбинировать со всеми другими сахароснижающими средствами, кроме инсулина короткого действия.
Высокоселективные ПСМ (глимепирид, гликлазид) сохранили свои позиции в международных алгоритмах лечения благодаря быстрому достижению сахароснижающего эффекта (на фоне монотерапии НbА1с снижался на 1–2%), невысокой цены, определяющей доступность лечения [16].
ПСМ различаются по сахароснижающей активности, которая определяется рецепторной селективностью, длительностью действия и путями элиминации. Основной недостаток ПСМ – это риск развития гипогликемических состояний и прибавки массы тела [17]. В связи с этим вопросы безопасности такой терапии остаются актуальными.
Гипогликемия на фоне применения ПСМ является результатом стимулирования секреции инсулина, даже если концентрация глюкозы в крови низкая. Риск развития гипогликемий часто связан с нарушением режима питания, нефизиологическими ограничениями в питании, чрезмерной физической нагрузкой, а также с фармакокинетическими и фармакодинамическими свойствами ПСМ. Высокоселективные ПСМ (глимепирид, гликлазид) предпочтительнее других ПСМ для пациентов с СД2 из-за низкого риска гипогликемий и нейтральности в отношении развития сердечно-сосудистых заболеваний [18].
Комбинирование метформина и ПСМ обоснованно с точки зрения воздействия на фундаментальные механизмы развития СД2. С учетом персонифицированного подхода к лечению ПСМ безопасны (нейтральны) для пациента с СД2 и сердечно-сосудистыми факторами риска, атеросклеротическими сердечно-сосудистыми заболеваниями (не рекомендован глибенкламид), ХБП (до 4-й стадии, глибенкламид не рекомендован при скорости клубочковой фильтрации <60 мл/мин/1,73 м²). В случае выраженной декомпенсации сердечной недостаточности ПСМ назначают с осторожностью [19].
Механизм действия этой группы препаратов основан на взаимодействии с мембранными рецепторами сульфонилмочевины-1 (Sulfonylurea Receptor 1 – SUR-1), β-клеток, связанными с АТФ-зависимыми K-каналами. ПСМ приводят к закрытию АТФ-зависимых K-каналов, деполяризации клеточной мембраны, ионы Са++ активно поступают в цитоплазму β-клеток, клетка сокращается, инсулин высвобождается в кровоток. Нарушение функции β-клеток является важным патогенетическим звеном развития СД2 [20].
Нарушение функции β-клеток характеризуется:
- • снижением или потерей первой фазы секреции инсулина;
- • нарушением секреции инсулина в ответ на другие (негликемические) стимулы (аминокислоты);
- • повышением уровня проинсулина;
- • снижением секреции инсулина суммарно, суточно и др.
Механизм нарушения функции β-клеток не до конца ясен. Без сомнения, длительная нагрузка глюкозой на β-клетки нарушает их синхронную функцию, которая очень важна для коррекции постпрандиальной гликемии. Нельзя не учитывать и возможное влияние генетических факторов на развитие дисфункции β-клеток в ответ на длительное влияние гипергликемии. Однако четких генетических маркеров пока не установлено. Нельзя исключать и влияние факторов внешней среды, ожирения и ИР.
Периферическое (экстрапанкреатическое) действие ПСМ, вероятно, обусловлено повышением инсулинемии и снижением глюкозотоксичности.
Постпрандиальная инсулинемия ассоциируется со снижением продукции глюкозы печенью и улучшением утилизации глюкозы периферическими тканями [21].
ПСМ различаются селективностью связывания с SUR-1 на мембранах β-клеток и способностью диссоциировать с данным рецептором. Чем выше степень сродства препарата с SUR-1, тем больше он стимулирует АТФ-зависимые К+-каналы, тем выше эндогенная секреция инсулина β-клетками. Приоритет при выборе имеют препараты с высокой биодоступностью, способностью быстрого взаимодействия с рецептором на β-клетке, а также с быстрой диссоциацией препарата с рецептором [22].
Хочется представить интересный клинический случай применения комбинированной терапии метформина и глибенкламида у пациента с СД2.
Клинический случай
Пациент Б. 74 лет, пенсионер, не работает. Поступил в отделение эндокринологии планово.
Жалобы при поступлении: повышение уровня глюкозы в крови, небольшая сухость во рту, сухость слизистых оболочек и кожи, жажда (до 2,5 л жидкости в день), полиурия, никтурия, неприятные «покалывания» кожи голеней и стоп, особенно в ночное время, судорожное сведение мышц ног, также чаще ночью. Повышение артериального давления (АД) до 160 и 100 мм рт.ст. (на фоне проводимой антигипертензивной терапии).
Анамнез заболевания: СД2 диагностирован в 72 года во время госпитализации в отделение терапии по поводу плохо контролируемой артериальной гипертензии. Уровень гликемии на тот момент: натощак до 7,3, после еды до 13,4 ммоль/л. Масса тела – 104 кг, рост – 176 см, индекс массы тела – 33,6 кг/м2.
По данным выписки из стационара: клинический анализ крови без изменений, биохимический анализ крови: АЛТ – 72 МЕ/л, мочевая кислота – 431 ммоль/л, альбумин, креатинин, мочевина, ГГТ – в норме. Анализ мочи без изменений. Уровень НbА1с – 8,2%.
Липидограмма: общий холестерин – 5,9 ммоль/л, триглицериды – 2,92 ммоль/л, ЛПНП – 3,84 ммоль/л, ЛПОНП – 2,56, ЛПВП – 0,9 ммоль/л По данным ЭКГ, ЭхоКГ, значимых изменений выявлено не было.
Находясь в стационаре, консультирован эндокринологом. Диагностирован СД2 с целевым уровнем НbА1с 7%. Назначена терапия метформином по 500 мг 2 раза в день с постепенной титрацией дозы до 1000 мг 2 раза в день.
С пациентом было проведена беседа о необходимости соблюдения правил питания, исключения из рациона питания «быстрых» углеводов и сокращения количества «медленных» углеводов, необходимости увеличить количество продуктов, содержащих пищевые волокна и др. Было рекомендовано осуществлять физические нагрузки ежедневно.
Перенесенные заболевания: желтуха в детстве (12 лет), аппендэктомия в 1983 г., артериальная гипертензия диагностирована в 68 лет. Исследования на симптоматические гипертонии не проводились. В течение всего периода артериальной гипертензии пациент получает антигипертензивную терапию: эналаприл 10 мг/сут, амлодипин 5 и бисопролол 2,5 мг/сут.
Острых сердечно-сосудистых заболеваний в анамнезе не было.
Наследственность по СД отягощена, отец болел СД; какое получал лечение, не помнит. У отца СД диагностирован в зрелом возрасте.
В последующие годы пациент аккуратно проводил лечение метформином, контроль гликемии соблюдал ежедневно 1 раз в день и в разное время по дням недели. По данным дневника гликемии, уровни глюкозы были в пределах целевых: натощак до 7, после еды до 9 ммоль/л. Похудел на 6 кг. Уровень НbА1с – 6,3%. Цифры АД стали нормальными, дозы антигипертензивных препаратов были снижены, некоторые препараты отменены. Больной вел активный образ жизни, много ходил пешком, играл в волейбол. Пациент рассказал, что всю жизнь занимался спортом, много двигался, строил дачу, но 7 лет назад после смерти жены «опустил руки», перестал следить за здоровьем, «засел» у телевизора, неправильно питался, поправился на 15 кг.
Нужно сказать, что пациент весьма осознанно подошел процессу лечения СД, имел достаточно строгий рацион питания с небольшим количеством «долгих» углеводов. И конечно, поддерживать такой строгий пищевой рацион было трудно (со слов пациента). Примерно через год после начала терапии на фоне некоторого расширения пищевого рациона, увеличения (небольшого) количества «долгих» углеводов пациент отметил, что гликемия стала увеличиваться. Цифры гликемии натощак стали повышаться до 8–8,2 ммоль/л, в течение дня до 10–11 ммоль/л. НbА1с повысился до 7,6%.
Эндокринолог поликлиники к терапии метформином добавил препарат группы ингибиторов дипептидилпептидазы-4, по 5 мг в день. Со слов пациента, снижения цифр гликемии не отмечал, препарат принимал в течение 2 месяцев. Вернулся к более строгому соблюдению диеты, но гликемия после еды была выше целевых значений (до 11–12 ммоль/л). Натощак уровень глюкозы крови был удовлетворительным – 6–7 ммоль/л. После разговора с эндокринологом в поликлинике, совместного взвешивания «за» и «против» (со слов пациента) был назначен препарат Метглиб® Форс 2,5+500 мг 2 раза в день. Доза метформина при этом была уменьшена, назначен ПСМ глибенкламид в небольшой дозе. Уже в первые дни приема препарата пациент отметил снижение гликемии до нормальных значений. Цифры гликемии натощак были до 7 ммоль/л, после еды до 8 ммоль/л. При этом пациент говорил, что диету соблюдает не так строго, как раньше, в рационе было больше углеводов (но без злоупотреблений). В течение 6 месяцев на терапии Метглиб® Форс 2,5+500 мг 2 раза в день (без увеличения дозы метформина) гликемия в пределах нормальных значений, уровень НbА1с – 5,3%. Вес не прибавил.
Настоящая госпитализация связана с плановым обследованием пациента.
Состояние при поступлении удовлетворительное. Масса тела – 91 кг, рост – 170 см, индекс массы тела – 31,5 кг/м2, окружность талии – 108 см.
Кожные покровы и видимые слизистые оболочки нормальной окраски и влажности. Кожа голеней, стоп сухая, оволосение скудное. Тактильная, температурная, вибрационная чувствительность сохранены. Двигательные функции удовлетворительные. Дыхательная система без признаков патологии. Тоны сердца ритмичные, частота сердечных сокращений – 72 в минуту, АД – 132/81 мм рт.ст. Органы желудочно-кишечного тракта без признаков патологии. Органы мочевыделительной системы без признаков патологии.
Антигипертензивная терапия: эналаприл 5 мг.
Сахароснижающая терапия: Метглиб® Форс 2,5+500 мг 2 раза в день.
Гликемический контроль: (проводился мониторинг глюкозы системой мониторирования Либра) натощак 6,3–6,9, в течение дня – 5,3–8,1 ммоль/л. Время в целевом уровне гликемии – 92%.
Липидограмма: триглицериды 1,59 (1,70–2,0) ммоль/л, холестерин общий – 5,73 (3,10–5,20), холестерин – ЛПВП 0,94 (0,9–2,2), холестерин – ЛПНП 3,31 (2,85–3,37) ммоль/л.
ЭКГ исследование: синусовый ритм с частотой сердечных сокращений – 83 удара в минуту. Вертикальное положение электрической оси сердца. Минимальные изменения миокарда ЛЖ ЭхоКГ исследование: визуализация умеренно затруднена. Аорта не расширена, стенки уплотнены. Створки аортального и митрального клапанов уплотнены. Камеры сердца не расширены. Глобальная систолическая функция левого желудочка не снижена. Фракция выброса – 68%. Зон снижения локальной сократимости не выявлено. Диастолическая функция левого желудочка нарушена по 1-му типу. Признаков легочной гипертензии не выявлено.
Диагноз при выписке: СД2, удовлетворительный контроль гликемии. Целевой уровень НbА1с менее 7%.
Обсуждение
Пациенту 74 года. Диагноз СД2 установлен в 72 года. Диабет диагностирован в зрелом возрасте. Пациент мотивирован на лечение, старается соблюдать правила питания, привержен к лекарственной терапии. Подбор лекарственной терапии – достаточно сложная задача для врача. СД – это заболевание с множеством патогенетических механизмов, выявить которые не всегда представляется возможным.
Подбирая терапию, врач руководствуется рекомендациями по персонифицированному целевому уровню НbА1с, основываясь на возрасте пациента, длительности заболевания, возможности развития гипогликемических состояний и др. Но у врача не всегда есть возможность выявить механизм заболевания у конкретного пациента. Врач не всегда располагает достаточной лабораторно-диагностической базой. В данной клинической ситуации назначена комбинированная терапия метформином и глибенкламидом (Метглиб® Форс). Глибенкламид – это препарат не первого ряда выбора. И многие врачи-эндокринологи, назначая ПСМ, начали бы с других препаратов этой группы (гликлазид, глимепирид). Конечно, были взвешены все «за» и «против»: пациент не имеет в анамнезе сердечно-сосудистых заболеваний, низка вероятность гипогликемических состояний, и течение СД характеризуется постпрандиальной гипергликемией, что свидетельствует о β-клеточной недостаточности.
У каждого врача-эндокринолога есть пациенты, их немного, которые очень хорошо откликаются на лечение глибенкламидом. Причем отклик настолько хороший, что гликемия полностью нормализуется, несмотря на погрешности в питании, избыточный вес и даже небольшое ожирение, как у нашего пациента.
Видя подобные случаи, вспоминаешь о СД типа MODY, точнее MODY3, при котором также отмечается хороший лечебный эффект на терапию ПСМ и именно глибенкламидом.
СД типа MODY3 развивается в результате мутации в гене HNF1A ядерного фактора гепатоцитов 1А (12-я хромосома), фактора транскрипции. Факторы транскрипции (белки) контролируют процесс синтеза мРНК на матрице ДНК (транскрипцию) путем связывания со специфичными участками ДНК. Ген HNF1A имеет регуляторный белок и выступает в качестве гомеодоменсодержащего фактора транскрипции, экспрессирующегося в панкреатических β-клетках, печени, кишечнике, почках. В β-клетках этот фактор играет важную роль в транскрипции генов, участвующих в секреции инсулина, транспорте и метаболизме глюкозы (GLUT2), транспорте аминокислот, а также в синтезе нескольких митохондриальных ферментов, так или иначе связанных с синтезом инсулина. В случае развития СД типа MODY3 мутации гена HNF1A приводят к нарушению секреции инсулина и/ или снижению количества β-клеток, а также к уменьшению почечного порога для глюкозы. Глюкоза, аминокислоты, жирные кислоты и кетоновые тела стимулируют секрецию инсулина. Точный механизм, посредством которого мутации в генах факторов транскрипции приводят к развитию СД, до настоящего времени неизвестен. Появляется все больше доказательств, что ядерные факторы гепатоцитов играют ключевую роль в развитии, регулировании пролиферации и метаболизме β-клеток. Сочетание этих факторов, вероятно, со временем приводит к прогрессированию дисфункции β-клеток. Для СД типа MODY3 характерно позднее начало заболевания [23, 24].
Подобные клинические случаи создают предпосылки к усовершенствованию диагностики CД, генетического консультирования и разработке патогенетических подходов к лечению.



