Среди 60 тыс. российских женщин, ежегодно заболевающих раком молочной железы (РМЖ), не менее чем у 10 тыс. имеются высокоагрессивные опухоли с повышенной амплификацией гена HER2-/ neu. К этому надо добавить десятки тысяч женщин с прогрессированием HER2-позитивного РМЖ, заболевших в предшествующие годы.
Разработанный более 20 лет назад таргетный препарат трастузумаб (Герцептин), представляющий собой моноклональное антитело против рецептора человеческого эпидермального фактора роста 2 (HER2), который амплифицирован или сверхэкспрессирован у 15–20% больных РМЖ, коренным образом изменил в лучшую сторону отдаленные результаты лечения этого грозного заболевания [1–3]. Поскольку почти у 70% больных выявляются операбельные стадии рака (I–IIIA), основное применение анти-HER2-терапии приходится на адъювантное лечение. При оценке эффективности адъювантной таргетной терапии РМЖ пока можно говорить только о трастузумабе – единственном препарате, изученном более чем на 12 тыс. пациентов со средним периодом наблюдения до 10 лет.
Лечение больных HER2-позитив-ным РМЖ тщательно обсуждалось на 13-й конференции по РМЖ в Сан-Галлене 13–16 марта 2013 г. [4–6]. Минимальный размер HER2+-опухоли 6 мм для назначения трастузумаба поддержали 72,5% экспертов. Все эксперты согласились с тем, что предпочтительная продолжительность адъювантной терапии – 12 месяцев. Подавляющее большинство (93,2%) экспертов проголосовали за включение таксанов в комбинацию с трастузумабом и 68% – за включение также антрациклинов при лечении HER2-позитивного РМЖ. Дана положительная оценка подкожного введения трастузумаба, значительно сокращающего время процедуры, хорошо воспринимаемой пациентами [7, 8].
В свое время на страницах журнала «Фарматека» были представлены выводы мета-анализа важнейших клинических исследований адъювантного применения трастузмумаба у больных с HER2-позитивным РМЖ [9].
Адъювантная терапия трастузумабом в течение 52 недель (одного года) одновременно или последовательно с химиотерапией – наиболее обоснованный стандарт лечения больных ранним (операбельным) HER2-позитивным РМЖ.
Сокращение продолжительности лечения до 9 (FinHER) или до 26 недель (PHARE) снижает эффект таргетного лечения. Но и увеличение длительности терапии трастузумабом свыше 52 недель (до 2 лет, как в проекте HERА) не добавляет пользы и не увеличивает выживаемость, повышая риск кардиотоксичности в два раза.
Одновременное (конкурентное) начало адъювантной химиотерапии и анти-HER2-терапии трастузумабом в большей степени улучшает безрецидивную и общую выживаемость, чем последовательное применение трастузумаба после завершения химиотерапии, несколько увеличивая риск кардиологических осложнений.
Замена в режимах адъювантной терапии HER2-позитивного РМЖ антрациклинов на карбоплатин (проект BCIRG 006) снижает частоту кардиологических осложнений с 2,0 до 0,4%. При этом, однако, в «безантрациклиновой» группе нарастало число больных с рецидивом заболевания и риск смертельных исходов по сравнению с группой пациентов, получавших антрациклины (АС-ТН). Мета-анализ всех рандомизированных испытаний трастузумаба показывает, что он может использоваться в комбинации с антрациклинами с приемлемой кардиотоксичностью при условии низкой кумулятивной дозы применения менее кардиотоксичных антрациклинов и особенно больными HER2-позитивным РМЖ с комаплификацией гена ТОР2А.
После оценки большинства исследований создается впечатление, будто режим, содержащий антрациклины и таксаны с дополнением трастузумаба (АС-ТН), – наиболее подходящий выбор для адъювантного (послеоперационного) лечения HER-позитивного РМЖ.
Неоадъювантное применение трастузумаба у пациентов с HER2-позитивным местно-распространенным РМЖ
Местнораспространенный РМЖ и воспалительный РМЖ (МР/ВРМЖ) составляют около 6–10% от всех новых случаев РМЖ. Женщины с таким заболеванием имеют прогноз хуже, чем с ранним операбельным заболеванием. Именно поэтому местнораспространенный РМЖ представляет интерес как область для постоянного медицинского изучения.
Предоперационная системная (неоадъювантная) терапия играет важную роль для пациентов с МРРМЖ и ВРМЖ, улучшая хирургическое лечение, дает возможность выполнить органосохраняющие операции, а также лечение микрометастазов с минимальной задержкой [10].
В исследовании NOAH (NeOAdjuvant Herceptin) были оценены выгоды одногодичного применения трастузумаба для пациентов с МРРМЖ и ВРМЖ, получавших неоадъювантную доксорубицин- и таксансодержащую химиотерапиию [11]. Трастузумаб назначали на время всей химиотерапии и продолжали в виде монотерапии после операции. Исследование также включало параллельную группу пациентов, получавших химиотерапию, отобранную по тем же критериям, но с HER2-негативным заболеванием.
Критерий «HER2-негативное заболевание» обозначал, что «промежуточную группу» (с FISH-негативным заболеванием и 2+экспрессией) не включали в исследование, увеличивая разницу в результатах между истинно HER2-негативной и HER2-позитивной группами.
В целом результаты исследования показали, что у пациентов с HER2-позитивным заболеванием с добавлением трастузумаба к неоадъювантной химиотерапии значительно улучшились клинический и патоморфологический ответы при МРРМЖ и ВРМЖ и значительно уменьшился риск рецидива заболевания и смерти по сравнению с пациентами, которые не получали таргетную терапию.
Выгода лечения трастузумабом наблюдалась во всех подгруппах больных, включая большую группу женщин с ВРМЖ, который часто ассоциируется с гиперэкспрессией HER2, он особенно агрессивен и имеет неблагоприятное течение. В исследовании NOAH женщины с воспалительной формой РМЖ имели клиническую выгоду от трастузумаба, подобную женщинам с невоспалительной местнораспространенной формой заболевания.
HER2-позитивная патология более чувствительна к неоадъювантному применению доксорубицина и паклитаксела, чем HER2-негативная патология. Схожие данные получены для адъювантной системной терапии. Более значимый ответ, наблюдавшийся в группе пациентов, получавших трастузумаб, чем в контрольной группе, свидетельствует о том, что добавление антител повышает эффективность применения доксорубицина и паклитаксела, несмотря на то что HER2-позитивные опухоли в принципе высокочувствительны к этим химиопрепаратам.
Исследование NOAH стало первым клиническим исследованием трастузумаба, показавшим повышение безрецидивной выживаемости и частоты полных патоморфологических регрессов. По крайней мере два других крупных рандомизированных исследования проводятся, чтобы в будущем дать оценку вкладу неоадъювантного применения трастузумаба. Результаты исследования NOAH показали, что неоадъювантное применение трастузумаба должно быть запланировано для пациентов с HER2-позитивным МРРМЖ/ВМРЖ как дополнение к химиотерапии с последующим адъювантным применением этого препарата после операции [12].
Неоадъювантная терапия, включающая комбинацию «трастузумаб+пертузумаб»
Трастузумаб и пертузумаб обладают комплементарными механизмами действия. В то время как трастузумаб блокирует отделение HER2 [13] и лиганд-независимую передачу сигнала, основной эффект пертузумаба обусловлен подавлением лиганд-зависимой передачи сигнала, в частности между НЕR2 и НЕR3. Этот сигнальный путь играет важную роль в процессах активации пролиферации и выживания клеток [14]. Оба антитела служат индукторами антителопосредованной клеточной цитотоксичности [15].
В недавно проведенном клиническом исследовании больных НЕR2-позитивным метастатическим РМЖ (МРМЖ) 2-й фазы частота эффекта от применения пертузумаба и трастузумаба больными с прогрессированием после терапии трастузумабом достигла 50% [16]. Исследование было разработано и проводилось фондом Микеланджело (Милан) в сотрудничестве с Ф. Хоффманн-Ля Рош Лтд. (Швейцария) при участии НИИ онкологии им. проф. Н.Н. Петрова и Городского и Областного клинических онкологических диспансеров Санкт-Петербурга и Ленинградской области [17].
В целом в исследование «NeoShere» включены больные из 59 центров 16 стран с декабря 2007 по декабрь 2009 г.
Всего были обследованы 603 больных, из которых 417 подошли для рандомизации. Большинство (n=392) больных были подвергнуты хирургическому лечению, как и планировалось. Характеристики больных были сбалансированы по исследуемым группам, и средняя продолжительность лечения варьировалась от 16 до 18 недель. Средний размер опухоли, по данным клинического обследования, на момент включения составил ≥50 мм во всех группах исследования.
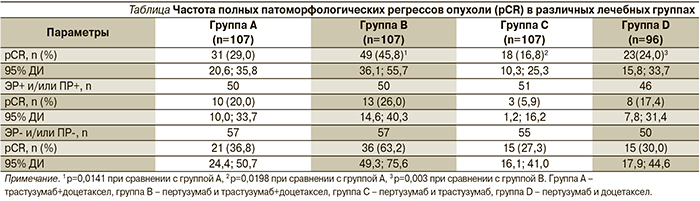
Частота патоморфологического полного регресса (pCR – Pathologic Complete Response) в 29%, наблюдавшаяся в группе «трастузумаб+доцетаксел» (группа А), оказалась меньше, чем в группе «пертузумаб и трастузумаб+доцетаксел» (группа В, 45,8%) (р=0,0141) (см. таблицу).
При сравнении оказалось, что при комбинации «пертузумаб+доцетаксел» (группа D) была зафиксирована частота полных регрессов в 24% случаев. Примечательно, что комбинированное таргетное лечение (пертузумаб и трастузумаб) без химиотерапии привело к полному исчезновению опухоли в молочной железе лишь у 16,8% больных (группа С).
В соответствии с данными, полученными в более ранних исследованиях [18], частота pCR была ниже при гормон-рецептор-положительных опухолях. У больных с гормон-рецептор-негативными опухолями частота pCR достигла 63,2% при применении трех препаратов (группа В) и 27,3% после всего лишь четырех курсов таргетной терапии без применения цитостатических препаратов (группа С). Доля больных без поражения лимфоузлов, по данным хирургического лечения, достигших полного патоморфологического регресса в ткани железы, была самой высокой в группе В (39,3%).
У большинства (67,6–88,1%) больных был достигнут клинический общий ответ на лечение: полный регресс (CR) или частичный регресс (PR – Partial Response) первичного новообразования.
В целом исследование NeoShere продемонстрировало, что добавление ингибитора димеризации HER2-препарата пертузумаб к традиционной схеме терапии «трастузумаб+доцетаксел» существенно повышает частоту полного регресса опухоли в молочной железе после относительно короткого периода неоадъювантного лечения (12 недель) в популяции больных, треть из которых имеют местнораспространенную форму РМЖ.
Хотя пертузумаб в комбинации с доцетакселом также эффективен, сочетанное применение химиотерапии и двух таргетных антител оказалось более эффективным, чем применение цитотоксической терапии и одного из таргетных препаратов.
Примечательно, что полный регресс опухоли был достигнут в 16,8% случаев при использовании одной только таргетной терапии (трастузумаб+пертузумаб). Это знаковое наблюдение указывает на то, что определенная доля HER2-позитивных больных может быть излечена без применения химиотерапии.
Подобный вывод может оказать очень существенное влияние на клиническую практику при выборе лечения больных, которые не могут получать тяжелую цитотоксическую терапию, и будет иметь еще большее значение в перспективе, если удастся выявить более точные биомаркеры, предсказывающие ответ на лечение.
В исследовании II фазы TRYPHAENA (NCT00976989) 225 пациентов были рандомизированы на получение одного из трех неоадъювантных режимов: пертузумаб+трастузумаб, назначенный одновременно с антрациклин/таксан-содержащей химиотерапией (фторурацил, эпирубицин, циклофосфамид – FEC, а затем доцетаксел) или двойная анти-HER2-комбинация, назначаемая последовательно после схемы FEC, но одновременно с доцетакселом, или данный анти-HER2-дублет, назначаемый одновременно с карбоплатином и доцетакселом [28]. Первичная цель данного исследования – кардиальная безопасность, сопоставимая для всех трех исследуемых групп. Частота pCR равнялась 61,6% в 1-й группе, 57% – во 2-й и 66,2% – в 3-й группе, при этом HER-негативный статус опухоли коррелировал с более высокой частотой pCR (79,4,% 65,0 и 83,8% для 1, 2 и 3-й групп соответственно).
Комбинация «трастузумаб+лапатиниб»
Двойное таргетное лечение HER2-позитивного РМЖ с помощью трастузумаба и лапатиниба, принятое в исследовании NeoALTТO [19], объясняется возможной первичной или приобретенной резистентностью к обоим агентам, их частично неперекрещивающимися механизмами действия и хорошо известным синергитическим взаимодействием на моделях HER2-позитивного рака. Трастузумаб ингибирует лиганд-независимый HER2- и HER3-сигнальные пути и запускает антителзависимую клеточную цитотоксичность.
В противоположность трастузумабу лапатиниб блокирует лигандиндуцированный гетеродимер, предотвращая экспрессию «усеченной» версии HER2-рецептора, нередко резистентную к трастузумабу. Кроме того, лапатиниб приводит к аккумуляции HER2 на поверхности опухолевых клеток, усиливая трастузумабзависимую антителопосредованную клеточную цитотоксичность.
В исследование NeoALTТO вошли 455 пациентов с HER2-позитивным РМЖ T2-3N0-2M0 из 23 стран, включая Россию (в т.ч. НИИ онкологии им. Н.Н. Петрова). В соответствии с рандомизацией 154 больных получали еженедельно в течение 6 недель лапатиниб, 149 больных – трастузумаб и 152 – их комбинацию с последующим добавлением к таргетной терапии паклитаксела в течение 12 недель во всех группах.
Главной целью исследования было достижение полного патоморфологического регресса опухоли (рCR) в различных лечебных группах. Наиболее высокая частота полного патоморфологического регресса наблюдалась в группе комбинированной таргетной терапии (51,3%), достоверно отличающаяся от получавших монотерапию лапатинибом (рCR=24,7%) или трастузумабом (рCR=29,5%). Не отмечено достоверных отличий между двумя последними группами таргетной монотерапии (р=0,34).
Исследование NeoALTТO подтвердило представление о том, что двойная блокада HER2 превосходит эффективность одного агента в анти-HER2-терапии. Комбинация лапатиниба и трастузумаба приводит к значительно более высокой, чем монотерапия лапатинибом или трастузумабом, частоте рCRВ. В упоминавшемся исследовании NOAH удвоение частоты рCR у получавших трастузумаб коррелировало с улучшением безрецидивной выживаемости.
В исследовании TECHNO [20] также сообщается о корреляции между рCR и улучшением безрецидивной и общей выживаемости. Поэтому ожидается, что при двойной блокаде HER2 улучшится выживаемость при дальнейшем наблюдении за больными.
Результаты испытания NeoALTТO оказались схожими с уже опубликованными данными исследования NeoSphere, оценивавшими эффективность комбинации двух антиHER2-антител – трастузумаба и пертузумаба.Пертузумаб, как и лапатиниб, имеет комплементарный с трастузумабом механизм действия.
Как уже упоминалось, неоадъювантное исследование NeoALTТO подтвердило, что двойная блокада HER2 (трастузумаб+лапатиниб) превосходит по непосредственной эффективности (достижение рCR) один анти-HER2- агент. Исходя из идеи, что достижение патоморфологического полного регресса является суррогатным маркером более высокой выживаемости, параллельно с NeoALTТO было предпринято адъювантное исследование ALTТO. В исследовании ALTТO оценивались те же таргетные препараты, но в разных режимах:
- Лапатиниб+трастузумаб (Л+Т),
- Трастузумаб→лапатиниб (последовательно Т→Л),
- Лапатиниб (Л),
- Трастузумаб (Т).
С 2007 по 2011 г. был включен 8381 пациент. Анти-HER2-терапия начиналась после завершения всех курсов химиотерапии (n=4613) конкурентно с таксанами после антрациклинов (n=3337) и конкурентно с неантрациклиновыми платино-содержащими режимами (n=431). В «комбинированной» группе (Л+Т) число событий (местные рецидивы, отдаленные метастазы, смерть) оказалось меньше по сравнению с монотерапией (Т), и в «последовательной» группе Т→ Л показатель безрецидивной выживаемости (DFS) оказался не ниже, чем в группе Т.
Однако статистически значимых отличий при сравнении любых групп пока не выявлено. Таким образом, первые результаты оценки DFS в проекте ALTТO при сроке наблюдения 4,5 года не показали тех обнадеживающих успехов двойной блокады HER2 (Л+Т), которые были получены в неоадъювантном проекте NeoALTТO. Основные разработчики обоих проектов (Piccart и соавт., 2014) делают выводы о необходимости более длительных сроков наблюдения.
Лечение HER2-позитивного МРМЖ. Двойная HER2-блокада
Доклинические данные свидетельствуют о синергетическом эффекте пертузумаба в комбинации с трастузумабом, продолжаются клинические исследования, оценивающие стратегию двойной HER2-блокады [15].
В нескольких исследованиях I фазы, проводимых при МРМЖ, оценивалась эффективность пертузумаба либо в качестве монотерапии, либо в комбинации с цитотоксическими агентами. В небольшом исследовании II фазы оценивалась комбинация пертузумаба и трастузумаба у 11 пациентов с HER2-позитивным МРМЖ, получавших предварительно терапию трастузумабом [21]. Общая частота ответов (ORR – overall response rate) была отмечена у 18% и частота клинической пользы (CBR – clinical benefit rate) – у 44,5%, однако набор в данное исследование был преждевременно прекращен из-за проявлений кардиотоксичности. У шести пациентов зарегистрировано снижение фракции выброса левого желудочка, в двух случаях снижение фракции составило более 15%, и у одного пациента развилась симптоматическая застойная сердечная недостаточность.
В другом исследовании II фазы оценивалась комбинация пертузумаба с продолженной терапией трастузумабом у 66 больных HER2-позитивным МРМЖ, прогрессирующим на терапии трастузумабом. В данном исследовании была показана многообещающая противоопухолевая активность данной комбинации: ORR достигла 24,2%, а CBR равнялась 50%, при этом 5 (7,6%) пациентами был достигнут полный ответ (CR) и 11 (16,7%) пациентами – частичный (PR) [22].
Профиль кардиальной безопасности в данном исследовании был благоприятным по сравнению с более малыми исследованиями, при этом не было пациентов, исключенных из исследования из-за развития кардиотоксичности. Кардиальная безопасность пертузумаба была доказана в объединенном анализе изучения 598 пациентов, получавших пертузумаб либо в качестве монотерапии, либо в комбинации с другими агентами, в котором было показано, что пертузумаб не приводит к значительному увеличению частоты побочных кардиальных эффектов [23].
Исследование CLEOPATRA (Clinical Evaluation of Pertuzumab and Trastuzumab; NCT00567190) представляет собой рандомизированное клиническое исследование III фазы, включившее 808 пациентов с HER2-позитивным МРМЖ, ранее не получавших лечение, которые были рандомизированы на получение или комбинации доцетаксел+трастузумаб или комбинации той же схемы с пертузумабом [24].
Двойная блокада HER2 продемонстрировала значительно более высокие показатели выживаемости без прогрессирования заболевания (PFS – progression free survival) – первичной конечной точки исследования, сравнимой со стандартными показателями (mPFS 18,7 против 12,4 месяца, отношение рисков – ОР=0,65; 95% доверительный интервал [ДИ] – от 0,5 до 0,75; р<0,001).
Промежуточный анализ общей выживаемости (OS – overall survival) продемонстрировал тенденцию в пользу группы, получавшей пертузумаб. Второй анализ ОS, проводимый среди 69% запланированных случаев для окончательного анализа, показал статистическую достоверность в пользу группы, получавшей пертузумаб (mOS равнялась 56,5 месяца по сравнению с 40,8 в группе плацебо; ОР=0,68, 95% ДИ – 0,52–0,84; р=0,0008). ORR равнялся 69,3% в контрольной группе и 80,2% в группе, получавшей пертузумаб [25, 26].
Только 10% пациентов, включенных в исследование CLEOPATRA, получали трастузумаб как часть (нео) адъювантной терапии. Тем не менее исследовательский анализ не выявил различий в эффективности для больных, получавших пертузумаб в сочетании с первичной терапией трастузумабом.
Что касается токсичности, то диарея, сыпь, мукозиты, фебрильная нейтропения и сухость кожи любой степени наблюдались чаще в группе, получавшей пертузумаб.
Профили кардиальной безопасности между двумя группами были сопоставимыми. Левожелудочковая систолическая дисфункция 3-й степени и выше была отмечена у 2,8% пациентов контрольной группы и у 1,2% пациентов группы, получавшей пертузумаб [27]. На основании этих результатов, пертузумаб утвержден для применения в терапии первой линии при HER2-позитивном МРМЖ в комбинации с трастузумабом и доцетакселом, в т.ч. и в Российской Федерации.
Указанные клинические данные по эффективности привели к проведению проспективных многоцентровых клинических исследований III фазы по оценке эффективности пертузумаба в адъювантном режиме.
Иммуноконъюгаты при HER2-позитивном МРМЖ (T-DM1)
T-DM1 является конъюгатом «антитело-лекарственное средство», состоящим из DM1 (антимикротрубочкового агента, производного майтанзиноида), связанного с трастузумабом через неразрушенные тиоэфирные связи. Т-DM1 доставляет данный сильнодействующий цитотоксический агент конкретно к HЕR2-экспрессирующим клеткам. Как только Т-DM1 связывается с HER2 на поверхности клетки, комплекс T-DM1-HER2 активируется и антитело-компонент протеолитически разрушается, выпуская DM1 в цитоплазму [29]. Важно отметить, что T-DM1 сохраняет биологическую активность трастузумаба (т.е. блокаду HER2-сигнального пути и индукцию антителзависимой клеточной цитотоксичности) [30]. Эти свойства служат биологическим основанием для дальнейшего изучения T-DM1 при HER2-позитивном РМЖ.
В исследовании I фазы, включившем 24 пациента с поздними стадиями HER2-позитивного РМЖ, получавших предварительно интенсивное лечение (в среднем до четырех первичных химиотерапевтических агентов при метастатическом заболевании), оценивалась безопасность и переносимость T-DM1 в трехнедельном режиме с возрастающей дозой [31]. Максимальная переносимая доза (МПД) Т-DM1 равнялась 3,6 мг/кг, причем преходящая тромбоцитопения служила дозолимитирующим проявлением токсичности. Профиль токсичности был благоприятным, при этом общими побочными эффектами 2-й и более низкой степени служили тромбоцитопения, повышение уровня трансаминаз, слабость, тошнота и анемия.
Недавно были доложены положительные результаты рандомизированного исследования III фазы EMILIA (NCT00829166) [32], подтверждающие противоопухолевую активность Т-DM1 при HER2-позитивном МРМЖ. В этом исследовании пациенты (n=991), получавшие ранее трастузумаб и таксаны, были рандомизированы на получение препарата T-DM1 или лапатиниб+капецитабин.
Независимый анализ показал, что в группе, получавшей T-DM1, отмечалось значительное увеличение показателя беспрогрессивной выживаемости (mPFS) по сравнению с группой, получавшей комбинацию лапатиниб+капецитабин (9,6 против 6,4 месяца, ОР=0,65; 95% ДИ – от 0,55 до 0,77; р<0,001). Показатель «частота общего ответа» (ORR) также был выше в группе, получавшей T-DM1 (43,6 против 30,8%; р<0,001), так же как и медиана длительности ответа (12,6 против 6,5 месяца).
Во втором промежуточном анализе значение медианы ОS (mOS) превзошло пороговое значение отсутствия эффективности (30,9 против 25,1 месяца, ОР=0,68; 95% ДИ – от 0,55 до 0,85; р<0,001) в группе, получавшей T-DM1.
Частота токсичных явлений 3-й или 4-й степени в общем была ниже в группе, получавшей T-DM1 (41 против 57%). В группе, получавшей T-DM1, чаще отмечались случаи тромбоцитопении и повышения уровня печеночных ферментов и реже диареи, тошноты, рвоты и ладонно-подошвенного синдрома по сравнению с группой, получавшей лапатиниб+капецитабин.
Хотя результаты исследования EMILIA продемонстрировали достоверные доказательства в пользу препарата T-DM1 в качестве препарата выбора во второй линии терапии HER2-позитивного МРМЖ, в другом рандомизированном исследовании III фазы, MARIANNE (NCT01120184), пытаются доказать возможность использования Т-DM1 в первой линии терапии.
В исследовании MARIANNE, включившем 1092 пациента, сравнивается эффективность комбинаций T-DM1 плюс пертузумаб, T-DM1 плюс плацебо и трастузумаб плюс таксаны. Третье исследование III фазы TH3RESA (NCT01419197) оценивает эффективность T-DM1 в третьей и последующих линиях терапии.
В этом исследовании пациенты с HER2-позитивным МРМЖ, получавшие ранее трастузумаб, лапатиниб или химиотерапию были рандомизированы на получение T-DM1 или терапии по выбору врача. С 14.09.2011 по 19.11.2012 602 пациента были случайным образом распределены в группы лечения (404 в группу лечения трастузумаб эмтанзином и 198 в группу терапии по выбору лечащего врача). На момент среза данных (11.02.2013) 44 пациента, распределенных в группу лечения по выбору лечащего врача, перешли в группу лечения трастузумаб эмтанзином. При медиане периода последующего наблюдения 7,2 месяца (МКД – 5,0–10,1 месяца) в группе трастузумаб эмтанзина и 6,5 месяца (МКД – 4,1–9,7) в группе лечения по выбору лечащего врача, 219 (54%) пациентов в группе лечения трастузумаб эмтанзином и 129 (65%) в группе лечения по выбору лечащего врача перенесли события, связанные с выживаемостью без прогрессирования. Выживаемость без прогрессирования была значимо больше при лечении трастузумаб эмтанзином по сравнению с лечением по выбору лечащего врача (медиана 6,2 месяца [95% ДИ 5,59–6,87] в сравнении с 3,3 месяца [2,89–4,14]; стратифицированное отношение рисков [ОР] 0,528 [0,422–0,661]; p<0,0001). Промежуточный анализ общей выживаемости показал тенденцию в пользу трастузумаб эмтанзина (стратифицированное ОР 0,552 [95% ДИ 0,369–0,826]; p=0,0034), но граница прекращения исследования не была достигнута. При этом медиана общей выживаемости в группе терапии по выбору лечащего врача составила 14,9 месяца, а в группе трастузумаб эмтанзина на момент наблюдения не была достигнута. Эффективность терапии ЛС трастузумаб эмтанзин показана во всех подгруппах пациентов вне зависимости от возраста, состояния пациента по ECOG, гормонального статуса, наличия висцеральных метастазов, количества предшествующих линий терапии и наличия метастазов в головной мозг. Доля пациенток, показавших объективный ответ на терапию ЛС трастузумаб эмтанзин, была значительно выше, чем в группе сравнения, и составила 31%, по сравнению с 9% (разница 22,7%, р<0,0001). Снижение частоты нежелательных явлений 3-й или более степени было отмечено в группе трастузумаб эмтанзина по сравнению с лечением в группе по выбору лечащего врача (32% по сравнению с 43%). Нейтропения (2% по сравнению с 16%), диарея (<1% по сравнению с 4%) и фебрильная нейтропения (<1% по сравнению с 4%) были нежелательными явлениями 3-й и более степеней, которые чаще развивались в группе лечения по выбору лечащего врача, чем в группе лечения трастузумаб эмтанзином. Тромбоцитопения (5% по сравнению с 2%) была нежелательным явлением 3-й и более степеней, чаще встречавшимся в группе лечения трастузумаб эмтанзином. У 18% пациентов в группе трастузумаб эмтанзина и 21% в группе лечения по выбору лечащего врача были зарегистрированы серьезные нежелательные явления [33].
Другие продолжающиеся исследования II фазы в настоящее время изучают возможность и/или противоопухолевый потенциал Т-DM1 в адъювантной (NCTO1196052) и неоадъювантной терапии (NCT01745965) HER2-позитивного РМЖ.
Препарат T-DM1 (Кадсила) зарегистрирован в США, Европейском Союзе и в России для второй линии терапии HER2+МРМЖ у пациентов, ранее получавших трастузумаб и таксаны.
Поколение низкомолекулярных ингибиторов
Нератиниб – пероральный необратимый ингибитор пан-HER TKI of EGFR/HER, HER2 и HER4, находится в стадии клинического исследования.
В исследовании II фазы оценивали эффективность нератиниба у пациентов с HER2-позитивным MРМЖ, которые ранее либо получали терапию трастузумабом (66 пациента), либо не получали (70 пациентов) [34].
Нератиниб продемонстрировал выраженную противоопухолевую активность. Шестнадцатинедельный показатель выживаемости без прогрессирования (PFS) составил 59% для пациентов, которые предварительно получали трастузумаб, и 78% для пациентов, которые не получали трастузумаба. Медиана PFS равнялась 22,3 и 39,6 недели соответственно.
Наиболее частыми побочными эффектами были диарея (чаще 3 и 4-й степеней), тошнота, рвота и слабость. На фоне терапии нератинибом кардиотоксичность 3-й или 4-й степени не наблюдалась. Также оценивалась эффективность применения нератиниба в комбинации с трастузумабом в исследовании I–II фаз, включившем 45 пациентов, которые предварительно получали терапию трастузумабом по поводу HER2-позитивного МРМЖ [35].
В настоящее время проводится исследование III фазы по оценке эффективности нератиниба для пациентов с ранними стадиями HER2-позитивного РМЖ после завершения стандартной терапии трастузумабом в сочетании с адъювантной химиотерапией (NCT00878709).
Афатиниб – еще один перспективный пероральный необратимый ингибитор пан-HER TKI, находящийся в стадии клинического исследования. Одногрупповое исследование II фазы, оценивающее эффективность афатиниба для 41 пациента, получавшего предварительно терапию трастузумабом по поводу HER2-позитивного МРМЖ, при среднем количестве до трех линий химиотерапии (интервал – 0–15) [36]. В данном исследовании продемонстрирована значимая клиническая активность. У 4 (10%) пациентов отмечен частичный регресс (PR), у 15 (37%) пациентов стабилизация процесса как наилучший ответ и показатель mPFS достиг 15,1 недели (95% ДИ – от 8,1 до 16,7 недели). Наиболее частыми побочными явлениями 3-й степени были диарея и сыпь.
В настоящее время продолжаются исследования, оценивающие эффективность применения афатиниба при HER2-позитивном РМЖ.
Блокаторы Pi3k/Akt/mT0R-сигнального пути
Pi3k/Akt/mT0R представляет собой внутриклеточный сигнальный путь передачи сигнала, дерегулирующийся при РМЖ и потенциально отвечающий за развитие резистентности к анти-HER2-блокирующим агентам [37]. На сегодняшний день эверолимус и его аналоги представляют собой наиболее клинически значимые таргетные препараты, направленные на данный сигнальный путь.
В исследовании I фазы проводилось изучение триплета эверолимуса с паклитакселом и трастузумабом, применявшегося еженедельно 33 пациентами, получавшими предварительное лечение (медиана двух линий химиотерапии при МРМЖ в диапазоне от 0 до 17 линий) по поводу HER2-позитивного МРМЖ [38].
Результаты оценки двойной комбинации эверолимуса с трастузумабом при МРМЖ были доложены в объединенном анализе (47 пациентов) двух исследований I–II фаз, проводимых одновременно: показатель CBR равнялся 34% и mPFS 4,1 месяца. Слабость, инфекционные осложнения и мукозиты были наиболее частыми побочными эффектами [39].
В настоящее время продолжаются два исследования III фазы, оценивающих эффективность эверолимуса при HER2-позитивном МРМЖ: исследование BOLERO-1 (NCT00876395), оценивающее эффективность триплета эверолимуса, трастузумаба и паклитаксела в первой линии терапии, и исследование BOLERO-3 (NCT01007942), оценивающее дополнительное значение винорельбина в комбинации с двумя таргетными агентами у пациентов, предварительно получавших лечение.
Важно отметить, что клиническая активность аналогов эверолимуса объясняется их молекулярных механизмом действия, который заключается в ингибировании mTORCl, в то время как mTORC2 остается неповрежденным [40]. Для преодоления этого ограничения в настоящее время проводятся исследования многих таргетных препаратов, блокирующих различные молекулярные компоненты сигнального пути PI3K/Akt/mTOR при HER2-позитивном РМЖ, а именно пан-блокаторы PI3K, блокаторы селективных изоформ PI3K, селективные блокаторы mTORCl/2, двойные блокаторы Р13К/mTOR и ингибиторы Akt [41].
Другие экспериментальные стратегии анти-HER2-блокады
Понимание молекулярной биологии HER2-позитивного РМЖ в сочетании с уточнением молекулярных механизмов резистентности к HER2-блокирующим агентам может привести к разработке эффективных таргетных препаратов.
Продолжающиеся исследования комбинированного применения анти-HER2-таргетных агентов с соединениями, блокирующими другие сигнальные пути, должны в дальнейшем улучшать клинические исходы у пациентов с HER2-позитивным РМЖ.
Представляется перспективным сочетание анти-HER2-терапии с препаратами, блокирующими рецептор инсулиноподобного фактора роста 1 (IGF-1R – insulin-like growth factor-1 receptor). Перекрестный механизм HER2 и IGF-1R хорошо изучен. Ингибирование IGF-1R восстанавливает чувствительность к трастузумабу на доклинических моделях [42, 43].
В настоящее время продолжаются клинические испытания, оценивающие эту гипотезу.
Другой рациональный подход – комбинированная блокада HER2 и SRC, которая представляет собой не связанную с клеточным рецептором тирозинкиназу и является одним из общих механизмов развития резистентности к трастузумабу, как приобретенной, так и развившейся de novo [44]. Блокирование SRC в комбинации с трастузумабом показывает повышенную синергическую противоопухолевую эффективность трастузумаба при трастузумаб-резистентных опухолях in vivo, что свидетельствует о потенциальной клинической значимости данного подхода.
HER3, как уже было показано в доклинических испытаниях, служит еще одной рациональной молекулярной мишенью при HER2-позитивном РМЖ. HER3 – потенциальный активатор PI3K/Akt-сигнального пути, и, как было показано, его активация происходит при HER2-блокаде [45].
В недавнем докладе сообщалось, что двойная HER2-блокада не полностью выключает функцию HER3 в клетках HER2-позитивного РМЖ, и таким образом, добавление анти-HER3-таргетных моноклональных антител к двойной комбинации либо трастузумаб/пертузумаб или трастузумаб/лапатиниб может привести к увеличению противоопухолевой активности [46].
Заключение
Вышеупомянутые данные подчеркивают противоопухолевый потенциал вновь разработанных анти-HER2-таргетных препаратов при HER2-позитивном РМЖ. Двойная HER2-блокада привела к клиническому успеху как при неоадъювантной терапии, так и при терапии МРМЖ.
Изучение новых анти-HER2 конъюгатов «антитело-лекарственное средство» будет способствовать разработке новых вариантов лечения для таких пациентов, достигая потенциальной эффективности химиотерапии в сочетании с HER2-блокадой.
Дальнейшие варианты лечения должны быть направлены на изучение молекулярных механизмов преодоления резистентности к анти-HER2- агентам.
Тем не менее остается ряд нерешенных вопросов: в частности, как можно выбрать лучшую оптимальную стратегию HER2-блокады для конкретного пациента?
Очевидно, что для ответа на этот вопрос необходима разработка надежных предсказательных биомаркеров. На сегодняшний день только HER2 остается подходящим биомаркером для выбора тактики анти-HER2-терапии. В недавнем анализе исследования CLEOPATRA не обнаружено убедительных признаков для применения индивидуальных предсказательных маркеров [22].
Каких из пациентов можно эффективно лечить анти-HER2-препаратами без добавления цитотоксической химиотерапии? Последние данные показывают, что ФДГ-ПЭТ/КТ (18F-фтордезоксиглюкоза-позит-ронно-эмиссионная и компьютерная томография) может служить ценным диагностическим методом для достижения этой цели.
В исследовании NeoALTTO при помощи ПЭТ оценивалась способность картины метаболической реакции в опухоли предсказывать полный патоморфологический регресс (pCR) к моменту хирургического лечения при применении анти-HER2-терапии; частота pCR была в два раза выше у пациентов, у которых регистрировался ответ по данным ФДГ-ПЭТ/КТ с использованием критериев Европейской организации по исследованию и лечению рака [47], по сравнению с пациентами, у которых не наблюдалось ответа (41 против 21% при ПЭТ/КТ, выполненной после 2 недель анти-HER2-терапии без химиотерапии) [48].
Полагаясь на эти многообещающие результаты, Международная группа по раку молочной железы (BIG – Breast International Group) планирует исследование DREAM для определения наиболее эффективной HER2-таргетной стратегии и раннего выявления группы пациентов, которые потенциально могли бы избежать назначения системной химиотерапии.



