Синдром раздраженного кишечника (СРК) считается одним из самых распространенных функциональных заболеваний желудочно-кишечного тракта (ЖКТ). Во всем мире приблизительно 9,8–12,8% взрослого населения, преимущественно женщины, имеют симптомы, соответствующие СРК. Пик заболеваемости приходится на самый активный трудоспособный возраст – 24–41 год [1]. Симптомы СРК продолжаются в течение длительного периода, могут сочетаться с другими функциональными расстройствами, а у части пациентов – с возникновением органического заболевания. Пусковыми факторами CРК признаны воспаление и инфекция ЖКТ, пищевая непереносимость, хронический стресс, дивертикулит, хирургические вмешательства.
В качестве основных звеньев патогенеза СРК, реализующихся при нарушении взаимодействия «кишка–мозг», рассматриваются гипермоторная или спастическая дискинезия кишечника; висцеральная гиперчувствительность; вегетативные и гормональные сдвиги; психосоциальные нарушения; генетические факторы и факторы окружающей среды; а также изменения в составе кишечной микрофлоры, в т.ч. после перенесенных кишечных инфекций с активацией иммунной системы стенки кишечника и формированием субклинического воспаления [2].
В 2016 г. были представлены Римские критерии-IV для диагностики СРК, предполагающие наличие рецидивирующей абдоминальной боли, по крайней мере не реже одного дня в неделю на протяжении последних 3 месяцев с появлением за 6 месяцев до постановки диагноза, ассоциированной с 2 или более симптомами, которая: 1) связана с дефекацией; 2) ассоциирована с изменением частоты стула и 3) изменением формы стула. К дополнительным симптомам относятся патологическая частота стула (менее 3 раз в неделю или более 3 раз в день); патологическая форма стула (комковатый/твердый стул или жидкий/водянистый стул); натуживание при дефекации; императивный позыв или чувство неполного опорожнения кишечника; выделение слизи и вздутие [3]. По сравнению с Римскими критериями-III (2006) в критерии внесены некоторые изменения: убран термин «дискомфорт» в связи с неоднозначностью трактовки его пациентами, увеличена частота появления симптомов до не менее 1 дня в неделю (в предыдущих критериях – 3 дня в течение месяца), а также заменен термин «облегчение» боли после дефекации на ассоциацию с дефекацией, т.к. не у всех пациентов дефекация приводила к уменьшению болей, а могла даже усиливать их.
Согласно Римским критериям-III, в зависимости от преобладания того или иного типа нарушений стула предлагается выделение следующих типов СРК:
- СРК с запором – при наличии твердого или бобовидного кала при более 25% от общего числа опорожнений кишечника, однако допускается и наличие разжиженного (кашицеобразного) или водянистого кала при менее 25% от общего числа опорожнений;
- СРК с диареей, для которого характерно наличие кашицеобразного или водянистого кала при более 25% от общего числа опорожнений кишечника, однако допускается и наличие твердого или бобовидного кала при менее 25% от общего числа опорожнений;
- СРК смешанного типа, при котором имеет место чередование твердого или бобовидного кала и кашицеобразного или водянистого кала при 25% или более от общего числа опорожнений кишечника;
- неклассифицированный СРК – недостаточная выраженность отклонений консистенции кала для вышеуказанных типов [4].
Диагноз СРК должен устанавливаться на основании жалоб пациента (в соответствии Римским критериям-IV), анамнеза, клинической картины, физикального осмотра, минимальных лабораторных тестов и методов инструментальной диагностики при необходимости их проведения. В процессе постановки диагноза должны быть исключены другие заболевания кишечника, кроме дивертикулярной болезни (воспалительные заболевания кишки, целиакия, лактазная и фруктозная недостаточность, микроскопический колит и др.); заболевания других органов пищеварения, а также других органов и систем, при которых имеют место функциональные расстройства кишечника; прием лекарственных препаратов, влияющих на функцию кишечника.
Лечение пациентов с СРК
В настоящее время не существует эффективной схемы лечения пациентов с CРК, обеспечивающей длительную ремиссию заболевания. Это связано с наличием многих факторов, влияющих на течение СРК, таких как расстройства психоэмоциональной сферы (депрессия, тревога); сопутствующие заболевания органов пищеварения и «синдром перекреста» функциональных заболеваний, что нередко требует назначения массы лекарственных препаратов, и задача клинициста заключается в тщательном выборе лекарственных препаратов с учетом особенностей заболевания и побочных эффектов от лекарственных средств. Согласно Римским рекомендациям-IV, медикаментозную терапию предлагается назначать с учетом преобладания у больных СРК тех или иных клинических симптомов.
При любом из вариантов СРК обязательным симптомом служит абдоминальная боль, обусловленная в первую очередь повышением внутрикишечного давления. Поскольку при СРК гипертонус продольной и/или циркулярной мускулатуры кишечника является одним из ведущих механизмов в формировании абдоминальной боли, для нормализации моторных нарушений и купирования боли препаратами выбора признаны миотропные спазмолитики.
В рекомендациях Римских крите-риев-IV для купирования абдоминальной боли предложены следующие препараты (см. таблицу):
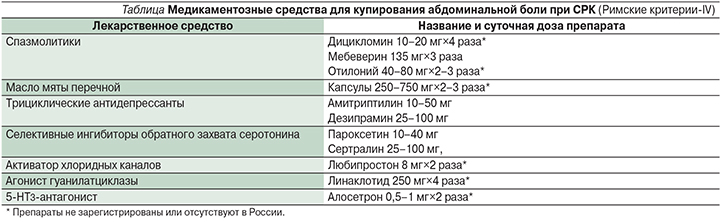
К сожалению, многие из рекомендованных при СРК лекарственных средств не доступны к применению в России. Разрешенные и рекомендованные к применению в нашей стране лекарственные средства для купирования болевого синдрома у больных СРК включают несколько различных по механизму действия классов препаратов: антихолинергические (гиосцина бутилбромид), гладкомышечные миорелаксанты (мебеверин, альверина цитрат), селективные блокаторы кальциевых каналов (пинаверия бромид) и периферические агонисты опиатных рецепторов (тримебутин).
В механизме возникновения абдоминальной боли большая роль отводится висцеральной гиперчувствительности (ВГЧ). Согласно современным представлениям, ВГЧ – это повышенная чувствительность к периферическим стимулам (механическим, термическим, химическим и др.), проявляющаяся появлением болевых ощущений, моторных и секреторных нарушений в ответ на допороговые стимулы. Патофизиологический феномен ВГЧ впервые был обнаружен в 1990-е гг. у больных СРК, и было установлено, что выраженность ВГЧ достоверно коррелировала с симптомами заболевания, а баллонно-дилатационный тест оказался высокоспецифичным и чувствительным методом ее исследования [5]. ВГЧ рассматривается в настоящее время в качестве первичного патофизиологического механизма, который обусловливает формирование и интенсивность абдоминальной боли при СРК. Поэтому при выборе препарата для купирования абдоминальной боли у больных СРК важно принимать во внимание его влияние на ВГЧ.
У значительной части пациентов с наличием абдоминальной боли наблюдается многообразие сочетаний гипер- и гипокинетических дискинезий в различных отделах пищеварительного тракта, что создает значительные трудности при выборе адекватной терапии [6]. К наиболее частым сочетанным нарушениям относятся СРК и функциональная диспепсия (ФД) по типу постпрандиального дистресс-синдрома, что требует назначения, с одной стороны, спазмолитика, с другой – прокинетика. Эпидемиологические данные свидетельствуют о том, что перекрест ФД и СРК может иметь место от 13 до 87% пациентов. Примерно у 27% больных СРК отмечаются симптомы ФД, у 42,1% пациентов с ФД – симптомы СРК, а у 3,5% наблюдается наличие всего комплекса симптомов, характерных как для ФД, так и для СРК [7].
Для купирования таких сочетанных разнонаправленных моторных нарушений перспективным считается использование препаратов, способных нормализовывать моторику независимо от ее исходного состояния в различных отделах ЖКТ, влияющих на висцеральную чувствительность ЖКТ, а также участвующих в антиноцецептивных механизмах контроля боли.
В данной ситуации особое место принадлежит тримебутину. Тримебутин является агонистом периферических µ-, δ- и κ-опиоидных рецепторов, расположенных на гладкомышечных клетках, ганглиях энтеральной нервной системы и интерстициальных клетках Каяла. В зависимости от исходной функциональной активности миоцитов препарат оказывает спазмолитическое или прокинетическое действие. При гиперкинетических состояниях тримебутин связывается с κ-рецепторами, блокирует возбуждающие импульсы нейронов энтеральной нервной системы и угнетает моторику ЖКТ. Конечным этапом спазмолитического его действия является блокада Na+- и Ca2+-каналов гладкомышечных клеток ЖКТ. При гипокинетических нарушениях тримебутин, имея тропность к µ- и δ-рецепторам, блокирует тормозные стимулы из нейронов энтеральной нервной системы и как следствие – стимулирует моторику. Прокинетическое действие тримебутина также может быть связано с восстановлением функциональной активности клеток Каяла, генерирующих потенциалы физиологического ритма кишечника [8]. Также тримебутин оказывает обезболивающий эффект за счет как связывания с κ-рецепторами, так и местного анестетического действия, что приводит к повышению порога болевой чувствительности и снижению ВГЧ у больных СРК [10]. Универсальный модулятор моторики тримебутин позволяет на ранней стадии начать лечение пациентов с функциональными расстройствами ЖКТ, сократить количество и стоимость диагностических процедур для уточнения характера моторных расстройств. Согласно данным, приведенным в первичной документации, пациенты, которым был установлен диагноз функционального расстройства ЖКТ, наиболее часто (66%) получали регуляторы моторики [11]. Важным преимуществом тримебутина является возможность использования его детьми начиная с 3 лет. В терапии СРК показано курсовое назначение тримебутина по 200 мг 3 раза в день за 30 минут до еды в течение 30 и более дней. В качестве поддерживающей может использоваться дозировка препарата в 100 мг 1–2 раза в день.
СРК с диареей
При CРК c диареей отмечается ускоренный транзит химуса по кишке, обусловленный повышением двигательной активности продольного мышечного слоя. Последствия быстрого транзита сводятся к нарушению процессов гидролиза и всасывания компонентов пищи, что приводит к повышению осмолярности кишечного содержимого за счет уменьшения времени контакта ингредиентов пищи с ферментами, избыточному бактериальному росту в кишечнике, увеличению содержания в толстой кишке желчных кислот, а также коротко- и среднецепочечных жирных кислот, накоплению в кишке других раздражающих субстанций [12]. При СРК с диареей рекомендуют диету исключения, которая не содержит кофеин, лактозу, фруктозу, сорбитол, уксус, алкоголь, перец, копчености, а также продукты, вызывающие чрезмерное газообразование. В рекомендациях Римских критериев-IV обсуждается целесообразность использования диеты Low FODMAP, название которой происходит от аббревиатуры Ферментируемые (Fermentable) Олиго- (Oligo-), Ди- (Di-), Моно- (Mono) сахариды и Полиолы (Polyol). Ограничение в пище содержания углеводов, относящихся к группе FODMAP, как было показано в различных исследованиях, оказывает положительное действие при СРК и других функциональных заболеваниях ЖКТ. Для некоторых пациентов с СРК бывает полезным исключение глютена, даже в отсутствие доказательств наличия целиакии (повышенная сенситизация к глютену). Однако исключение пищевых волокон из рациона может оказать и негативное влияние как на рост и развитие микрофлоры, так и в целом на функциональное состояние кишечника. Для улучшения переносимости продуктов, вызывающих избыточное газообразование, может быть использована биологически активная добавка к пище содержащая природный фермент альфа-галактозидазу (АГЗ), который расщепляет проблемные олигосахариды, содержащиеся в овощах, фруктах, бобовых и цельных злаках, являющихся субстратом для избыточного газообразования в кишечнике. Попадая в неизменном виде в толстый кишечник, олигосахариды сбраживаются бактериями с высвобождением избыточного количества газов, что приводит к вздутию, урчанию, боли в животе и послаблению стула. АГЗ обеспечивает отсутствующую в организме человека ферментную активность, предотвращая поступление олигосахаридов в толстый кишечник в нерасщепленном виде. Рекомендован прием 1–3 таблеток АГЗ при употреблении продуктов, вызывающих газообразование. Использование АГЗ позволяет расширить рацион пациентов СРК в период ремиссии и улучшить качество их жизни.
Медикаментозная терапия CРК с диареей включает следующие препараты:
- Лоперамид – агонист µ-опиоидных рецепторов. Снижает частоту стула и улучшает его консистенцию. Используется кратковременно и по требованию. Назначается по 2 мг утром или дважды в день. При необходимости суточная доза может составлять 16 мг.
- Секвестранты желчных кислот – холестирамин 9 г×2–3 раза в день.
В настоящее время в России отсутствует. С этой целью может использоваться диосмектит, универсальный адсорбент и цитопротектор. Назначается по требованию от 3 до 6 пакетиков (3 г) в день.
- Алосетрон (антагонист 5-HT3-серотониновых рецепторов) – разрешен к применению в США и назначается врачами, аккредитованными в специальной программе по лечению СРК. Препарат используется женщинами, страдающими СРК с диареей, не отвечающими на другие антидиарейные препараты. Ограничение применения этого препарата обусловлено возможным развитием опасного, хотя и редкого, осложнения – ишемического колита. В России препарат не зарегистрирован.
- Рифаксимин – невсасывающийся антибактериальный препарат, назначаемый в дозе 400 мг×3 раза в день, по данным многочисленных исследований, существенно снижает выраженность вздутия и диареи. Эффект рифаксимина связывают с устранением синдрома избыточного бактериального роста, часто встречающегося при СРК. Курсы препарата могут назначаться повторно без риска формирования резистентности и развития побочных эффектов.
CРК с запором
При СРК с запором отмечается замедленный транзит химуса за счет гипертонуса циркулярной мускулатуры (спастической дискинезии) толстой кишки. Последствия спастической дискинезии при запоре включают повышение внутрипросветного давления не только в толстой, но и в тонкой и двенадцатиперстной кишке, а также в желудке, что лежит в основе развития сопутствующих функциональных заболеваний при СРК (гастроэзофагеальная рефлюксная болезнь, функциональная желудочная диспепсия, функциональное нарушение сфинктера Одди и др.). Длительный стаз кишечного содержимого приводит к нарушению количественного и качественного состава кишечной микрофлоры [12].
При лечении СРК с запорами Римскими критериями-IV рекомендованы диета с высоким содержанием пищевых волокон или объем-формирующие агенты, к которым относятся препараты псиллиума до 30 мг в раздельных дозах, а также осмотические слабительные – полиэтиленгликоль (17–34 мг в день). Активатор хлоридных каналов (любипростон 8 мг×2 раза в день), агонист гуанилатциклазы (линаклотид 250 мг×4 раза в день), элюксадолин (смешанный агонист µ- и антагонист δ-опиоидных рецепторов) – в России не зарегистрированы [3]. Объемформирующие агенты и осмотические слабительные физиологичны, имеют доказанную базу данных по эффективности при запорах и входят в рекомендации многих гастроэнтерологических сообществ разных стран. Препараты лактулозы, относящиеся к осмотическим слабительным, в связи с наличием побочного эффекта (вздутия) стали использоваться больными CРК с запорами реже. Улучшить качество лечения пациентов с запорами позволяет применение лактитола. Терапия лактитолом позволяет увеличить частоту стула у 90% больных, что связывают с пребиотическим действием препарата. Даже в низких дозах (5–10 мг) у здоровых людей лактитол увеличивает содержание бифидо- и лактобатерий, а также короткоцепочечных жирных кислот. В процессе ферментации лактитола почти в 10 раз по сравнению с препаратами лактулозы увеличивается концентрация бутирата (пропионовой кислоты) [13]. По данным многочисленных исследований установлено, что среди всех известных короткоцепочечных жирных кислот именно бутират обладает доказанным влиянием на моторику кишечника [14]. При использовании лактитол вызывает вздутие, в 2,4 раза меньшее, чем препараты лактулозы. Мета-анализ сравнительных исследований лактитола и лактулозы при лечении запоров позволил сделать выводы, согласно которым лактитол предпочтительнее лактулозы ввиду его более высокой эффективности, по оценке врачей, лучших органолептических свойств, лучшего комплаенса и меньшего числа побочных эффектов [15]. При неэффективности диеты, объемформирующих и осмотических средств в отношении больных СРК используется алгоритм ведения пациентов с функциональным запором, который включает использование раздражающих слабительных (бисакодил, препараты сенны и др.) и прокинетиков (прукалоприд).
Коррекция микрофлоры
Для нормального функционирования ЖКТ определяющим является наличие стабильного и разнообразного состава кишечной микрофлоры.
У пациентов с СРК выявляются некоторые видовые различия в микробиоме, однако четкой связи состава микрофлоры с клинической картиной и вариантами заболевания до настоящего времени не выявлено. Для коррекции состава микрофлоры кишечника используют кишечные антисептики, пре- и пробиотики. Показания к назначению кишечных антисептиков: а) синдром избыточного бактериального роста в тонкой кишке; б) выявление условно-патогенной флоры в кишечнике; в) воспалительные процессы в кишечнике; г) транслокация бактерий за пределы кишки; д) отсутствие эффекта от лечения без проведения деконтаминации кишечника. В этих случаях проводится один или два 7-дневных курса приема кишечных антисептиков широкого спектра действия (рифаксимин, нифуроксазид и др. в общепринятых дозах) со сменой препарата при очередном курсовом лечении. При транслокации бактерий за пределы кишечника приоритетны всасывающиеся антибактериальные препараты (ципрофлоксацин, фуразолидон, доксициклин и др). Одновременно с антибактериальными средствами могут быть назначены пребиотики. После окончания антибактериальной терапии для восстановления микрофлоры толстой кишки целесообразно принимать пробиотики [16]. При выборе препарата следует учитывать, что для оказания положительного воздействия на организм пробиотик должен воспроизводить эффекты многих видов и штаммов полезных микроорганизмов, присутствующих в кишечнике здорового человека, и его действие должно осуществляться на трех уровнях: просвет кишки, эпителий кишечной стенки и иммунная система. В связи с этим предпочтение отдается использованию мультивидовых пробиотиков, состоящих из штаммов различных видов, принадлежащих к разным семействам кишечных бактерий [17]. Любой пробиотик, как правило, назначается 2–3 раза в сутки в течение 2–8 недель.
Коррекция психосоматических нарушений
При СРК чаще назначаются трициклические антидепрессанты (амитриптилин, дезипрамин: стартовая доза – 10 мг, целевая – 10–75 мг). Селективные ингибиторы обратного захвата серотонина (пароксетин, сертралин), несмотря на некоторые сомнения в их эффективности, также используются определенной группой больных СРК. Цели назначения этих препаратов: коррекция психической коморбидности; нормализация висцеральной чувствительности, моторики и секреции ЖКТ; снижение центральной перцепции боли, возникающей из-за афферентных сигналов из кишки, когда симптомы СРК рефрактерны к симптоматическому лечению и психологические факторы способствуют обострению желудочно-кишечных симптомов. Терапия такими препаратами должна продолжаться 6–12 месяцев с постепенным переходом на прием поддерживающей дозы, желательно при участии врача-психотерапевта. Однако наряду с широким спектром положительных влияний эти препараты имеют значительный перечень противопоказаний и побочных эффектов, а также требуют титрования дозы, что ограничивает их применение в общесоматической практике [18].
В связи с этим заслуживают внимания малые нейролептики, к которым относится алимемазин, характеризующийся благоприятным профилем эффективности и безопасности. Алимемазин обладает антигистаминным, спазмолитическим, серотонинблокирующим, умеренным альфа-адреноблокирующим и седативным действиями, благодаря чему снимает тревогу и страх, устраняет вегетативный дисбаланс, способствует нормализации функционального состояния ЖКТ у больных СРК. Назначается по 15 мг/сут в 3 приема в течение 8 недель [19].
При лечении больных СРК используют также дополнительные лечебные процедуры: лечебную физкультуру, физио-, гипнотерапию, методы, основанные на биологической обратной связи, групповое межличностное лечение.



